
- •Введение
- •Основные закономерности химико-технологического процесса.
- •Основные технологические понятия.
- •Технологическая схема.
- •Равновесие в химико-технологическом процессе.
- •Скорость химико-технологических процессов.
- •Кинетика гетерогенных химических реакций.
- •1. Теоретические основы составления балансов хтп.
- •1.1. Классификация хтс:
- •О тсюда
- •1.5. Общие принципы составления материальтного и теплового баланса.
- •1.6. Классификация систем по виду уравнения Данкелера.
- •1 .7. Использование уравнения Дамкелера для составления математической модели хтп.
- •1.8. Совместимость понятий при рассмотрении хтп.
- •2. Катализ в химической технологии.
- •2.2. Гомогеный катализ и его скорость.
- •Способы осуществления экзотермической каталитической реакции по линии оптимальных температур.
- •Химические реакторы.
- •Основные требования к промышленным реакторам.
- •Технологическая классификация.
- •Математические модели основных типов химических реакторов.
- •Реактор периодического действия (рпд).
- •Реакторы непрерывного действия.
- •С с равнение трёх типов реакторов.
- •Каскад реакторов идеального смешения.
- •4. Реальные химические реакторы.
- •4.1.Масштабирование реальных химических реакторов.
- •4.2.Типовые конструкции химических реакторов.
- •4.3.Реакторы для проведения гомогенных реакций в жидкой фазе.
- •4.4.Реакторы для проведения реакций в системе газ/жидкость.
- •4.5.Реакторы для проведения реакций в системе газ/твёрдая фаза.
- •4.6.Реакторы для проведения газовых реакций.
- •4.7.Промышленные печи.
- •5.Сырьё, вода и энергия в химической промышленности.
- •5.1.Сырьё.
- •5.2.Вода.
- •6.Технология серной кислоты.
- •6.1.Нитрозный способ образования серной кислоты.
- •6.2.Контактный метод получения серной кислоты.
- •6.3.Метод двойного контактирования.
Равновесие в химико-технологическом процессе.
По степени происхождения существуют следующие реакции обратимые и необратимые.
Обратимые реакции – это те, для которых существует состояние химического равновесия.
Устойчивое химическое равновесие характеризуется:
-
неизменностью состояния равновесия системы во времени при постоянных внешних условиях;
-
подвижностью равновесия, т.е. самопроизвольным восстановлением состояния равновесия при снятии внешних воздействий, вызвавшего отклонения в системе;
-
динамичностью характера равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов;
-
минимальностью значения энергии Гиббса.

Это вывод закона действующих масс для обратимой реакции, где константа химической реакции Кс выражается через концентрацию.
График №1: «Зависимость концентраций реагента и продукта от времени»
С

 CR*
CR*


СR
CA* СА


На графике СR* и СА* - равновесные концентрации.
СА во времени уменьшается, а СR увеличивается.
Константа химического равновесия для газовых реакций Кр, выражаемая через давление:

Константа химической реакции, выражаемая через число молей:
![]()
При изменении внешних условий равновесие может быть сдвинуто влево или вправо – это называется смещение равновесия.
Принцип Лешателье – в системе, выведенной внешними воздействиями, происходят изменения, направленные на ослабление этих воздействий.
Допущение: если реакция газовая:
Оценим внешние условия:
-
если увеличить температуру, то равновесие сместится влево;
-
если увеличить концентрацию А или В или уменьшить концентрацию R, то равновесие сместится вправо;
-
если в системе увеличить общее давление через объем, то равновесие сместится вправо, т.е. если увеличить объем, зависящий от числа молей в системе, то увеличится и общее давление.
Скорость химико-технологических процессов.
Скорость ХТП по целевому продукту – есть результирующая скоростей прямой, обратной и побочной реакций, а также скорости подвода исходных реагентов в зону реакций и отводу продуктов из этой зоны.
-
Реакция простая, гомогенная, идущая в одну стадию.
Скорость всего процесса равна скорости самой химической реакции.
Скорость химической реакции – это количество молей реагентов (продуктов), израсходованных (образующихся) в единицу времени на единицу объема реакционного пространства (WR):
![]() где
где
![]() объемная
концентрация.
объемная
концентрация.
![]()
![]()
Этим выражение определяется величина скорости химической реакции, т.е. изменение концентрации в единицу времени.
График
Касательная
![]()
![]() это
практический путь определения
это
практический путь определения
![]() .
.
Из графика видно, что WRmax в начале процесса и WRmin, когда концентрация уменьшается.
Факторы, оказывающие влияние на скорость химико-технологического процесса, определяются законами микрокинетики.
Закон действующих масс, в соответствии с которым скорость гомогенной реакции пропорциональна концентрациям исходных реагентов – эта функциональная зависимость называется кинетическим равнением реакции:
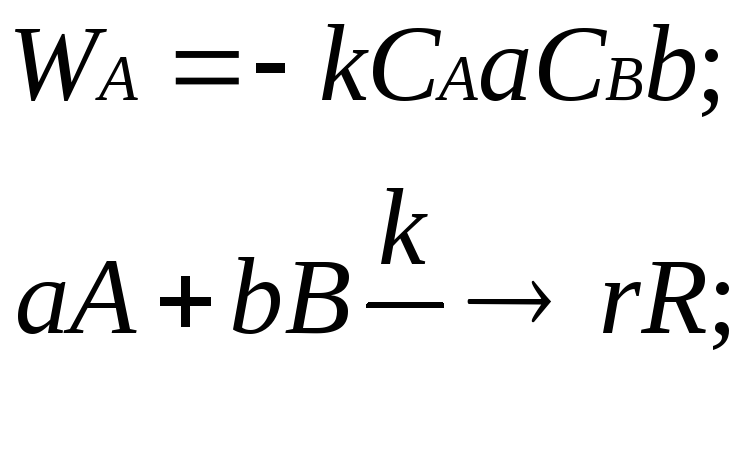
где a+b=порядок реакции (0-3).
-
Реакция сложная, протекающая через ряд параллельных или последовательных элементарных стадий.
Для написания кинетического уравнения этой реакции нужно знать следующие правила:
1) количество кинетических уравнений должно соответствовать количеству реагентов и продуктов, рассматриваемых в реакции;
2) суммарная скорость химической реакции по компоненту определяется алгебраической суммой скоростей тех стадий, в которых он участвует;
-
знак в алгебраической сумме определяется правилом знаков.
Правило знаков – производной концентрацией данного компонента по температуре приписывают знак минус независимо от того является ли этот компонент исходным реагентом или продуктом. В правой части кинетического уравнения скорости тех элементарных стадий, в которых компонент расходуется (т.е. является исходным реагентом) записывается со знаком плюс, а где компонент образуется (т.е. является продуктом) записывается со знаком минус.
-
Сложная последовательная реакция.

Для реакции 2 порядка (реакция элементарная-1 стадия):

Зависимость текущей концентрации от момента времени:

Время превращения:
![]()
Степень превращения:
![]()
Из этого следует:
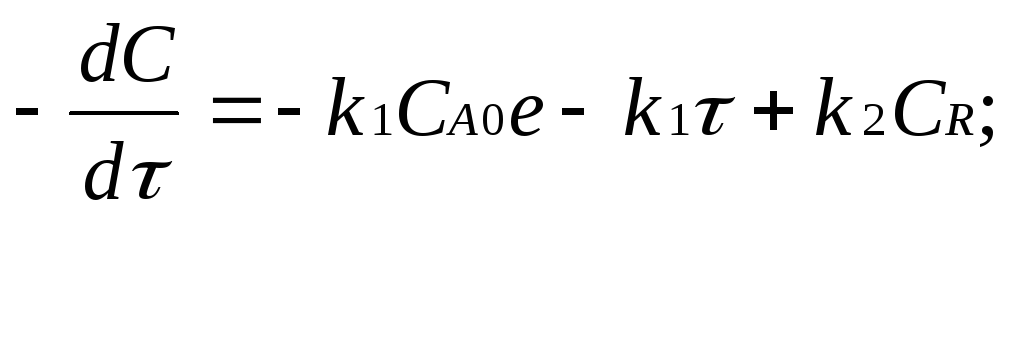
Тогда концентрация промежуточного продукта:

Текущая концентрация конечного продукта:
![]()
![]()
График
Изменение концентрации от времени осуществления химической реакции.
Случаи:
-
если k2k1, то:
![]()
-
если k1k2, то:
![]()
Тогда:

-
Сложная параллельная реакция.

Текущая концентрация исходного реагента:

Случаи:
-
если реакция 0 порядка:

хА- достигнутая степень превращения.
-
если реакция 1 порядка:

-
если реакция 2 порядка:

где М-
это отношение начальных концентраций
А
и B,
![]()
-
если реакция n порядка, кроме 1 (n1):
![]()
Зависимость скорости реакции от температуры.
Уравнение Аррениуса:
![]()
Логарифмируя данное уравнение от Т1 до Т2 и отношения k1 и k2 в итоге получаем:
![]()
где Е – это энергия активации химической реакции.
Энергия активации – это величина энергетического барьера, который нужно преодолеть молекуле, чтобы вступить в химическое взаимодействие (Е).
График
График
![]()
где
![]() - предэкспоненциальный множитель.
- предэкспоненциальный множитель.
![]()
