
- •Введение
- •Основные закономерности химико-технологического процесса.
- •Основные технологические понятия.
- •Технологическая схема.
- •Равновесие в химико-технологическом процессе.
- •Скорость химико-технологических процессов.
- •Кинетика гетерогенных химических реакций.
- •1. Теоретические основы составления балансов хтп.
- •1.1. Классификация хтс:
- •О тсюда
- •1.5. Общие принципы составления материальтного и теплового баланса.
- •1.6. Классификация систем по виду уравнения Данкелера.
- •1 .7. Использование уравнения Дамкелера для составления математической модели хтп.
- •1.8. Совместимость понятий при рассмотрении хтп.
- •2. Катализ в химической технологии.
- •2.2. Гомогеный катализ и его скорость.
- •Способы осуществления экзотермической каталитической реакции по линии оптимальных температур.
- •Химические реакторы.
- •Основные требования к промышленным реакторам.
- •Технологическая классификация.
- •Математические модели основных типов химических реакторов.
- •Реактор периодического действия (рпд).
- •Реакторы непрерывного действия.
- •С с равнение трёх типов реакторов.
- •Каскад реакторов идеального смешения.
- •4. Реальные химические реакторы.
- •4.1.Масштабирование реальных химических реакторов.
- •4.2.Типовые конструкции химических реакторов.
- •4.3.Реакторы для проведения гомогенных реакций в жидкой фазе.
- •4.4.Реакторы для проведения реакций в системе газ/жидкость.
- •4.5.Реакторы для проведения реакций в системе газ/твёрдая фаза.
- •4.6.Реакторы для проведения газовых реакций.
- •4.7.Промышленные печи.
- •5.Сырьё, вода и энергия в химической промышленности.
- •5.1.Сырьё.
- •5.2.Вода.
- •6.Технология серной кислоты.
- •6.1.Нитрозный способ образования серной кислоты.
- •6.2.Контактный метод получения серной кислоты.
- •6.3.Метод двойного контактирования.
6.Технология серной кислоты.
Область применения:
-
травление металлов (снятие оксидной плёнки),
-
производство взрывчатых веществ,
-
получение минеральных удобрений,
-
производство сульфатов, солей различных металлов,
-
очистка нефтепродуктов.
Сырьё:
-
любые серосодержащие соединения, могут быть как естественного, так и искусственного происхождения, а также могут быть твёрдыми и газообразными. Основным сырьём является серный колчедан FeS2,
-
отходящие газы нефтепереработки, содержащие H2S,
-
самородная сера,
-
отходящие газы теплоэлектростанций ( SO2 в небольших количествах).
Этапы:
-
получают диоксид серы (химизм процесса зависит от сырья).
-
окисление SO2 в SO3. эта реакция обратимая, экзотермическая, имеет очень высокую энергию активации, следовательно, необходимо использовать катализатор и соблюдать температурный режим.
6.1.Нитрозный способ образования серной кислоты.
Происходит взаимодействие диоксида серы с трехокисью азота, что приводит к образованию серной кислоты.
S O2
+ N2O3
+ Н2О
H2SO4
+ NO.
O2
+ N2O3
+ Н2О
H2SO4
+ NO.
Данный способ менее распространен, чем контактный.
6.2.Контактный метод получения серной кислоты.
В данном методе имеет место каталитического окисления SO2 в SO3.
Исходное сырьё – серный колчедан.

1 – обжиг колчедана и получение диоксида серы.
4 FeS2
+ 11О2 2Fe2О3
+ 8SО2 + Q,
воздух должен быть в избытке.
FeS2
+ 11О2 2Fe2О3
+ 8SО2 + Q,
воздух должен быть в избытке.
Система газ/ твёрдое – гетерогенна.
Огарок состоит из Fe2О3, FeS2, примесей FeS2.
2 – охлаждение газа в котле-утилизаторе. Реакция идёт с большим выделением количества тепла (3400 кДж/моль), следовательно, необходимо охлаждение.
3 – очистка газа, газ должен быть избавлен от содержащихся в нём ядов и пыли. Очистка здесь многоступенчатая, используются электрофильтры, мокрая очистка и т.п.
4 – осушка газа, то есть удаление из него лишней влаги, это связано с повешением концентрации SО2 в газе и с тем, как будет осуществляться процесс.
5 – подогрев газа. Газ должен быть нагрет до температуры зажигания катализатора (470-480оС).
6 – каталитическое окисление SO2 в SO3.
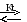
2SО2 + О2 2SО3 + Q.
В ходе процесса образуется смесь газов SO2, SO3.
Выделившаяся энергия тратится на исходный обогрев.
7 – абсорбция с получением готового целевого продукта. Абсорбция идёт уже готовой серной кислотой (98%).
1 и 6 стадии являются химическими, рассмотрим их подробнее.
Первая стадия.
2 FeS2
2FeS + S2,
FeS2
2FeS + S2,
S 2
+ 2O2 2SO2,
2
+ 2O2 2SO2,
4 FeS
+ 7О2 2 FeO3 +
4SО2.
FeS
+ 7О2 2 FeO3 +
4SО2.
Это типичный гетерогенный процесс в системе Г/Т (см. модель фронтального перемещения зоны реакции). Данный процесс лимитируется диффузионной стадией.
Способы интенсификации процесса: дробление (разумное), турбулизация потока.
Оптимальная конструкция реакторов – использование печи кипящего слоя, которые позволяют глубоко производить этот процесс. Но в данном случае существует недостаток: высокая запылённость газа, то есть высокий унос пыли, что приводит к наличию в технологической схеме следующих стадий, таких как очистка (это и простые циклоны, электрофильтры, мокрая очистка, позволяющая практически нацело избавиться от пыли и ядовитых газов). Стадия глубокой очистки необходима для того, чтобы обеспечить эффективное осуществление каталитического процесса окисления SO2 в SO3.
Шестая стадия.
С ростом температуры происходит увеличение скорости химической реакции, поэтому этот процесс необходимо осуществлять по линии оптимальных температур.
Зависимость константы скорости реакции от степени превращения и давления.
 ,
(6.1)
,
(6.1)
где a, b – процентное содержание SO2 и О2 в газе (объемные %).
Из зависимости видно, что рост давления влияет благотворительно.
Механизм реакции идёт по окислительно-восстановительному механизму:
K t
+ О KtO,
t
+ О KtO,
S O2
+ KtO SO2KtO,
O2
+ KtO SO2KtO,
S O2KtO
SO3Kt,
O2KtO
SO3Kt,
S O3Kt SO3
+ Kt.
O3Kt SO3
+ Kt.
В данном случае в качестве катализатора используют V2O5.
М ожно
осуществлять в полочном реакторе (см.
способы осуществления по ЛОТ)
ожно
осуществлять в полочном реакторе (см.
способы осуществления по ЛОТ)
Реально в процессе таких контактов 5-7.
Охлаждение осуществляется исходным более холодным реагентом. В продукте будет присутствовать SO2,SO3,O2 воздуха.
Степень превращения составляет 90-95%.
