
- •Тема 1. Реакционная способность веществ: химия и периодическая система элементов
- •Тема 2. Химическая связь, комплементарность
- •Тема 3. Химическая термодинамика. Энергетика химических процессов
- •Тема 4. Химическая кинетика. Химическое равновесие. Колебательные реакции
- •Тема 5. Химические системы: дисперсные системы, фазовое равновесие
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Электрохимические системы
- •Тема 7. Полимеры и олигомеры
- •Тема 8. Химическая идентификация
Тема 6. Электрохимические системы
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными реакциями (ОВР) называются химические процессы, в ходе которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим частицам (атомам, молекулам, ионам).
Окислителем называется частица, принимающая электроны от другой частицы. Восстановителем называется частица, отдающая свои электроны другой частице.
Окисление - это процесс отдачи электронов.
Восстановление - это процесс присоединения электронов. Из этих определений следует, что в ходе ОВР окислитель восстанавливается, а восстановитель - окисляется.
Метод электронного баланса
Данный метод основан на представлении о степени окисления атома в веществе. Степень окисления - это условный заряд атома, найденный исходя из предположения, что все связи в веществе чисто ионные. Степень окисления обозначается арабской цифрой со знаком (+) или (-).
Ионной связи в чистом виде в природе не существует. Например, в кристаллическом хлориде натрия (NaCl), натрий имеет реальный заряд +0,8 , а хлор (-0,8) заряда электрона по модулю. Отсюда следует, что степени окисления натрия (Na+) и хлора (Cl-) являются понятием формальным.
Тем не менее, метод электронного баланса в настоящее время широко используется, так как он наиболее прост и универсален. Практически единственным ограничением этого метода является то, что он позволяет уравнивать только полные схемы реакций.
Правила нахождения степеней окисления
Для применения метода электронного баланса необходимо знать степени окисления всех атомов в формулах веществ (исходных и продуктов реакции). Степени окисления находятся с использованием следующих правил:
1. Cтепень окисления атома в простом веществе равна нулю:
H![]() ;
N
;
N![]() ;
Mg
;
Mg![]() ;
C
;
C![]() и т.д.
и т.д.
2. Сумма степеней окисления всех атомов в формульной единице вещества (молекуле) равна нулю.
K![]() Cr
Cr![]() O
O![]() 2
(+1) + 2
(+6) + 7
(-2) = 0
2
(+1) + 2
(+6) + 7
(-2) = 0
Чтобы воспользоваться этим правилом необходимо запомнить перечень химических элементов, атомы которых во всех (или почти во всех) их соединениях имеют одну и ту же степень окисления.
|
Степень окисления атома элемента в соединениях |
Исключения |
|
Li+, Na+, K+, Rb+, Cs+, Fr+ |
|
|
Be+2, Mg+2, Ca+2, Sr+2, Ba+2, Ra+2 |
|
|
Al+3, Ga+3, In+3 |
Al+, Ga+, In+ - очень редко |
|
Ag+, Zn+2, Cd+2 |
Ag+2 - очень редко |
|
F- |
|
|
H+ |
H- - в гидридах (NaH и т.п.) |
|
O-2 |
O- - в пероксидах (H2O2,, K2O2 и т.п.) O-1/2 - в надпероксидах (KO2 и т.п.) O-1/3 - в озонидах (KO3) O+, O+2 - во фторидах кислорода (O2F2, OF2) |
Возвратимся к
приведенному выше примеру: K![]() Cr
Cr![]() O
O![]() .
.
Cтепени окисления калия и кислорода найдены по таблице. Далее применяем правило электронейтральности молекулы: 2 (+1) + 2 x + 7 (-2) = 0. Отсюда: x = +6.
3. Степени окисления атомов в кислотных остатках такие же, как в соответствующих им кислотам. Это правило является следствием определения кислотного остатка: кислотный остаток - это часть молекулы кислоты, перешедшая в соль без изменений.
Пример: MnySxO![]() .
.
Вначале находим
х. Кислотный остаток (сульфат) соответствует
серной кислоте - H![]() S+6O
S+6O![]() .
.
Теперь, по правилу электронейтральности молекулы можно найти степень окисления марганца: y + 6 + 4 (-2) = 0; y = +2.
Алгоритм метода электронного баланса
1. Написать схему реакции. Схема реакции - это условное химическое выражение, в котором слева указаны исходные вещества, справа - известные продукты реакции. Между правой и левой частями схемы ставится знак “стрелка”. Схема может быть полной (известны все продукты) и неполной (известна только часть продуктов). Метод электронного баланса позволяет работать только с полными схемами. Единственным веществом, которое можно не указывать в схеме является вода.
Пример: Cu + HNO3 Cu(NO3)2 + NO + . . . .
(многоточие означает, что в правой и левой части окончательного уравнения может появиться вода).
2. Над каждым атомом в схеме поставить степени окисления:
Cu0
+ H+1N+5O![]()
Cu+2(N+5O
Cu+2(N+5O![]() )2
+ N+2O-2
+ . . . .
)2
+ N+2O-2
+ . . . .
3. Найти атомы, изменившие свои степени окисления. Составить для них уравнения электронных переходов:
Cu0
+ H+1N+5O![]()
Cu+2(N+5O
Cu+2(N+5O![]() )2
+ N+2O-2
+ . . . .
)2
+ N+2O-2
+ . . . .
Cu0
- 2![]() = Cu+2,
= Cu+2,
N+5
+ 3![]() = N+2
.
= N+2
.
4. Сделать электронный баланс (подобрать коэффициенты, на которые нужно умножить уравнения электронных переходов, чтобы число электронов, ушедших от восстановителей, было равно количеству электронов, принятых окислителем).
 Cu0
- 2
Cu0
- 2![]() = Cu+2
3
= Cu+2
3
N+5
+ 3![]() = N+2
2
= N+2
2
Из электронного баланса следует, что в левой части полученного уравнения на каждые 3 атома восстановителя (Cu+2) должно приходиться 2 атома окислителя (N+5). В правой части будущего уравнения на 3 атома Cu+2 должно приходиться 2 атома N+2.
5. В схеме реакции поставить первые коэффициенты в соответствии с электронным балансом (там, где это возможно !).
3Cu + HNO3 3Cu(NO3)2 + 2NO + . . . .
Обратите внимание: из четырех теоретически возможных коэффициентов указаны только три. Перед азотной кислотой коэффициент пока неизвестен, т.к. N+5 ведет себя сложным образом: с одной стороны принимает участие в ОВР (это учтено в электронном балансе), а с другой - переходит без изменений в нитрат меди (Сu(NO3)2) (это не учтено в электронном балансе, т.к. при этом степень окисления азота не меняется).
6. Уравнять по всем атомам, кроме водорода и кислорода. При этом произвольное изменение коэффициентов, полученных из электронного баланса недопустимо.
3Cu + 8 HNO3 3Cu(NO3)2 + 2NO + . . . .
7. Уравнять по водороду. Это делается только одним способом: добавлением соответствующего числа молекул воды в ту часть схемы, где водорода не хватает. В данном примере слева 8 атомов водорода, а справа - нуль. Молекула Н2О содержит 2 атома водорода:
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O.
8. Полученное выражение должно быть уравнением ОВР, если до того не было допущено ошибки. Необходимо проверить данное уравнение по кислороду. Если справа и слева количество атомов кислорода одинаково, вместо “стрелки” ставим знак “равно” (это уравнение). Если по кислороду не сошлось, то следует повторить уравнивание, начиная с пункта 1.
Окончательное уравнение:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электродные потенциалы
Если кусочек металла погрузить в водный раствор его соли, то металл относительно раствора приобретет некий потенциал (называемый электродным потенциалом). При этом в системе установится равновесие между гидратированными ионами металла Me+z в растворе и атомами металла в твердой фазе:
![]()
Me+z (aq) + ze- Me(тв)
В данной системе кусок металла является электродом (активным электродом, т.к. частицы, из которых он состоит могут обратимо переходить в раствор в виде ионов).
Величина электродного потенциала зависит от многих факторов. В специальных таблицах приведены значения стандартных электродных потенциалов (E), измеренных при стандартных условиях (T = 298 K, p = 1,013.105 Па, концентрация ионов [Me+z] = 1 моль/л).
Если условия отличаются от стандартных, то электродный потенциал (E) электрода можно рассчитать по уравнению Нернста:
![]()
E = E +
где: E - стандартный электродный потенциал,
T - температура,
R - универсальная газовая постоянная,
F - постоянная Фарадея (96 485 Кл/моль),
z - количество электронов, принимающих участие в элементарном окислительно-восстановительном акте на электроде.
Величина электродного потенциала определяет термодинамическую возможность и направление протекания ОВР на данном электроде в электрохимической системе.
Гальванические элементы
Гальванические элементы являются химическими источниками электрической энергии. При работе гальванических элементов энергия ОВР преобразуется в электроэнергию. Принцип действия гальванических элементов рассмотрим на примере элемента Даниэля-Якоби (см. рисунок), в котором протекает окислительно-восстановительная реакция:
Zn + Cu+2 = Zn+2 + Cu
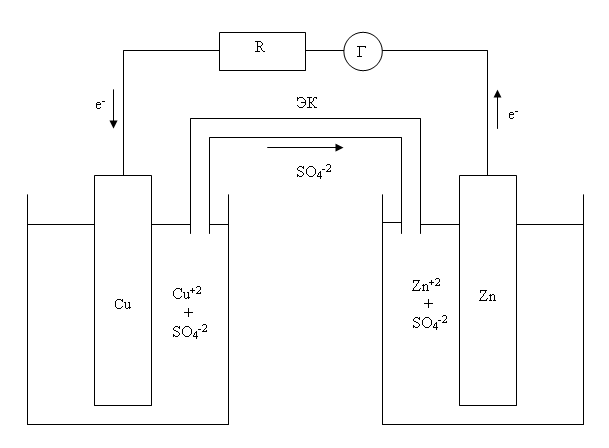
Этот гальванический элемент состоит из цинкового электрода, погруженного в раствор ZnSO4 и медного электрода, погруженного в раствор CuSO4. Растворы соединены между собой электролитическим ключом (ЭК)- устройством, позволяющим ионам SO4-2 переходить из одного раствора в другой. Оба раствора и электролитический ключ являются внутренней цепью гальванического элемента. Внешняя цепь в данном случае состоит из металлических проводов, резистора (R) и гальванометра (Г). Если внутренняя и внешняя цепи гальванического элемента замкнуты, то гальванометр регистрирует наличие во внешней цепи электрического тока. При этом на электродах самопроизвольно протекают процессы:
анод (-) Zn (тв) - 2e- = Zn+2 (aq)
катод (+) Cu+2 (aq) + 2e- = Cu (тв) .
Катод имеет положительный заряд, а анод - отрицательный. При работе гальванического элемента в раствор ZnSO4 переходят избыточные ионы Zn+2, а в растворе CuSO4 появляются избыточные анионы SO4-2. Через электролитический ключ ионы SO4-2 переходят из раствора CuSO4 в раствор ZnSO4. В гальваническом элементе Даниэля-Якоби цинковая пластина - активный электрод, а медная - инертный.
ЭДС гальванического элемента (E) равна разности электродных потенциалов катода и анода: E = Eк - Eа .
ЭДС элемента Даниэля-Якоби при стандартных условиях (T = 298 K, p = 1,013.105 Па, [Zn+2] = [Cu+2 ] = 1 моль/л) равна разности стандартных электродных потенциалов цинка и меди:
E = E(Zn+2/Zn) - E(Cu+2 /Cu) = + 0,34 В - (- 0,76 В) = 1,1 В .
Аккумуляторы
Аккумуляторами называются называются гальванические элементы, предназначенные для многократного использования. При заряде аккумулятора реагенты регенерируют в результате пропускания через систему электрического тока от внешнего источника в направлении, обратном направлению тока при разряде.
Способность к регенерации обеспечивают подбором таких реагентов, которые в окисленной и восстановленной формах трудно растворимы в жидкости, находящейся между электродами. Поэтому продукты электрохимических реакций осаждаются на тех же электродах, на которых они образуются. В результате не происходит смешивания этих продуктов и нарушения целостности электродов.
Большое практическое значение имеет свинцовый аккумулятор, состоящий из нескольких одинаковых ячеек. Устройство ячейки свинцового аккумулятора изображено на рисунке:
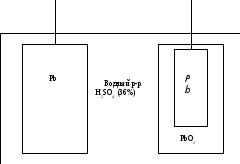
При работе свинцового аккумулятора (разряде) на электродах идут процессы:
анод (-) Pb + SO4-2 + 2e-= PbSO4
катод (+) PbO2 + 4H+ + SO4-2 + 2 e- = PbSO4+ 2H2O .
ЭДС этой системы при комнатной температуре около 2 В.
Для зарядки через аккумулятор пропускают постоянный электрический ток (на катод подается положительный потенциал, на анод - отрицательный). При этом на электродах протекают те же полуреакции, но в обратном направлении.
Электролиз
Электролизом называются окислительно-восстановительные реакции, протекающие при прохождении электрического тока через жидкость, содержащую ионы. Ионы могут появиться в жидкой среде при растворении электролита в полярном растворителе (электролитическая диссоциация) или при переходе ионогена в жидкое состояние (термическая ионизация).
Электролиз сводится к разрядке ионов на соответствующих электродах. При электролизе анод имеет положительный заряд, а катод - отрицательный (сравните с гальваническим элементом !).
Пример 1: электролиз расплава хлорида натрия. Жидкий NaCl состоит из ионов Na+ и Cl- Если в этот расплав погрузить два электрода и пропускать электроток от внешнего источника, то на электродах будет протекать ОВР разложения соли:
2Na+
+ 2Cl-
![]() 2Na + Cl2
2Na + Cl2
анод (+) 2Cl- - 2e- = Cl2
катод (-) 2Na+ + 2e- = 2Na
Данный пример является простейшим, так как в токопроводящей жидкости присутствуют катионы одного вида и анионы одного вида. Других частиц, способных к разрядке в данной среде нет.
Пример 2 : электролиз водного раствора хлорида натрия. В этой системе кроме ионов Na+ и Cl- присутствуют ионы H+ и OH- (автоионизация воды):
![]() H2O
H+
+ OH-
H2O
H+
+ OH-
В данном растворе присутствуют 2 частицы, теоретически способных к восстановлению и 2 частицы, в принципе способных к окислению. В такой ситуации пользуются правилами:
1) на аноде более вероятен тот процесс, для которого электродный потенциал меньше;
2) на катоде более вероятен тот процесс, для которого электродный потенциал больше.
Среда в рассматриваемом растворе нейтральная ([H+] = [OH-] = 10-7 моль/л). Если концентрация NaCl растворе 1 моль/л, то электродные потенциалы (E) четырех возможных процессов (полуреакций) будут следующими:
возможные анодные процессы
2Cl-- 2e- = Cl2 E1 = E = + 1,36 В
2H2O - 4e- = 4H+ + O2 E2 + 2 В (E2 больше стандартного значения для этой полуреакции E = + 1,23 В засчет явления перенапряжения);
возможные катодные процессы
Na+ + e- = Na E3 = E = - 2,71 В
2H+ + 2e- = H2 E4 = - 0,41 В (E4 меньше стандартного значения для этой
полуреакции E = 0 В засчет того, что [H+] = 10-7 моль/л) .
Сравнение величин электродных потенциалов приводит к выводу о том, что электролиз водного раствора хлорида натрия будет протекать по схеме:
анод (+) 2Cl-- 2e- = Cl2
катод (-) 2H+ + 2e- = H2
2 NaCl
+ 2H2O
![]() Cl2
+ H2
+ 2 KOH
Cl2
+ H2
+ 2 KOH
На аноде будет выделяться газообразный хлор, на катоде - газообразный водород, в растворе будет накапливаться щелочь (гидроксид калия).
В примере №2 электродные потенциалы конкурирующих полуреакций (E1 и E2 , E3 и E4 ) существенно отличны (|E1-E2|=0,64В, |E3-E4|=2,29В). Если абсолютное значения модуля разности конкурирующих полуреакций не превышает 0,2-0,3В, то в этом случае обычно наблюдается параллельное протекание нескольких процессов на данном электроде. Кроме того, в ряде случаев следует учитывать изменение электродных потенциалов в ходе электролиза (по уравнению Нернста), так как реагенты, принимающие участие в процессах на электродных расходуются и их концентрация постепенно уменьшается.
Массу вещества (m), выделившегося на электроде в ходе электролиза можно рассчитать по закону Фарадея:
m =![]() ,
,
где I - сила тока (A),
t - время (с)
F - постоянная Фарадея (96485 Кл/моль)
M - молярная масса вещества (г/моль).
z - число электронов, принимающих участие в образовании одной молекулы (или одной формульной единицы) вещества.
Физико-химический смысл постоянной Фарадея: F равна заряду 1 моля электронов.
