
- •Тема 1. Реакционная способность веществ: химия и периодическая система элементов
- •Тема 2. Химическая связь, комплементарность
- •Тема 3. Химическая термодинамика. Энергетика химических процессов
- •Тема 4. Химическая кинетика. Химическое равновесие. Колебательные реакции
- •Тема 5. Химические системы: дисперсные системы, фазовое равновесие
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Электрохимические системы
- •Тема 7. Полимеры и олигомеры
- •Тема 8. Химическая идентификация
ВОРОНЕЖСКАЯ ГОСУДАРСТВЕННАЯ ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ
И.Н.НАЗАРЕНКО
ЛЕКЦИИ ПО ХИМИИ
ДЛЯ СТУДЕНТОВ
СПЕЦИАЛЬНОСТИ 230201
“Информационные системы и технологии”
Воронеж
2010
Тема 1. Реакционная способность веществ: химия и периодическая система элементов
Химический элемент - вид (сорт) атомов, характеризующийся строго определенным зарядом ядра. Например, все атомы, ядро которых имеет заряд +6, называются химическим элементом “углерод”.
Химические свойства атомов определяются их электронным строением. Поведение электрона в атоме описывается специальной наукой, которая называется квантовая механика. В основу квантовой механики положена гипотеза Луи де Бройля о волново-корпускулярном дуализме микрочастиц (электронов, протонов, нейтронов и т.п.). Исходя из этой теории электрону присущи как свойства вещества(масса, заряд), так и свойства волны. Следствием волнового поведения электрона в атоме является то, что его местонахождение в пространстве нельзя точно определить. Можно говорить лишь о вероятности нахождения этой частицы в некотором объеме. Поведение электрона в атоме как волны описывается уравнением, предложенным Шредингером в 1925 г. Это сложное математическое выражение , решением которого являются орбитали.
Атомная орбиталь - это состояние электрона в атоме. Состоянием электрона называется его энергия и область пространства, в которой электрон находится с вероятностью 90 %.
Решение уравнения Шредингера удобно получать в виде квантовых чисел, которые могут иметь следующие значения:
1. Главное квантовое число (n)
n = 1, 2, 3, 4, . . . . . .
2. Побочное (орбитальное) квантовое число (l)
l = 0, 1, 2, 3, . . . . . . (n - 1) .
Для значений орбитального квантового числа часто используются буквы:
l = 0, 1, 2, 3, 4, 5 . . . . . .
s, p, d, f, q, h . . . . . .
3. Магнитное квантовое число (m)
m = 0, 1, 2, 3, . . . . . . l или
m = -l . . . -3, -2, -1, 0, +1, +2, +3 . . . +l .
Каждый разрешенный набор из этих трех квантовых чисел описывает одну орбиталь.
Для описания электрона в атоме существует еще одно квантовое число - спиновое квантовое число (s), которое может принимать два значения: - 1/2 и + 1/2.
Cпин - это особое свойство материи (подобное массе или заряду). Что такое спин объяснить невозможно (попробуйте объяснить, что такое «электрический заряд» ).
Все электроны подчиняются принципу Паули: 2 электрона в данном атоме не могут иметь абсолютно одинаковый набор из четырех квантовых чисел (n, l, m, s). Следствием принципа Паули является то, что состояние электрона в атоме однозначно описывается строго определенным набором из четырех квантовых чисел. По принципу Паули на одной орбитали могут одновременно находиться не более двух электронов, причем с разными спинами (-1/2, +1/2).
Квантовые числа определяют следующие параметры орбиталей:
1. Форма орбитали определяется орбитальным квантовым числом (l):
l = 0 s - форма (шарообразная)
l = 1 p - форма (гантелеобразная)
2. Ориентация орбитали в пространстве задается магнитным квантовым числом (m).
3. Энергия орбитали определяется квантовыми числами n и l по правилам Клечковского:
I правило Клечковского: чем меньше сумма (n + l), тем ниже по энергии данная орбиталь.
II правило Клечковского: если у нескольких орбиталей сумма (n + l) одинакова, то меньшую энергию имеет та, у которой меньшее значение n.
Следствием из правил Клечковского является то, что орбитали, входящие в данный подуровень, имеют абсолютно одинаковую энергию. Это нетрудно доказать. Рассмотрим орбитали 2 р- подуровня. У этих трех орбиталей одинаковые значения n и l (n = 2, l = 1). Как первое, так и второе правила Клечковского дают равенство по энергии 2рx, 2py, 2pz - орбиталей. Поэтому имеет смысл сравнивать по энергии не отдельные электронные орбитали, а целые подуровни.
Применение правил Клечковского дает следующую последовательность заполнения подуровней электронами:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d . . . . Зная эту последовательность можно написать электронную формулу атома любого элемента Периодической системы или его иона. Для этого необходимо заполнить приведенную выше последовательность слева направо с учетом того, что максимальная емкость любого s - подуровня равна 2 электронам, любого р - подуровня 6 электронам, любого d - подуровня 10 электронам, любого f - подуровня 14 электронам.
Примеры: 1) Написать электронную формулу атома серы.
Сера имеет порядковый номер в Периодической системе равный 16. Значит, атом серы имеет 16 электронов.
Электронная формула атома S : 1s2 2s2 2p6 3s2 3p4.
2) Написать электронную формулу иона Mn+2.
Марганец имеет № 25. В атоме марганца 25 электронов. Ион имеет на 2 электрона меньше, чем атом : 1s2 2s2 2p6 3s2 3p6 4s2 3d3.
Более точным способом описания электронного строения атома (или иона) является энергетическая диаграмма.
Заполнение орбиталей электронами происходит в соответствии с 3-мя законами (правилами):
1. Принцип наименьшей энергии (два правила Клечковского).
2. Принцип Паули.
3. Правило Хунда: в пределах одного подуровня электроны распределяются таким образом, чтобы их суммарный спин по модулю был максимален.
Пример: Энергетическая диаграмма атома железа.
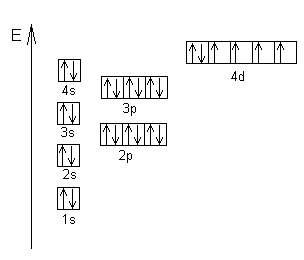
По электронному строению все элементы Периодической системы делятся на 4 типа: s - элементы, p - элементы, d - элементы и f - элементы. Если последний электрон в атоме (имеющий наибольшую энергию) является s - электроном, то данный элемент называется s - элементом. Например, все щелочные металлы являются s - элементами. Аналогично определяются p-, d-, f - элементы.
Отметим, что из 105 элементов Периодической системы 20 имеют отклонения от правил Клечковского в заполнении подуровней. Отклонения относительно небольшие (1 - 2 электрона) и встречаются только у d и f - элементов.
Пример. Хром должен был иметь электронную формулу:
1s2 2s2 2p6 3s2 3p6 4s2 3d4 . Реально хром имеет: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 .
Все элементы Периодической системы делятся на металлы и неметаллы. Металлы - это элементы, которые никогда не проявляют отрицательных степеней окисления. Более 80 химических элементов являются металлами. Неметаллы хотя бы в одном своем соединении имеют отрицательную степень окисления. Такое деление является несколько формализованным, так как понятие степени окисления само по себе условно.
Деление элементов на металлы и неметаллы можно осуществить, исходя из значений их электроотрицательности (ЭО). Наиболее просто электроотрицательность рассчитывается по уравнению:
![]()
ЭО =
где ЕI - энергия ионизации атома (энергия, которую необходимо затратить для отрыва электрона от атома); EC - энергия сродства к электрону (энергия, которая выделяется при присоединении к атому электрона).
Как правило, пользуются не абсолютными значениями ЭО, рассчитанными по приведенному выше уравнению, а относительными ЭО (ОЭО). За единицу измерения принято считать ЭО атома лития. Тогда ОЭО элемента Х можно найти как:
ОЭО(Х) = ЭО(Х) / ЭО(Li) .
Значения ОЭО для большинства элементов приведены в таблице 1. Из таблицы 1 видно, что ОЭО металлов лежат в промежутке 0,7 - 2,3 , а неметаллов 1,7 - 4,0. Следовательно, границу между металлами и неметаллами можно провести приблизительно) при значении ОЭО = 2 0,3 .
Одним из важнейших научных обобщений в химии является Периодический закон Д.И.Менделеева. Современная формулировка его выглядит следующим образом: свойства элементов, а также их соединений находятся в периодической зависимости от зарядов их ядер. Иначе, при монотонном увеличении заряда ядра свойства элементов примерно повторяются через определенный промежуток (период).
Например, при увеличении заряда ядра от +3 (Li) до +10 (Ne), свойства элементов резко изменяются от типично металлических (Li, Be) до свойств сильных неметаллов (N, O, F). Но затем у элемента № 11 (Na) происходит возврат к свойствам сильного металла. Кроме того, многие химические свойства лития и натрия довольно схожи.
Свойства элемента определяются электронным строением их атомов. Все входящие в атом электроны можно разделить на валентные и невалентные. Валентными являются электроны внешних s- и p- подуровней, а также незавершенных (частично заполненных) d- и f- подуровней. Именно валентные электроны определяют химическое поведение данного элемента. Все остальные электроны в атоме являются невалентными. Они не принимают участия в химических взаимодействиях.
Физической причиной периодичности свойств элементов является периодическое повторение сходных электронных структур при монотонном увеличении заряда атомного ядра.
Графическим отображением Периодического закона является Периодическая система элементов (ПСЭ). ПСЭ имеет четкую внутреннюю организацию. В ней выделяются периоды, группы и подгруппы.
Период - это ряд элементов с последовательно увеличивающимися номерами (зарядами ядер), внутри которого свойства изменяются от свойств щелочного металла до свойств благородного газа.
Подгруппа включает элементы, имеющие одинаковое строение валентных уровней. Элементы одной подгруппы, как правило, очень похожи по химическим свойствам. Подгруппы делятся на главные и побочные. Главные подгруппы включают только s или p - элементы. Побочные подгруппы содержат только d и f - элементы.
Группа объединяет элементы одной главной и одной побочной подгрупп. Например, VI группа ПСЭ включает главную подгруппу (VIA): O, S, Se, Te, Po и побочную подгруппу (VIB): Cr, Mo, W. Элементы главной и побочной подгрупп одной группы могут быть похожи по химическим свойствам только в тех соединениях, где они имеют валентность, равную номеру группы. Во всех остальных соединениях элементы разных подгрупп очень непохожи.
Для ПСЭ известны следующие тенденции в изменении свойств элементов и их соединений при движении по периоду (слева направо) и главной подгруппе (сверху вниз):
1. В пределах периода металлические свойства ослабевают, а неметаллические усиливаются. В главной подгруппе металлические свойства усиливаются, а неметаллические ослабевают.
2. В периоде свойства высших оксидов меняются от типично основных до типично кислотных (высшим соединением элемента называется такое, в котором он проявляет валентность, равную номеру группы). В периоде свойства высших гидроксидов меняются от основных до кислотных. Гидроксидом называется неорганическое соединение, состоящее из атомов трех элементов: водорода, кислорода и любого третьего элемента (например: KOH; Al(OH)3; H2SO4).
3. В главной подгруппе основные свойства оксидов усиливаются, а кислотные ослабевают. В главной подгруппе основные свойства гидроксидов усиливаются, а кислотные ослабевают.
4. Характер оксидов и гидроксидов одного элемента зависит от его степени окисления. Чем она выше, тем сильнее в данном соединении выражены кислотные свойства. Чем ниже степень окисления, тем более вероятно наличие основных свойств.
5. В главной подгруппе сила бескислородных кислот увеличивается. Например, в ряду HF, HCl, HBr, HJ самой слабой кислотой является HF, а самой сильной HJ.
6. В главной подгруппе сила кислородсодержащих кислот уменьшается. Например, в ряду H2SO4, H2SeO4, H2TeO4, H2PoO4 самой сильной является серная кислота, а самой слабой - полониевая.
7. В периоде энергия ионизации и энергия сродства к электрону увеличиваются. Поэтому увеличивается и ОЭО. В главной подгруппе энергия ионизации, энергия сродства к электрону и ОЭО уменьшаются.
