
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
Электронные эффекты заместителей
|
Заместитель |
Электронные эффекты |
Характер совместно го действия |
|
|
индуктивный |
мезомерный |
||
|
Алкильные группы (R) |
+I |
− |
}Электронодонорный |
|
−О− |
+I |
+M |
|
|
−NH2, −NHR, −NR2 |
−I |
+M |
|
|
−ОH |
−I |
+M |
|
|
Алкоксигруппы (−ОR) |
−I |
+M |
|
|
−NH3+, −NR3+ |
−I |
− |
}Электроноакцепторный |
|
Галогены (F, Cl, Br, I) |
−I |
−M |
|
|
−NО2 |
−I |
−M |
|
|
−SО3H |
−I |
−M |
|
|
−COOH, −COOR |
−I |
−M |
|
|
>C=O |
−I |
−M |
|
С помощью табл. 6 можно прогнозировать характер изменения электронной плотности на реакционном центре молекулы, вызванного заместителем.
Особое значение
явление делокализации электронной
плотности имеет для сопряженных
систем. Сопряжение - это образование
единого электронного облака в результате
взаимодействия негибридизованных
![]() -орбиталей
в молекулах с чередующимися двойными
и одинарными связями.
-орбиталей
в молекулах с чередующимися двойными
и одинарными связями.
Различают два типа сопряженных систем (и сопряжений).
1.![]() ,
,![]() -Сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бутадиена участвуют четыре атома
углерода:
-Сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бутадиена участвуют четыре атома
углерода:
![]()
Делокализация электронов в молекуле бензола происходит с участием шести атомов углерода:
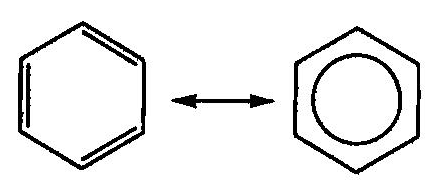
Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль.
2. p,![]() -Сопряжение
— в делокализации принимают участие
электроны
-Сопряжение
— в делокализации принимают участие
электроны
![]() -связи
и р-орбитали гетероатома; например, в
молекулах ацетамида и пиррола:
-связи
и р-орбитали гетероатома; например, в
молекулах ацетамида и пиррола:
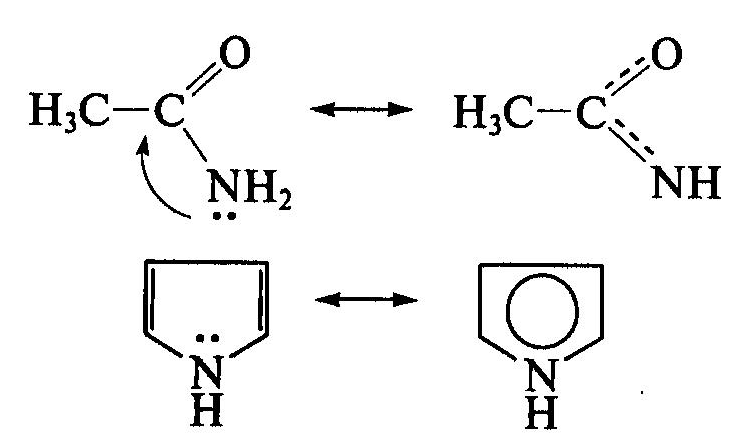
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N с неподеленной электронной1 парой). Чем длиннее система сопряжения, тем более она устойчива.
§ 2.3. Системы с замкнутой цепью сопряжения.
(Самостоятельная работа студентов)
Среди циклических сопряженных систем наибольший интерес представляет группа соединений, отличительной чертой которых является повышенная термодинамическая устойчивость по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичности. К ним, в первую очередь, относится способность таких формально ненасыщенных соединений вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры. Циклы этих систем по химическому строению могут быть только углеродными (арены и их производные) или содержать еще гетероатомы (гетероциклические соединения), и в них может осуществляться как π,π-, так и ρ,π- сопряжение.
Арены и их производные. Особенности электронного строения ароматических углеводородов (аренов) наиболее наглядно проявляются в атомно-орбитальной модели бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ - связи (С – С и
С- Н) лежат в одной плоскости. Шесть негибридизованных ρ-АО расположены перпендикулярно плос кости молекулы и параллельно друг другу (рис. 6.а). Каждая ρ-АО в равной степени может перекрываться с двумя соседними ρ-АО. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ- скелета и охватывает все атомы углерода цикла ( рис. 6, б). π- электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком внутри цикла (рис. 6, в).

а) б) в)
Рис. 6. Атомно-орбитальная модель бензола
Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.
В общем случае, как установил на основании квантовомеханических расчетов немецкий физик Э. Хюккель, для образования таких стабильных молекул необходимо, чтобы плоская циклическая система содержала (4п + 2) π-электронов, где п = 1, 2, 3 и т. д. (правило Хюккеля, 1931). С учетом этих данных можно конкретизировать понятие ароматичности.
Соединение ароматично, если оно имеет плоский замкнутый цикл и сопряженную π-электронную систему, охватывающую все атомы цикла и содержащую (4п+ 2) π-электронов.
Правило Хюккеля применимо к любым плоским конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. Поэтому такие соединения с конденсированными бензольными ядрами, как нафталин и другие, отвечают критериям ароматичности (рис. 7).
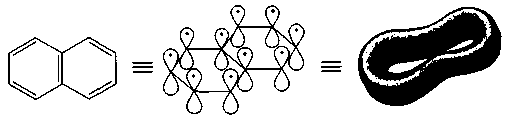
Рис. 7. Атомно-орбитальная модель нафталина
В настоящее время в связи с широким внедрением физико-химических методов появилась возможность экспериментально устанавливать наличие ароматического характера по способности соединения удерживать индуцированный кольцевой ток. Это осуществляют с помощью метода ядерно-магнитного резонанса
