
- •Глава 1.2 разложение плавильных материалов. Восстановление железа и др. Металлов в д.П.
- •Глава 1.2 разложение плавильных материалов. Восстановление железа и других металлов в доменной печи
- •1.2.1. Разложение гидратов и карбонатов
- •1.2.2. Структура и свойства оксидов железа
- •1.2.3 Основные закономерности восстановления оксидов железа газообразными восстановителями
- •1.2.4. Восстановление оксидов железа углеродом
- •1.2.5. Кинетика восстановления железа
- •1.2.6. Влияние различных факторов на процессы восстановления оксидов железа
- •1.2.7. Восстановление оксидов других, кроме железа, металлов
- •1.2.8. Особенности восстановления оксидов металлов в доменной печи
- •63 В.П. Тарасов, п.В. Тарасов
1.2.5. Кинетика восстановления железа
Наряду с термодинамическими закономерностями восстановления оксидов металлов большое значение на скорость их восстановления имеет также кинетика процесса.
В соответствии с разработанными в настоящее время представлениями о кинетике, восстановительные процессы слагаются из последовательных этапов, схематически представленных на рис. 1.26. В межкусковых пространствах железорудных материалов движется восстановительный газ. Вокруг отдельных кусков материалов образуются граничные потоковые слои газа. Массобмен между газовой фазой и поверхностью оксида происходит за счет диффузии газообразного восстановителя через этот граничный слой газа (поз. 1). Затем газ восстановитель диффундирует по макро- и микропорам куска через слой продуктов восстановления внутрь куска до поверхности (поз. 2), где находится восстанавливаемый оксид. Здесь газообразный восстановитель адсорбируется (поз. 3) и происходит собственно химическая реакция отрыва кислорода из решетки оксида газом-восстановителем (поз. 4). Окисленный газ десорбирует с реакционной поверхности и диффундирует обратно по микро- и макропорам куска до его поверхности (поз. 5,6).Наконец происходит диффузия окисленного газа через пограничный слой в газовый поток (поз.7) в межкусковом пространстве.
Рассмотренные процессы можно представить в виде реакции в три стадии: адсорбции газа-восстановителя на поверхности восстанавливаемого оксида, химическая реакция, обратная диффузия окисленного газа (адсорбционно-автокаталитическая теория Чуфарова с сотрудниками)
MeOт+Вг=МеОт Вг.адс,
МеОтВг.адс=Мет.ВОг
МетВОг=Мет+ВОг
МеОт+Вг=Мет+Ог. (1.75)
В первой стадии кроме адсорбции газа-восстановителя на поверхности с FeO задействованы также его диффузия через пограничный слой и в макро- и микропорах до места химической реакции (вторая стадия). В третью стадию входит десорбция газообразного продукта реакции, обратная его диффузия в микро- и макропорах куска железосодержащего материала и, наконец, диффузия через пограничный слой с поверхности куска в основной газовый поток.
Закономерности движения газового потока в межкусковых пространствах рассмотрены в первом разделе учебника. Основные закономерности восстановления оксидов железа рассмотрены в 1.3 и 1.4 данного раздела. Поэтому более подробно остановимся на процессах диффузии газа-восстановителя к месту нахождения вюстита и его адсорбции на реакционную площадку, а также условиях десорбции газообразного продукта реакции и обратной его диффузии в газовый поток.
В доменной печи, как правило, газ в межкусковых пространствах имеет турбулентный режим движения. Однако вокруг обтекаемых кусков железорудных материалов образуется малоподвижный тонкий слой (названный в нашем случае пограничным), где сохраняется ламинарный режим и градиент концентрации газа С1 и С2 по границам слоя. Этот граничный слой создает наибольшее сопротивление перетоку газа, так как в нем происходит сравнительно медленная молекулярная диффузия. Коэффициент молекулярной или свободной диффузии для бинарной смеси газа D можно определить из следующей зависимости
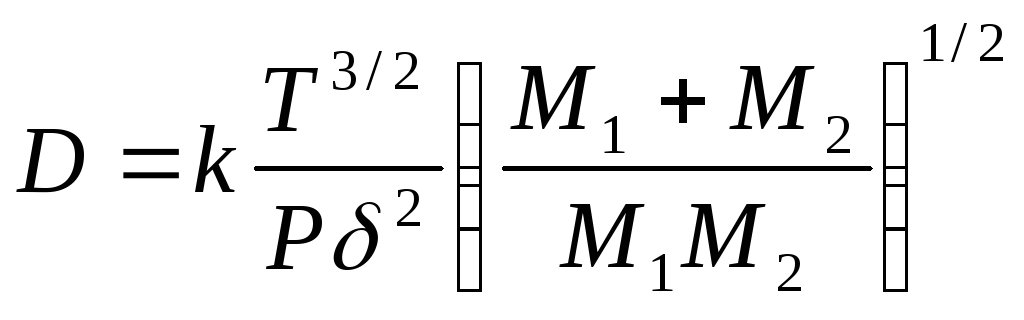 (1.76)
(1.76)
где δ - средний эффективный диаметр взаимодействия ударяющихся молекул, см; M1, M2 - молекулярные массы компонентов газа, г/моль; P - давление, кПа; k - коэффициент, зависящий от размерности величин.
В табл. 1.3 приведены коэффициенты диффузии и длина свободного пробега молекул в наиболее часто встречающихся при восстановлении железа бинарных смесей газа (P = const). При постоянной температуре коэффициент диффузии изменяется обратно пропорционально общему давлению смеси или сумме концентраций компонентов смеси (С1+С2). Рост температуры вызывает увеличение коэффициента пропорционально Т3/2 (при P = const) или Т1/2 (при постоянном количестве газа в единице объема).
Таблица 1.3 – Коэффициент диффузии газов D, см2/с (числитель) и длина
свободного пробега молекул λ, см (знаменатель) в бинарных
газовых смесях (Р=98 кПа)
|
Т, 0С |
0К |
СО + N2 |
H2 + N2 |
H2 + H2O |
CO + CO2 |
|
500 700 900 1100 |
773 973 1173 1373 |
1,09/2,64 1,65/3,58 2,30/4,52 3,05/5,53 |
3,68/3,34 5,51/4,44 7,64/5,62 10,06/6,84 |
4,64/3,57 6,91/4,76 9,58/6,01 12,62/7,32 |
0,95/2,63 1,51/3,71 2,20/4,91 3,01/6,22 |
Скорость потока газов (I, моль/(см2/с)) через ламинарную пленку газа толщиной l, см можно определить из уравнения
I = D(C1 – C2)/l (1.77)
Если С1 и C2 на границах пограничного слоя (ламинарная пленка газа) являются постоянными, а количество газа входящего и выходящего из слоя тоже постоянно, концентрация газа меняется от С1 до С2 линейно. Из табл. 1.3 видно, что коэффициент диффузии смеси Н2-Н2O в 4-5 раз выше аналогичного коэффициента смеси СО-СО2. Следовательно, при равной разности концентраций этих газов по границам ламинарной пленки скорость потока Н2 примерно во столько же раз будет выше, чем окиси углерода. Поэтому при лимитирующем значении диффузионных процессов в восстановлении оксидов железа водород будет более сильным восстановителем не только выше 8100С, но и при более низких температурах.
Для определения диффузии через пограничный слой газа толщиной l удобно пользоваться коэффициентом массопередачи β, см/с
β = D/l (1.78)
Преимуществом здесь является то, что формула (1.78) описывает не только диффузию газа через ламинарный слой, но и массообмен. Последнее очень важно для соответствующего определения в доменной печи общей массы восстановленных оксидов косвенным путем и построения надежной математической модели доменного процесса. Установлено, что в большинстве случаев коэффициент массопередачи приблизительно пропорционален квадратному корню из скорости газа.
При диффузии через поры кусков железорудных материалов или через слой продуктов восстановления следует учитывать сужение сечения, сквозь которое идет диффузия. Следует также ввести фактор, учитывающий направленность пор, относительно направления диффузии, а также разветвленность пор. Это достигается использованием коэффициента диффузии через поры Dп, см2/с
Dп = D γ ξ , (1.79)
где γ - относительный объем пор, т.е. отношение объема пор к объему куска; ξ - лабиритный фактор, зависящий от структуры пор и определяемый эмпирически.
Если диаметр пор (dп) меньше длины среднего свободного пробега молекул (dп<λ) то столкновение молекулы о стенки поры будут чаще, чем соударения молекул. Поэтому здесь нельзя применять для определения коэффициента диффузии формулу (1.76), а следует пользоваться коэффициентом кнудсеновской диффузии
![]() (1.80)
(1.80)
Сравнение
с формулой (1.76) показывает, что Dк
в порах при dп<λ,
в противоположность D не зависит от
давления газа и сечения взаимодействия
ударяющихся молекул. Обозначим среднюю
арифметическую скорость движения через
V,
тогда![]() и
и
![]() (1.81)
(1.81)
а диффузионный поток (количество вещества в молях, проходящего за 1 с поверхность в 1 см2)
![]() (1.82)
(1.82)
где ΔР - разность давления газа в начале и в конце диффузионного пути, кПа; l - длина поры, см.
Можно показать, что скорость кнудсеновского течения Iк по абсолютной величине меньше скорости диффузии в пограничном слое газа I при тех же условиях во столько раз, во сколько размер микропор меньше длины свободного пробега молекул газа. Следует иметь ввиду, что суммарная площадь сечения микропор очень велика и коэффициент самодиффузии газа равен
D=2/3 Vλ. (1.83)
Из рассмотрения формул (1.81) и (1.83) видно, что Dк равен D при λ = dп. Исходя из этого, температура, давление газа и размер пор по-разному влияют на скорость молекулярной и кнудсеновской диффузий, так как D зависит от λ, а Dк от размера пор (поскольку λ величина постоянная, равная dп). В связи с этим величину 1/λ можно считать сопротивлением свободной диффузии, а 1/dп - сопротивлением кнудсеновской диффузии.
Если размеры пор настолько малы, что соизмеримы с диаметрами молекул, то диффузию через такие поры называют активированной и необходима дополнительная энергия для преодоления сил притяжения со стороны поверхности твердого тела. Концентрация газа в твердом теле зависит от его растворимости и в большинстве случаев остается неизвестной величиной. Поэтому диффузионный поток Ia = Da (ΔС/l), где Da - коэффициент активированной диффузии, см2/с; ΔС - изменение концентрации газа внутри твердого тела по диффузионному пути l, моль/см3 и Ia можно определить из соотношения
Ia = KΔP/l, (1.84)
где К - постоянная проницаемости, означающая количество газа, диффундирующего за 1 час через 1 см2 площади тела толщиной 1 мм при разности парциальных давлений 1,33 кПа.
Величина К резко возрастает с увеличением температуры, т. е.
К = К0 ехр(-Е/RТ), (1.85)
где Ко - коэффициент, Е - энергия активации, зависящая от природы газа и твердого тела.
Таким образом, диффузионный поток Ia в мелких порах является экспоненциальной функцией энергии активации, которая в свою очередь является следствием нарушения молекулярной структуры газа-восстановителя. Поскольку различие величин Е для отдельных газов велико, активированная диффузия в значительно большей мере является избирательной, по сравнению с молекулярной. Установлено, что даже поры размером >15 Нм, но меньше средней длины свободного пробега молекул газа-восстановителя доступны его воздействию и скорость диффузии может быть выше скорости протекания процессов на поверхности твердых тел. В более мелких порах Ia газов меньше максимально возможной скорости реакции на поверхности и газ в порах достигает равновесного состава. Скорость восстановления в этом случае зависит только от скорости диффузии газа в порах.
Адсорбированные на поверхности твердого тела молекулы газа-восстановителя не все реагируют с окислами металла. Некоторые из них удерживаются физическими силами и время их пребывания на поверхности тела составляет ~10-7 с. Другие же вступают в химическую связь с атомами и элементами поверхности (хемсорбция), т.к. при адсорбции в них ослабляются или даже исчезают внутримолекулярные связи. При этом новые связи адсорбированных молекул с атомами твердых тел могут быть настолько прочными, что при последующей десорбции газа атомы решетки твердого тела перейдут в газ.
Восстановление оксидов железа идет или ступенчато фронтальными слоями, или во всем объеме. В первом случае процесс начинается отнятием ионов кислорода в тонком поверхностном слое с последующим фронтальным продвижением вглубь. При этом α-Fe2О3 переходит в кубическую дырчатую решетку γ- Fe2О3. По мере отнятия кислорода на поверхности накапливаются катионы Fe2+ которые вместе с электронами мигрируют в центр кристаллов. Катионы железа заполняют вакансии в решетке γ- Fe2О3 и она превращается на периферии в кубическую решетку магнетита. Другая часть Fe2+ диффундирует в решетку α- Fe2О3 которая перестраивается в переходную γ-фазу. Последняя все время сохраняется в виде прослойки между гематитом и магнетитом.
Слой за слоем протекает первый этап восстановления до полного перехода Fe2О3 в Fe3О4. Параллельно, начиная с поверхности, идет дальнейшее отнятие уже от магнетита кислорода восстановителем и внедрение освободившихся ионов железа в кристаллы Fe3O4. Образуется дырчатая решетка вюстита Fe1-yO с максимальным у, а затем в процессе внедрения Fe2+ концентрация ионов кислорода в решетке уменьшается (y изменяется от 0,125 до 0,06). На рис. 1.23 и 1.24 видно, что дальнейшее отнятие кислорода восстановителем от вюстита приводит к последней ступени восстановления Fe1-yО до железа.
Таким образом при ступенчатом восстановлении каждая фаза образует пояс и переход Fe2О3→Fe3О4→Fe1-yО→Fе протекают одновременно в различных поясах объема рудных частичек. На рис. 1.27, б представлена схема последовательности ступенчатого восстановления, причем показано развитие активных центров начала реакции. Видно, что с развитием восстановления оксидов железа нарастает образование активных центров и скорость реакции, медленная вначале (индукционный период), быстро возрастает (автокатализ) (рис. 1.27,а). При слиянии поверхностей раздела отдельных фаз новые центры активации растут медленнее, по сравнению с затуханием ранее образованных и скорость реакции восстановления постепенно убывает.
Наиболее часто, как это указывалось ранее, скорость потока восстановителя в ламинарной пленке (1.77), микропорах (1.82) и даже в порах, соизмеримых с диаметрами молекул (1.84) выше по сравнению со скоростью химической реакции. Поэтому восстановитель диффундирует вглубь рудной частицы и восстановление оксидов железа идет сразу во всем ее объеме. Не исключено и смешанное восстановление, например, фронтальное для перехода Fe2O3 в Fe3О4 и во всем объеме для восстановления Fe3О4 до FeO и FeO до Fe. В двух последних схемах восстановления реакции также идут с автокатализом и также наблюдается три его периода – индукция, автокатализ и постепенное затухание процесса.
С ростом восстановления оксидов железа увеличивается концентрация твердых растворов, диффузия газа-восстановителя в которых значительно затруднена. Особенно это относится к твердым растворам вюстита и металла [32-35].
Ранее уже упоминалось, что вакансия ионов железа делает возможным их передвижение в решетке. Если в уравнении (1.48) принять (1-y)=1, то поток катионов железа IFe, можно определить из соотношения
![]() (1.86)
(1.86)
где ξ – толщина слоя, см; VFeO – молярный объем, моль/м3.
Поскольку VFeO и D*Fe для определенных температурных условий величины, примерно, постоянные, то поток катионов железа в твердых растворах обратно пропорционален толщине восстановленного слоя металла или менее окисленного оксида железа.
При миграции ионов железа в решетке одновременно через слой вюстита или металла идет поток дефектных электронов |е|, которые можно представить с точки зрения химии ионами Fe3+. Эти избыточные заряды двигаются путем обмена зарядами между ионами Fe2+ и Fe3+ решетки. При стационарном течении диффузии действительно
![]() (1.87)
(1.87)
т.е. поток дефектных электронов в два раза слабее потока катионов железа. Поэтому при рассмотрении скорости восстановления оксидов железа в твердых растворах и принималась во внимание скорость диффузии катионов железа.
Как уже отмечалось скорость восстановления лимитируется или скоростью реакции, или скоростью диффузии. На рис. 1.28 представлена указанная зависимость от температуры. Левее точки пересечения кривых 1 и 2 D>Кv и скорость процесса лимитируется скоростью взаимодействия реагирующих веществ. Правее этой точки Kv>D лимитирующим звеном становится диффузия, затрудняемая с непрерывным ростом ξ.
Следовательно, с позиций адсорбционно-автокаталитической теории объяснены практически все вопросы, возникающие при рассмотрении кинетики восстановления оксидов железа. Например, такие как автокаталитический характер процесса, увеличение скорости экзотермической реакции восстановления вюстита с повышением температуры, влияние Н2О и СО2 в газовой фазе на скорость восстановления оксидов железа водородом и окисью углерода и др.
