
- •1.Материаловедение, как наука о строении и свойствах материалов, её основоположники
- •2.Кристаллическое состояние, типы кристаллических решеток, их параметры. Строение кристаллов. Анизотропия кристаллов, квазиизотропия свойств сплавов.
- •3.Металлографический метод изучения металлов.
- •4.Спец методы изучения сплавов (рентгеновский, микрорентгеноспектральный, фрактографический, радиографический).
- •5.Закономерности процесса кристаллизации
- •6.Строение слитка и факторы, на него влияющие
- •Превращения в твердом состоянии (аллотропические и магнитные превращения).
- •8.Типы структурных составляющих, присутствующих в металлических сплавах
- •9. Построение диаграмм состояния методом термического анализа.
- •10. Правила фаз и отрезков
- •11. Диаграмма состояния для сплавов, образующих механические смеси кристаллов двух компонентов
- •12. Диаграмма состояния для сплавов образующие неорганические твердые растворы.
- •18. Понятие о тройных диаграммах состояния.
- •19. Механические свойства материалов и методы их определения(твердость, прочность, пластичность, ударная вязкость).
- •20. Влияние деформации на структуру и свойства материала. Роль дефектов кристаллического строения в изменении прочности материала.
- •21. Процессы, происходящие при нагреве деформированных материалов( отдых, полигонизация, рекрестализация).
- •22. Диаграмма состояния железо – углерод, характеристики и свойства структурных составляющих.
- •23. Углеродистые стали, их классификация, маркировка. Влияние углерода и постоянных примесей на свойства сталей.
- •24.Конструкционные стали общего назначения ( стали обычного качества, качественные, высококачественные, листовые стали для холодной штамповки, автоматные стали).
- •25. Чугуны, их классификация, маркировка. Влияние углерода, постоянных примесей, скорости охлаждения на структуру и свойства чугунов.
- •26. Диаграмма состояния железо-графит, процесс графитизации.
- •27.Получение белого, серого, ковкого, высокопрочного чугунов, их структура, свойства применение.
- •28 Термическая обработка, ее параметры, методы осуществления.
- •29. Классификация видов термической обработки, их связь с диаграммами состояния.
- •30. Структурные превращения при термообработке стали и их классификация. Виды термообработки стали.
- •31. Превращение в стали при нагреве. Образование и рост аустенитного зерна.
- •32. Превращения в стали при охлаждении. Диаграмма изотермического превращения аустенита.
- •33.Мартенситное превращение и его особенности.
- •34. Превращение при отпуске закалённой стали.
- •35. Термомеханическая обработка стали.
- •36. Способы и параметры закалки стали. Прокаливаемость и закаливаемость. Поверхностная закалка сталей.
- •37. Отжиг и нормализация стали, их назначение и способы осуществления.
- •40. Классификация и маркировка легированных сталей.
- •41. Цементуемые и улучшаемые машиностроительные конструкционные стали, их термич-я обр-ка, св-ва и применения.
- •42. Рессорно-пружинные, шарикоподшипниковые стали, их термомобр-ка, св-ва и применение.
- •43. Инструментальные некрасностойкие стали для изготовления режущего инструмента, их обработка и св-ва. Быстрорежущие стали. Твердые сплавы.
- •44.Быстрорежущие стали. Твердые сплавы.
- •45. Инструментальные стали для оснастки холодного и горячего деформирования металлов, их термическая и химико – обработка, структура и свойства.
- •46. Жаропрочные, жаростойкие и нержавеющей стали, их термообработка, свойства и применение.
- •47. Высокопрочные мартенситно-стареющие стали.
- •48. Сплавы с заданным значением тепловых коэффициентов расширения и модуля упругости, магнитотвердые, магнитомягкие, немагнитные материалы.
- •49. Магнитотвердые, магнитомягкие, немагнитные материалы.
- •50. Алюминий и его сплавы, литейные и деформируемые алюминиевые сплавы, их назначение, термообработка и свойства.
- •51. Медь и ее сплавы. Латуни, бронза, их свойства,
- •52. Цинк, свинец олово, магний.
- •53. Тугоплавкие металлы, их использование в промышленных сплавах.
- •54. Полимерные материалы.
- •56. Силикатные материалы
- •Содержание
9. Построение диаграмм состояния методом термического анализа.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5)
Р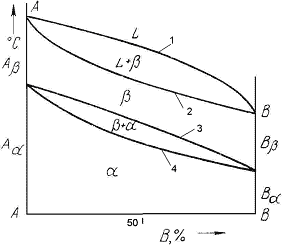 ис.
4.5. Диаграмма состояния
ис.
4.5. Диаграмма состояния
Диаграммы состояния показывают равновесные состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Равновесного состояния можно достигнуть при бесконечно медленном охлаждении или нагреве
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа (который основан на фиксировании тепловых эффектов фазовых превращений). В расплав сплава какого-то состава опускается термопара, соединённая с гальванометром. В процессе остывания череза равные промежутки времени записываются в таблицу показатели температуры до полного затвердевания сплава. По данным точкам для различных составов строятся кривые охлаждения. После построения кривых охлаждения на них фиксируются перегибы, обозначающие выделение тепла на линиях. Температуры, соответствующие фазовым превращениям, называют критическими точками:
1-начало кристаллизации
2-конец кристаллизации
3-начало фазового превращения
4-конец фазового превращения.
Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют линией ликвидус, а концу кристаллизации – линией солидус.
По кривым охлаждения строят диаграмму состояния в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
10. Правила фаз и отрезков
А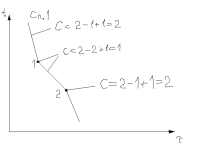
 нализ
сплавов можно осуществлять с использованием
правила
фаз:
C=К-Ф+1.
С
– число степеней свободы (число внешних
и внутр факторов, которые можно изменять
без изменения числа фаз в системе).
Изменяться могут t0С
и состав при постоянном давлении. С=0
(ничего не изм); С=1,=2 (изм t
или состояние). К – число компонентов.
Компоненты сплава – это чистые хим
эл-ты или хим соединения. Ф – число фаз.
Фаза – это часть с-мы (часть сплава),
имеющая пов-сть раздела, при переходе
через которую св-ва меняются скачкообразно.
нализ
сплавов можно осуществлять с использованием
правила
фаз:
C=К-Ф+1.
С
– число степеней свободы (число внешних
и внутр факторов, которые можно изменять
без изменения числа фаз в системе).
Изменяться могут t0С
и состав при постоянном давлении. С=0
(ничего не изм); С=1,=2 (изм t
или состояние). К – число компонентов.
Компоненты сплава – это чистые хим
эл-ты или хим соединения. Ф – число фаз.
Фаза – это часть с-мы (часть сплава),
имеющая пов-сть раздела, при переходе
через которую св-ва меняются скачкообразно.
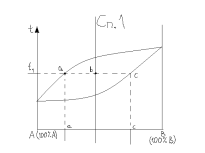
В данной диагр состояния закономерности можно рассматривать через кривые охлаждения. До т 1 равномерное охлаждение жидкой фазы. В т 1 начинается процесс кристаллизации с выделением из жидкой фазы кристаллов α фазы, изменяется число степеней свободы и на кривой появляется перегиб. Перегиб свидетельствует о выделении тепла. От т 1 до т 2 идет кристаллизация, и в точке 2 жидкой фазы уже нет, следовательно изменилось число степеней свободы, опять перегиб на кривой охлаждения, в т 2 охлаждение идет быстрее, так как нет выделения тепла. Ниже т 2 охлаждение сплава на основе α фазы.
Любой сплав будет иметь такую же кривую охлаждения, но чистые элементы будут иметь другую кривую:
Для чистых сплавов кристаллизация идет при t0=const.
Применение правила отрезков.
Правило отрезков позволяет определить: 1) Доли фаз (кол-во фаз) в %; 2) Составы фаз При t1 в равновесии нах 2 фазы – жидкая и твердая. Кж=(bc/ac)*100%% Кα=(ab/ac)*100%
Состав жидкой фазы – это т. а, которая проектируется на ось, с – состав α фазы, b – состав сплава в целом.
Если сплав сосоит из одной фазы, то её 100% и отрезки применять не имеет смысла.
