
- •Институт экономики, управления и права (г. Казань)
- •Содержание
- •Раздел 1. Работа и энергия «Энциклопедический словарь физика», 1991:
- •Ядерная энергия
- •Яворский б.М., Детлаф а.А. Физика, 2000:
- •«Энциклопедический словарь физика», 1991:
- •Другие виды энергии
- •Закон сохранения энергии
- •Карно цикл
- •Раздел 2. Основы термодинамики Яворский б.М., Детлаф а.А. Физика, 2000
- •Энтропия
- •«Энциклопедический словарь физика», 1991:
- •Раздел 3. Основы классической генетики Мамонтов с.Г. И др. Основы биологии, 1992:
- •Основы генетики и селекции
- •Основные понятия генетики
- •Закономерности наследования признаков. Гибридологический метод изучения наследования признаков. Законы менделя
- •Закон расщепления
- •Закон чистоты гамет
- •Закон независимого комбинирования генов
- •Сцепленное наследование генов
- •Взаимодействие генов
- •Генетика пола
- •Раздел 4. Геохронология Чернышева ф.А. «Биология с основами экологии», 2005:
- •Геохронологическая шкала
- •Циклический характер климатических изменений
- •Левин а.С. Введение в общую экологию, 1998:
- •Чернышева ф.А.Биология с основами экологии, 2005:
- •Крупные ароморфозы
- •История развития органического мира
- •I эон криптозой
- •2 Эра фанерозоя – мезозой (средняя жизнь)
- •3 Эра фанерозоя - кайнозой новая жизнь
- •Раздел 5. Главные направления эволюционного развития органического мира Грин н. И др. Биология. Т. 3, 1996.
- •Эволюционное древо растений
- •Эволюционное древо животных
- •Список цитируемых литературных источников
- •420108, Г. Казань, ул. Зайцева, д. 17
Карно цикл
Развитие термодинамики было в большой степени связано с анализом работы тепловых машин. Его осуществил в 1824 г. французский инженер С. Карно в книге «Размышления о движущей силе огня и машинах, способных развивать эту силу». Основная идея Карно состоит в том, что тепловая машина производит работу не за счет только поглощения тепла, а благодаря его передаче от источника тепла – нагревателя, находящегося при температуре Т1, к холодильнику, находящемуся при температуре Т2<Т1, т. е. от более нагретого тела к менее нагретому.
С. Карно впервые разработал метод циклов. Цикл – это последовательность процессов, которые возвращают в конечном счете всю систему участвующих в них тел в первоначальное состояние. Метод циклов оказал и продолжает оказывать большое влияние на развитие термодинамики.
Изменение состояния системы обычно характеризуется изменением трех основных параметров: температуры Т, давления р и объема V. Для одного моля идеального газа, как известно, выполняется уравнение: pV=RТ. французский физик Б. Клапейрон в 1834 г. впервые предложил изображать на диаграмме с помощью этого уравнения процессы, составляющие циклы. Если по оси ординат такой диаграммы откладывать давление, а по оси абсцисс – объем, то площадь, заключенная внутри замкнутой кривой, характеризующей изменение состояния системы, будет представлять собой работу, произведенную системой в результате цикла. Коэффициент полезного действия (КПД) цикла равен отношению произведенной работы к затраченному теплу.
Цикл Карно – обратимый круговой процесс, в котором совершается превращение теплоты в работу.
Цикл Карно сыграл важную роль в развитии термодинамики (на его основе, в частности, сформулирован второй закон термодинамики) и теплотехники и до сих пор используется при анализе работы тепловых машин.
Раздел 2. Основы термодинамики Яворский б.М., Детлаф а.А. Физика, 2000
<….>
Открытой системой называется термодинамическая система, которая может обмениваться веществом с внешней средой. Примерами таких систем служат живые организмы.
Закрытая система не может обмениваться веществом с внешней средой.
Изолированной называется термодинамическая система, которая не может обмениваться с внешней средой ни энергией, ни веществом.
Замкнутой системой называется термодинамическая система, изолированная в механическом отношении, т.е. не способная к обмену энергией с внешней средой путем совершения работы.
Термодинамическая система называется адиабатной (система изолированная в тепловом отношении), если не происходит теплообмена между системой и внешней средой. Такая система может совершать работу над внешними телами. Вместе с тем внешние силы могут совершать работу над системой. Примером может служить цилиндр с подвижным поршнем, наполненный газом и со всех сторон окруженный плотным слоем теплонепроницаемого войлока. Отсутствие теплообмена с внешней средой не исключает возможности газу совершать работу расширения и совершения над ним работы сжатия силами внешнего давления.
Система приближается по свойствам к адиабатной, если происходит столь быстрое изменение ее состояния, что за время процесса не успевает произойти теплообмен системы с внешней средой. Например, быстрое расширение газа, заключенного в баллоне, при кратковременном открытии крана.
Броуновским движением называется наблюдаемое под микроскопом непрерывное хаотическое движение мелких частиц, взвешенных в газе или жидкости. Броуновское движение обусловлено флуктуациями давления, которое оказывают молекулы газа или жидкости на взвешенные частицы. В результате флуктуации давления броуновские частицы испытывают со всех сторон действие неуравновешенных сил, которые приводят к видимому сложному движению этих частиц.
При постоянных внешних условиях в движении броуновских частиц не наблюдается никаких изменений, и оно продолжается как угодно долго. Это свидетельствует о непрерывности теплового, хаотического движения молекул, вызывающего перемещения броуновских частиц. Скорости v и энергии w движения броуновских частиц зависят от размеров частиц, а не от химической природы; величины v и w растут с повышением температуры и уменьшением вязкости жидкости или газа.
Опытами установлено, что при своем движении броуновские частицы могут перемещаться вверх, как бы «всплывая» в газе или жидкости. Это может происходить в том случае, если броуновская частица получит со стороны молекул газа (или жидкости) нескомпенсированный импульс, направленный снизу вверх. При этом потенциальная энергия частицы возрастает за счет кинетической энергии окружающих ее молекул, и происходит местное охлаждение газа или жидкости. Механическая энергия броуновской частицы возрастает за счет охлаждения одного источника теплоты – жидкости или газа, что противоречит второму началу термодинамики. Таким образом, броуновское движение доказывает ограниченность второго закона термодинамики, его статистический характер.
Движение броуновской частицы является полностью хаотическим.
Температура равновесной системы является мерой интенсивности теплового движения ее молекул (атомов, ионов). Для равновесной системы частиц, подчиняющихся законам классической статистической физики, средняя кинетическая энергия теплового движения частиц прямо пропорциональна термодинамической температуре системы.
Температуру можно измерять только косвенным путем, основываясь на том, что целый ряд физических свойств тела, поддающихся прямому или косвенному измерению, зависит от температуры. Так, при изменении температуры тела изменяются его длина и объем, плотность, электрическое сопротивление, упругие свойства и т. д. Изменение любого из этих свойств может быть основой измерения температуры. Для этого необходимо, чтобы для одного тела, называемого термометрическим телом, была известна функциональная зависимость данного свойства от температуры. Температурные шкалы, устанавливаемые с помощью термометрических тел, называются эмпирическими.
В международной стоградусной шкале температура измеряется в °С (градус стоградусной шкалы, градус Цельсия) и обозначается t. Считается, что при нормальном давлении в 1,01325 • 105 Па (IX) температуры плавления льда и кипения воды равны О °С и 100 °С соответственно. В термодинамической шкале температура измеряется в Кельвинах (К) и обозначается Т. Связь между термодинамической температурой Т и температурой по стоградусной шкале:
Т = 273,15 + t.
Температура Т = 0 (t = -273,15 °С) называется абсолютным нулем температуры.
Параметры состояния системы разделяются на внешние и внутренние. Внешними параметрами системы называются физические величины, которые зависят от положения в пространстве и различных свойств тел, являющихся внешними по отношению к данной системе. Например, для газа объем V сосуда, в котором находится газ, является внешним параметром, ибо объем зависит от расположения внешних тел – стенок сосуда. Для диэлектрика, находящегося в электрическом поле, внешним параметром является напряженность этого поля, созданного некоторыми внешними источниками поля. Внешним параметром для жидкости в открытом сосуде является, например, атмосферное давление.
Внутренними параметрами системы называются физические величины, зависящие как от положения внешних по отношению к системе тел, так и от координат и скоростей частиц, образующих данную систему. Например, внутренними параметрами газа являются его давление и энергия, ибо они зависят от координат и скоростей движущихся молекул и от плотности газа.
Параметры состояния системы, находящейся в равновесном состоянии, не являются независимыми. Внутренние параметры такой системы зависят только от ее внешних параметров и температуры. Равновесное состояние простой системы заданного химического состава и массы М определяется заданием двух параметров – объема V и температуры Т.
Уравнением состояния (термическим уравнением состояния) простой системы называется функциональная зависимость равновесного давления р в системе от объема и температуры:
P = f(V, Т).
Уравнение состояния в термодинамике получается опытным путем. В статистической физике уравнение состояния выводится теоретически. В этом состоит взаимосвязь статистического метода исследования с термодинамическим методом.
Примером простых систем является газ в отсутствие внешних полей. Простыми системами являются смеси химически однородных газов постоянного состава, химически чистые жидкости.
Если какой-либо из внешних параметров системы изменяется, то происходит изменение состояния термодинамической системы, называемое термодинамическим процессом. Термодинамический процесс называется равновесным (равновесный, квазистатический процесс), если система бесконечно медленно проходит непрерывный ряд бесконечно близких термодинамически равновесных состояний. Все процессы, которые не удовлетворяют перечисленным условиям, называются неравновесными. Реальные процессы неравновесны, ибо происходят с конечной скоростью. Однако они тем ближе к равновесным, чем медленнее они происходят.
Изопроцессами называются термодинамические процессы, происходящие в системе с постоянной массой при каком-либо одном постоянном параметре состояния (рис. 2).
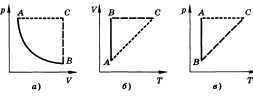
Рис. 2. Термодинамические процессы: а – изотермический; б – изобарный, в – изохорный.
Изотермический (изотермный) процесс происходит при постоянной температуре (Т = const).
Изохорический (изохорный) процесс происходит при постоянном объеме (V = const).
Изобарический (изобарный) процесс протекает при постоянном давлении (р = const).
Адиабатическим (изоэнтропическим) процессом называется термодинамический процесс, который происходит в системе без теплообмена с внешними телами.
Функциями состояния называются физические величины, характеризующие состояние системы. Изменения функций состояния при термодинамических процессах не зависят от вида этих процессов. Изменение функции состояния однозначно определяется значениями параметров начального и конечного состояний системы. Простейшими функциями состояния системы являются ее внутренняя энергия U и энтропия S .
При адиабатическом процессе работа совершается идеальным газом за счет убыли его внутренней энергии.
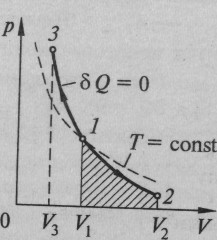
Рис. 3. Связь между параметрами состояния термодинамической системы.
На рис. 3 сплошная кривая – адиабата – изображает в (р - V) диаграмме адиабатический процесс, а штриховая линия – изотерма – изотермический процесс при температуре, соответствующей начальному состоянию 1 газа. При адиабатическом процессе давление изменяется с изменением объема резче, чем при изотермическом процессе. При адиабатическом расширении уменьшается температура газа, и его давление падает быстрее, чем при соответствующем изотермическом расширении. При адиабатическом сжатии газа его давление возрастает быстрее, чем при изотермическом сжатии. Это связано с тем, что увеличение давления происходит за счет уменьшения объема газа и в связи с возрастанием температуры. (Таблица 1)
Таблица 1.
Условия протекания термодинамических изопроцессов
|
|
Название процесса | |||
|
Изохорический |
Изобарический |
Изотермический |
Адиабатический | |
|
Условие протекания процесса |
V = const |
р = const |
pV = const |
∆Q = 0 |
Слово «термодинамика» состоит из двух греческих слов: «терме» – «теплота» и «динамис» – «сила». Термодинамика возникла как наука о процессах, происходящих в тепловых машинах: паровых котлах, двигателях внутреннего сгорания и т. д., т. е. как наука о превращении тепла в механическое движение, в работу. И до сих пор она занимается изучением этих вопросов, но кроме того и проблемами теорий реактивных двигателей, ядерных реакторов и многими другими.
В процессе своего развития термодинамика необычайно расширилась и приобрела характер фундаментальной физической науки. Ныне объектом ее исследования являются практически любые процессы превращения материи, связанные с выделением или поглощением энергии, совершением работы, переносом вещества и т. п. Термодинамика изучает процессы расширения и сжатия, нагрева и охлаждения, плавления и затвердевания, испарения и конденсации, химические реакции, тепловое излучение и т. д.
По отношению ко всем этим процессам термодинамика отвечает на три главных вопроса:
1. Возможен ли данный процесс при данных условиях?
2.Если процесс возможен, то в каком направлении (тоже, конечно, при данных условиях) он пойдет?
3. Чем процесс закончится? Это окончательное, не зависящее уже от времени состояние термодинамика называет состоянием теплового равновесия.
На эти вопросы термодинамика отвечает с помощью трех законов, составляющих ее основное содержание.
Первый закон термодинамики утверждает, что всякое тело обладает внутренней энергией U, причем внутренняя энергия может уменьшиться, если тело совершает работу А, и увеличиться, если ему сообщают теплоту Q: ∆U=Q-A.
Первый закон термодинамики – это закон сохранения энергии. Из него, в частности, следует, что если внутренняя энергия тела постоянна ∆U=0 и тело не получает и не отдает тепла Q =0, то оно не может совершать работу: А=0. Таким образом, нельзя получить работу из ничего или превратить ее ни во что. Устройство или машину, получающую работу из ничего, называют вечным двигателем первого рода. Первый закон термодинамики отвергает вечный двигатель первого рода.
Установление этого закона в основном связано с именами немецкого врача Ю. Майера, который около 1842 г. впервые пришел к идее о возможности взаимного превращения тепла и работы, английского физика Дж. Джоуля, который в 1843 г. первым вычислил механический эквивалент теплоты, и немецкого ученого Г. Гельмгольца, сформулировавшего в 1847 г. первый закон и понявшего его всеобщий смысл как закона сохранения энергии.
Идея второго закона термодинамики связана с именем французского инженера С. Карно, который в 1824 г. разработал цикл Карно-круговой процесс в тепловой машине, в результате которого тело, совершив работу, затем возвращается в исходное состояние, используя часть этой работы. Он впервые показал, что полезную работу можно получить лишь в случае, когда тепло передается от нагретого тела к более холодному.
Развивая идеи Карно, английский физик У. Томсон в 1851 г. сформулировал второй закон: «В природе невозможен процесс, единственным результатом которого была бы механическая работа, полученная за счет охлаждения теплого резервуара». Эта формулировка показывает, что взаимное превращение тепла и работы неравноценно: работу можно полностью превратить в тепло (путем трения, нагрева электрическим током и другими способами), а тепло полностью превратить в работу нельзя. Машину, многократно и полностью превращающую тепло в работу, называют вечным двигателем второго рода. Второй закон отвергает вечный двигатель второго рода.
Независимо от У. Томсона формулировку второго закона в 1850 г. дал немецкий физик Р. Клаузиус: «Теплота не переходит самопроизвольно от холодного тела к более горячему». Эта формулировка подчеркивает односторонность реальных процессов. Действительно, первый закон термодинамики не запрещает указанный переход тепла (лишь бы выполнялся закон сохранения энергии), однако этого никогда не происходит. Мы знаем много других примеров односторонности процессов: газы перемешиваются в сосуде, но сами не разделяются; кусок сахара растворяется в воде, но не выделяется обратно в виде куска; можно нагреть проволоку от аккумулятора, но нельзя (к огорчению автомобилистов!) зарядить аккумулятор от нагретой проволоки и т. д.
Клаузиус решил вопрос о направлении самопроизвольных процессов в 1865 г., когда ввел новую функцию – энтропию, установив ее важнейшую особенность: в теплоизолированных системах самопроизвольно процессы идут в сторону увеличения энтропии; в состоянии теплового равновесия энтропия достигает максимума. Эта функция является мерой беспорядка в системе; таким образом, самопроизвольные процессы идут в сторону увеличения беспорядка.
Возможность расчета абсолютной величины энтропии связана с именем немецкого физико-химика В. Нернста. В 1906 г. он установил, что, когда температура стремится к абсолютному нулю, изменение энтропии, связанное с любым превращением, также стремится к нулю. Позднее было показано, что и абсолютное значение энтропии простых кристаллических систем стремится к нулю при Т→0. Это третий закон термодинамики.
Вводя внутреннюю энергию, энтропию и другие функции, термодинамика не интересуется их природой и не связывает их с устройством тел, с тем, из каких частиц тела состоят, какими свойствами эти частицы обладают, как они взаимодействуют между собой. В ней основные законы вводятся как постулаты, являющиеся обобщением многовекового опыта человечества. Поэтому они оказываются справедливыми для любых процессов и для любых веществ: твердых, жидких, газообразных, плазмы, металлов, полупроводников, диэлектриков и т. д. А. Эйнштейн писал: «Теория оказывается тем более впечатляющей, чем проще ее предпосылки, чем значительнее разнообразие охватываемых ею явлений и чем шире область ее применимости. Именно поэтому классическая термодинамика производит на меня очень глубокое впечатление. Это – единственная общая физическая теория, и я убежден, что в рамках применимости своих основных положений она никогда не будет опровергнута».
