
- •Альдегиды и кетоны
- •Методы получения
- •Реакционная способность
- •I. Реакции присоединения по карбонильной группе
- •II. Реакции присоединения-отщепления (реакции с азотистыми нуклеофилами).
- •III. Реакции с участием атомов водорода при -углеродном атоме
- •2. Реакции альдольной и кротоновой конденсации
- •IV. Реакции окисления
- •Карбоновые кислоты
- •Методы получения
- •Реакционная способность
- •I. Он-кислотность карбоновых кислот
- •II. Реакции замещения он-группы
- •Сложные эфиры
- •Соли карбоновых кислот
- •Амиды карбоновых кислот
- •1. Гидролиз
- •2. Кислотно-основные свойства
- •Нитрилы карбоновых кислот
- •Жиры, масла
- •Общая формула жиров (масел)
- •Физические свойства
- •Реакционная способность
- •Дикарбоновые кислоты
- •Угольная кислота и ее производные
- •Синтез некоторых производных угольной кислоты и их свойства
- •1. Основные свойства мочевины
- •2. Реакции мочевины по амидному фрагменту
- •3. Поведение при нагревании
Карбоновые кислоты

Номенклатура
Суффикс – овая

Карбоновые кислоты имеют высокие температуры кипения, причиной является образование ассоциатов за счет водородных связей.

Методы получения

2. Окисление спиртов, альдегидов (см. соответствующие темы).

4. Гидролиз нитрилов.

Реакционная способность

Поляризация связей в молекулах карбоновых кислот
За счет р,-сопряжения НПЭ атома кислорода в гидроксильной группе и р-электронов -связи карбонила дефицит элекронной плотности на атоме углерода карбонила (+) снижен; по этой причине карбоновые кислоты не склонны вступать в реакции присоединения по карбонильной группе в отличие от альдегидов (кетонов). Кроме проявления ОН-кислотности, для карбоновых кислот характерны реакции замещения гидроксильной группы и атома водорода в -положении.
I. Он-кислотность карбоновых кислот
Карбоновые кислоты относятся к слабым кислотам, рКа 4-5, они слабее сильных и средних минеральных кислот, но сильнее угольной кислоты, спиртов, фенолов. Растворимые в воде карбоновые кислоты (муравьиная, уксусная и пропионовая) способны протонировать воду.

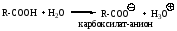
Влияние заместителей на величину рКа карбоновых кислот:
1. Донорные группы увеличивают прочность связи кислород-водород, что приводит к уменьшению силы кислот (к увеличению значения рКа).


рКа 3,75 4,76 4,86
2. Акцепторные группы уменьшают электронную плотность связи кислород-водород, это приводит к увеличению их силы (уменьшению значения рКа).

рКа 0,66 1,25 2,87 4,76
Карбоновые кислоты реагируют с металлами, оксидами металлов, гидроксидами, аммиаком, солями более слабых кислот (OH, NH, CH - кислот) с образованием солей.




II. Реакции замещения он-группы
1. Реакция этерификации
Протекает в присутствии сильных и средних кислот, реакция равновесна. В процессе реакции происходит замещение гидроксильной группы на алкокси- группу и образование сложных эфиров.

Механизм SN - замещение ОН-группы на алкоксигруппу (ОR).

2. Превращение в хлорангидриды и ангидриды
а) синтез хлорангидридов

В качестве реагентов для пщлучения галогенангидридов можно также использовать SOCl2, PCl3.
б) синтез ангидридов

4. Образование азотсодержащих производных
а) синтез амидов

б) синтез нитрилов

III. Реакции по - положению
а) хлорирование

б) бромирование (реакция Геля - Фольгарда – Зелинского)

Эта реакция используется в синтезе окси- и аминокислот (см.материал 2-го семестра).
ПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ КИСЛОТ
Свойства и взаимные превращения
производные общая формула, примеры названий
функциональная группа







Галогенангидриды и ангидриды карбоновых кислот
Галогенангидриды и ангидриды карбоновых кислот - важнейшие и наиболее реакционноспособные производные кислот.
Галогенангидриды и ангидриды карбоновых кислот легко вступают в реакции нуклеофильного замещения галогена и карбоксилат-аниона у sp2-гибридизованного атома углерода. Реакции идут без катализаторов.

Галогенангидриды и ангидриды являются наиболее часто используемыми ацилирующимим агентами. Ацилирование – это замещение подвижного атома водорода на ацильную группу (R-CO) в спиртах (О-ацилирование) и аминах (N-ацилирование).
Примеры реакций


(R-алкил)
Механизм образования метилацетата SN, Nu: CH3OH

Ацилирование с помощью ангидридов протекает по аналогичному механизму, при этом всегда, кроме целевого продукта, образуется карбоновая кислота.

