
Фармацевтический анализ. Химические
.pdf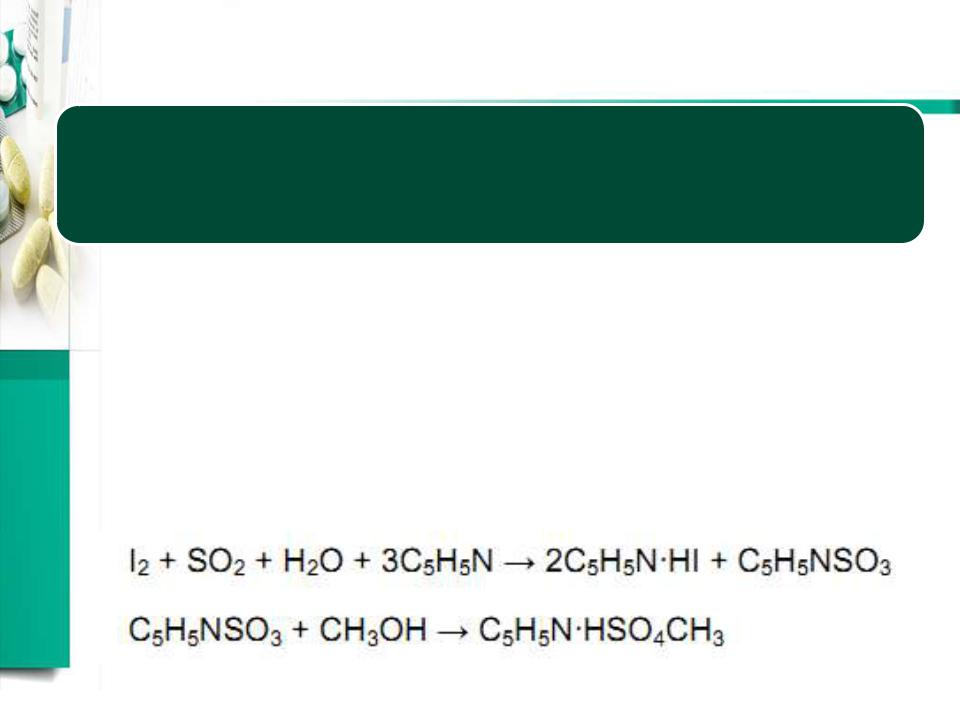
Окислительно-восстановительное
титрование
Определение воды полумикрометодом (по К. Фишеру)
•Растворитель: метанол
•Титрант: йодсернистый реактив (реактив Фишера) –
I2 + SO2 + C5H5N
•Точка эквивалентности фиксируется амперометрически либо визуально

Окислительно-восстановительное
титрование
Определение воды полумикрометодом (по К. Фишеру)
•Вместо пиридина часто используют другие основания (имидазол)
•Вместо метанола возможно использование монометилового эфира этиленгликоля
•Метод может использоваться в диапазоне содержания воды от 0,001% до 100%.
•В ГФРБ 2 метода: А – прямое титрование, Б - обратное

Окислительно-восстановительное
титрование
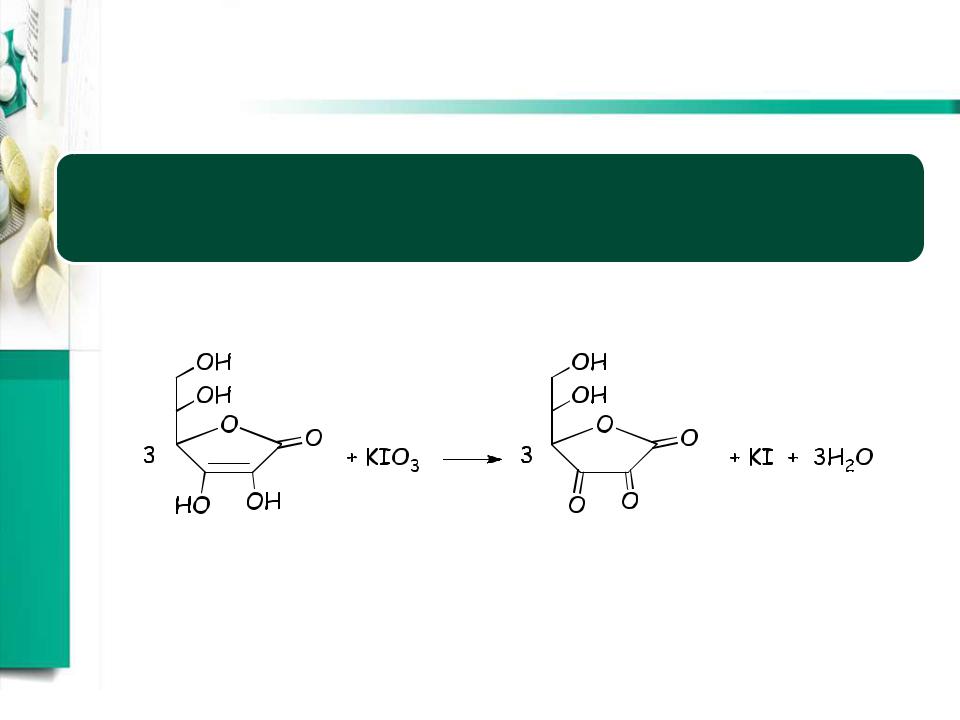
Йодатометрия
•Титрант: KIO3, pH=5-8
•Определяемое вещество – восстановитель
•2 варианта проведения: в кислой среде и сильнокислой среде (3-6 M HCl)
•Т.э.: появление окраски I2 (умеренно кислая среда, где восстановление идет до йодида) или обесцвечивание хлороформного слоя (сильно кислая среда, восстановление до ICl)
Окислительно-восстановительное
титрование
Йодатометрия (в кислой среде)
• определение аскорбиновой кислоты
5I-+IO3-+6H+ = 3 I2 +3H2O

Окислительно-восстановительное
титрование
Йодатометрия (в очень кислой среде) – определение калия йодида
•титрант: 0,05 М раствор калия йодата
•среда: сильнокислая, 3-6 М хлористоводородная кислота;
•вспомогательное вещество: хлороформ
•точка эквивалентности фиксируется по обесцвечиванию слоя хлороформа
IO3- + 5I- + 6H+ 3I2 + 3H2O
2I2 + 6H+ + 5Cl- + IO3- 5ICl + 3H2O 2I- + IO3- + 6H+ + 3Cl- 3ICl + 3 H2O
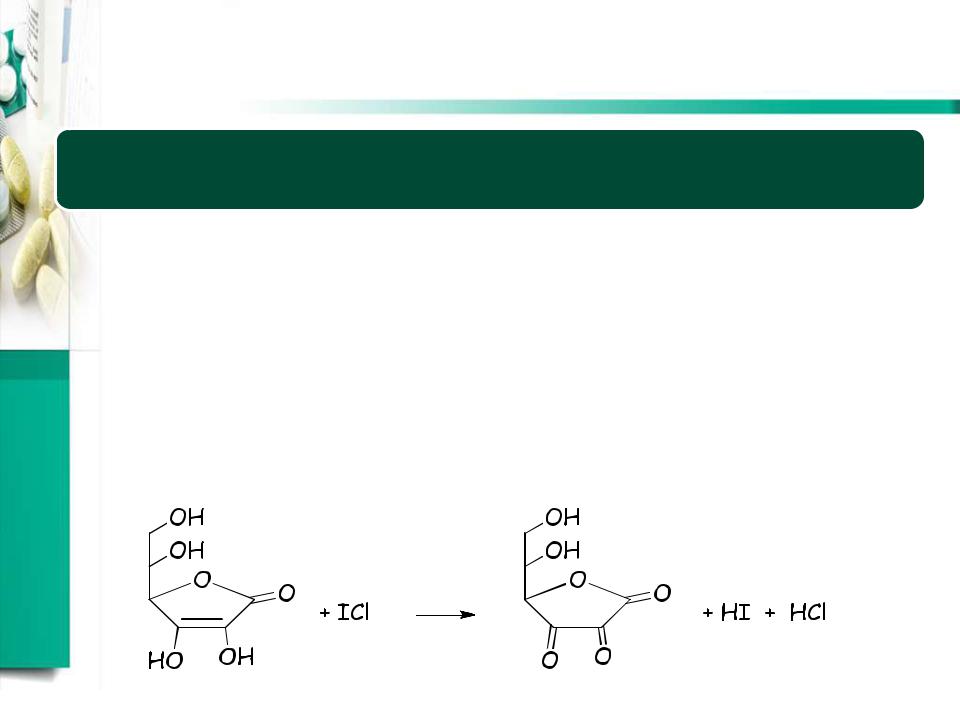
Окислительно-восстановительное
титрование
Хлориодометрия
•Титрант: ICl
•Определяемое вещество – восстановитель
•Т.э.: появление окраски I2 (крахмал)
•в кислой, нейтральной или слабощелочной среде (но не в сильнощелочной!)
•Пример: определение аскорбиновой кислоты

Окислительно-восстановительное
титрование
Броматометрия
•окисление броматом
BrO3- + Red = Ox + Br-
•окисление бромом (Br- + BrO3-) 5Br-+BrO3-+6H+ = 3Br2 +3H2O Br2 + Red = Ox + 2Br-

Окислительно-восстановительное
титрование
Броматометрия (окисление броматом)
•Титрант: KBrO3, кислая среда
•Определяемое вещество –восстановитель
•Т.э.: появление окраски Br2, изменение окраски индикатора (метиловый красный, метиловый оранжевый)
•Пример: определение щавелевой кислоты
3C2O42- + BrO3-+6H+ = 6CO2 + Br- +3H2O

Окислительно-восстановительное
титрование
Бромометрия (окисление бромом)
•Титрант: KBrO3 , предварительно добавляется KBr, кислая среда
•Определяемое вещество –восстановитель
•Т.э.: появление окраски Br2, изменение окраски индикатора (метиловый красный, метиловый оранжевый)
•Часто определяют органические вещества
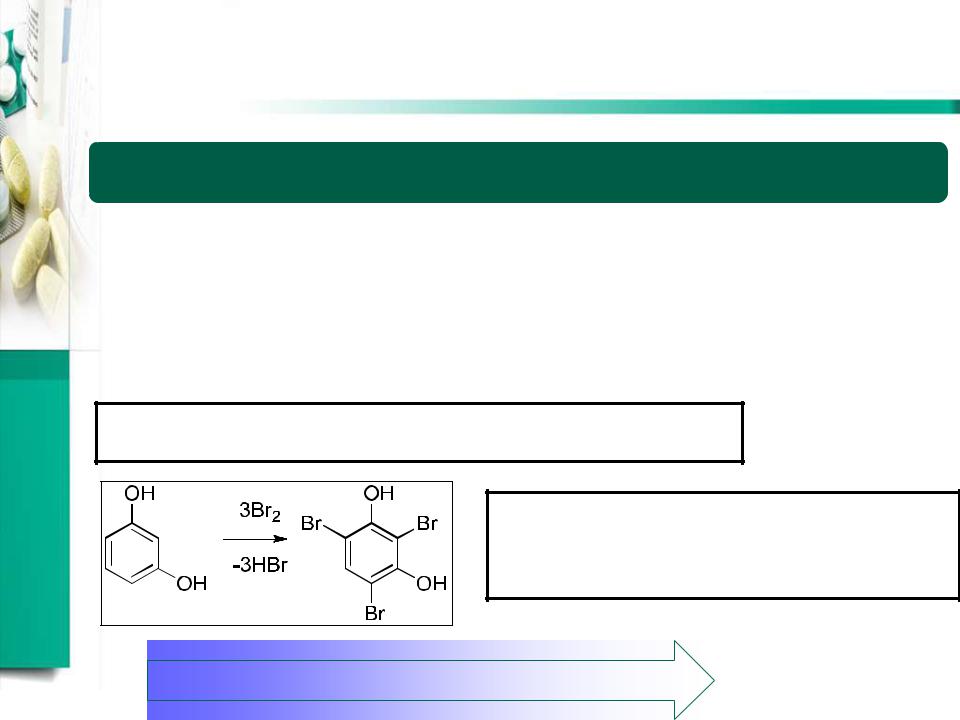
Окислительно-восстановительное
титрование
Броматометрия + йодометрия – определение резорцина
•окисление: 0,0167 М раствор бромид-бромата
•среда: водная, кислая (хлористоводородная кислота)
•заместитель: йодид калия
•титрант: 0,1 М натрия тиосульфата
•индикатор: крахмал
BrO3- + 5Br- + 6H+ → 3Br2 + 3H2O
Br2 + 2I- → 2Br- + I2
I2 + 2Na2S2O3 2NaI + Na2S4O6
