
- •Ответы к экзамену
- •Структура и функции белков Вопрос №4
- •Вопрос №5
- •Вопрос №6
- •Вопрос №7
- •Вопрос №8
- •1. Методы разрушения тканей и экстракции белков:
- •Вопрос №9
- •Вопрос №10
- •Вопрос №13
- •Ферменты Вопрос №17
- •Название ферментов
- •Вопрос №27
- •Вопрос №18
- •Вопрос №21
- •Вопрос №19
- •Вопрос №20
- •Вопрос №22
- •В основе всех 4 типов регуляции лежит изменение конформации ферментов.
- •Вопрос №26
- •Вопрос №23
- •Кинетика ферментативных реакций
- •Вопрос №24
- •Вопрос №25
- •Уравнение Лайнуивера—Бэрка
- •Вопрос №28
- •Нуклеиновые кислоты и нуклеотиды Вопрос №29
- •Вопрос №30
- •Вопрос №31
- •Вопрос №32
- •Вопрос №33
- •Вопрос №34
- •Вопрос №35
- •Транскрипция
- •Трансляция
- •Посттрансляционные модификации
- •Вопрос №36
- •Вопрос №37
- •Общий путь катаболизма Вопрос №38
- •Вопрос №39
- •Вопрос №40
- •Вопрос №41
- •Вопрос № 42
- •Вопрос № 43
- •Вопрос №44
- •Вопрос №45
- •Вопрос №46
- •Вопрос №47
- •Обмен углеводов Вопрос №48
- •I стадия – переваривание (в жкт)
- •Глюкоза → Глюкоза-6ф
- •Вопрос №51
- •Вопрос №52
- •Вопрос №54
- •Гликолиз
- •Вопрос №55
- •Вопрос №56
- •Вопрос №61
- •Вопрос №57
- •Вопрос №58
- •Вопрос №63
- •Вопрос №59
- •Пентозофосфатный путь (пфп)
- •Вопрос №60
- •Вопрос №62
- •Глюконеогенез (гнг)
- •Обмен белков Вопрос № 67
- •Вопрос №68
- •Вопрос №71
- •Вопрос №72
- •Вопрос №73
- •Вопрос №74
- •Вопрос №75
- •Вопрос №77
- •Вопрос №78
- •Вопрос №79
- •Вопрос №80
- •Обмен липидов Вопрос №81
- •Вопрос №82
- •Вопрос №87
- •Вопрос №88
- •Вопрос №89
- •Вопрос №90.
- •Вопрос №92
- •Вопрос №94
- •Вопрос №97
- •Вопрос № 98
- •Вопрос №100
- •Обмен нуклеотидов Вопрос №102
- •Вопрос №103
- •Вопрос №104
- •Вопрос №105
- •Вопрос №106
- •Витамины
- •Вопрос №125
- •Общие принципы регуляции метаболических процессов в организме человека Вопрос №128
- •I. По химической структуре:
- •II. По влиянию на организм:
- •III. По механизму действия:
- •Вопрос №129
- •Гормоны белково-пептидной природы
- •Стероидные гормоны
- •Тиреоидные гормоны
- •Вопрос №130
- •Вопрос №131
- •Вопрос №132
- •Вопрос №133
- •Вопрос №134
- •Вопрос №135
- •Вопрос №136
- •Вопрос №137
- •Вопрос №138
- •Вопрос №139
- •Вопрос №140
- •Вопрос №141
- •Вопрос №142
- •Аденилатциклазный механизм
- •Механизм действия гормонов через рецепторы, обладающие ферментативной активностью
- •Вопрос №143.
- •Вопрос №144
- •Механизм действия через липиды мембран
- •Биохимия органов и тканей Вопрос №145
- •Вопрос №147
- •Вопрос №148
- •1. Первичный гемостаз
- •3. Фибринолиз
- •Вопрос №149
- •Вопрос №150
- •Вопрос №151
- •Вопрос №152
- •Вопрос №153
- •Желтуха
- •2. Печеночная
- •3. Подпеченочная
- •4. Физиологическая желтуха новорожденных
- •Вопрос №154
- •1 Стадия обезвреживания: гидрофобное → гидрофильное
- •2 Стадия: конъюгация
- •Вопрос №159
- •Вопрос №160
- •Вопрос №161
- •Вопрос №162
- •Вопрос №163
- •1) Синтез препро-α-цепей
- •2) Внутриклеточные модификации
- •3) Секреция
- •4) Внеклеточные модификации
- •Вопрос №167.
- •Вопрос №169
Н адеюсь,
что это вообще когда-нибудь пригодится!
адеюсь,
что это вообще когда-нибудь пригодится!
Ответы к экзамену
По биохимии

1
СТРУКТУРА И ФУНКЦИИ БЕЛКОВ 3
ФЕРМЕНТЫ 10
НУКЛЕИНОВЫЕ КИСЛОТЫ И НУКЛЕОТИДЫ 20
ОБЩИЙ ПУТЬ КАТАБОЛИЗМА 31
ОБМЕН УГЛЕВОДОВ 45
ОБМЕН БЕЛКОВ 56
ОБМЕН ЛИПИДОВ 73
ОБМЕН НУКЛЕОТИДОВ 85
ВИТАМИНЫ 90
ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА 92
БИОХИМИЯ ОРГАНОВ И ТКАНЕЙ 114
Сделано второкурсницей с красными глазами, ничего не соображающей в биохимии,
Трубицыной Викторией Владимировной
БелГУ
июнь 2014
ВВЕДЕНИЕ В БИОХИМИЮ
Вопрос №1
Предмет и задачи биологической и клинической химии.
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей.
Биохимия – это наука о молекулярных основах жизни.
Статическая – химические формулы строения веществ
Динамическая – последовательность реакций и процессов
Функциональная – биохимия тканей и органов.
Предмет - выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях.
Современная биохимия решает следующие задачи:
1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок.
2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков.
3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками.
4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач.
Клиническая химия (также известна как клиническая биохимия или медицинская биохимия) - область клинической лабораторной диагностики, использующая методы аналитической химии для исследования биологических объектов на предмет содержания определенных химических веществ с целью диагностики заболеваний или патологических состояний организма.
Структура и функции белков Вопрос №4
Аминокислоты - структурные мономеры белков. Общая характеристика, классификация (полярные, неполярные, полярные незараженные). Особенности образования пептидной связи. Первичный уровень организации белка.
Белки – это биополимеры, состоящие из α-аминокислотных остатков, соединенных пептидной связью.
Пептиды – цепочка до 10 аминокислотных остатков
Полипептиды – более 10 аминокислотных остатков
Протеины = белки – от 6 000 аминокислотных остатков
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы
В белках обнаружено 20 АМК.
П ри
нейтральном рН - в виде биполярных ионов.
ри
нейтральном рН - в виде биполярных ионов.
Классификация по заряду радикала:
неполярные незаряженные (гидрофобные) - с алифатическим (Ала, Вал, Лей, Иле, Мет, Про) и ароматическими (Фен, Тпф) радикалами. Радикалы стремятся к друг другу или другим гидрофобным молекулам и поверхность их соприкосновения с водой уменьшается.
полярные незаряженные - Сер, Тре, Тир (ОН-группы), Асн, Глн (NH2-группа), Цис (SH-группа), Гли. Лучше растворяются, т.к. имеют полярные функциональные группы.
Полярные - полярные отрицательно заряженные - Асп, Глу (СООН-группа). При рН 7 радикал - анион.
П
 олярные
- полярные положительно заряженные -
Арг, Лиз, Гис. Наибольшая растворимость
в воде.
олярные
- полярные положительно заряженные -
Арг, Лиз, Гис. Наибольшая растворимость
в воде.


П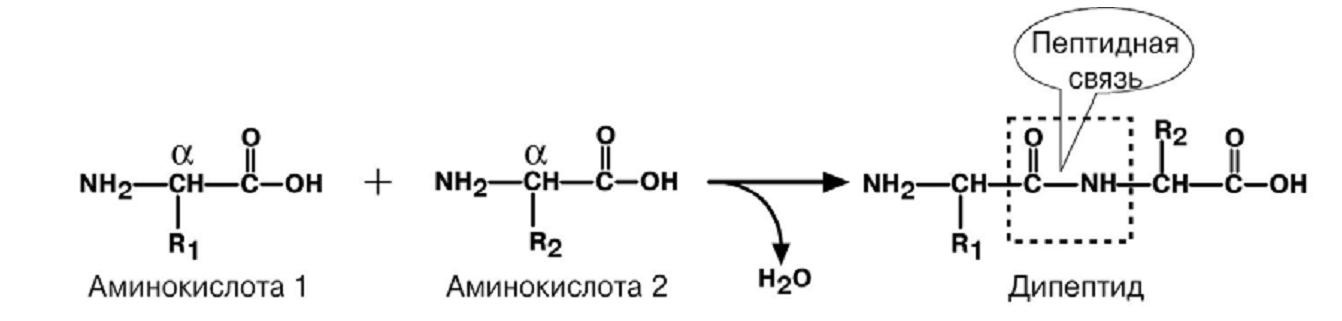 ервичная
структура
– последовательность аминокислотных
остатков, соединенных пептидной связью.
ервичная
структура
– последовательность аминокислотных
остатков, соединенных пептидной связью.
Н ачинается
со свободной аминогруппы (N-конец),
завершается свободной карбоксильной
группой (С – конец). Нумерация с N-конца.
Названия всех аминокислот с окончанием
-ил, последней - как обычно.
ачинается
со свободной аминогруппы (N-конец),
завершается свободной карбоксильной
группой (С – конец). Нумерация с N-конца.
Названия всех аминокислот с окончанием
-ил, последней - как обычно.
При рН > 7 (кровь) пептидная связь енолизируется.
Наличие С = С придает пептидной связи планарный характер, т. е. вращение между N и О затруднено, что делает первичную структуру белков более жесткой.
NB!: Первичная структура белка имеет важное значение для индивидуальных (нативных) свойств пептида, полипептида и белков, Т. Е. последовательность аминокислот в любом белке строго специфично и детерминирована генами. Такая последовательность аминокислот формирует уникальную для каждого белка вторичную, третичную и четвертичную структуру.
К первичной структуре можно отнести дисульфидные мостики, образованные остатками цистеина.
– S – S –
Следовательно, первичная структура стабилизируется ковалентными связями между аминокислотными остатками.
