
Otvety_po_Biletam_s_praktikoy
.docБилет № 1
1. Биоорганическая химия –изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, с познанием их биологичеких функций
Основные объекты 1) биополимеры(высокомолекулярные природные соединения, являющиеся структурной основой всех живых организмов и играющие определенную роль в процессах жизнедеятельности (пептиды, белки, полисахариды, нуклеиновые кислоты). 2) Биорегуляторы – соединения которые химически регулируют обмен веществ (витамины, гормоны, лекарственные вещества). Целью изучения БХ в вузах – формирование системных знаний о взаимосвязи строения химических веществ биологических классов органических соединений.
Задачи: 1. Разработка методов выделения и очистки прир. Соединений. 2. Определение строения и конфигурации изучаемого соед., 3. Разработка методов синтеза как самих прир. биологически важных в-в, так и ряда их аналогов. 4. Изучение зависимости биол. действия от строения. 5. Выяснение химизма взаимодействия биологически активного в-ва с живой клеткой или с ее компонентами.
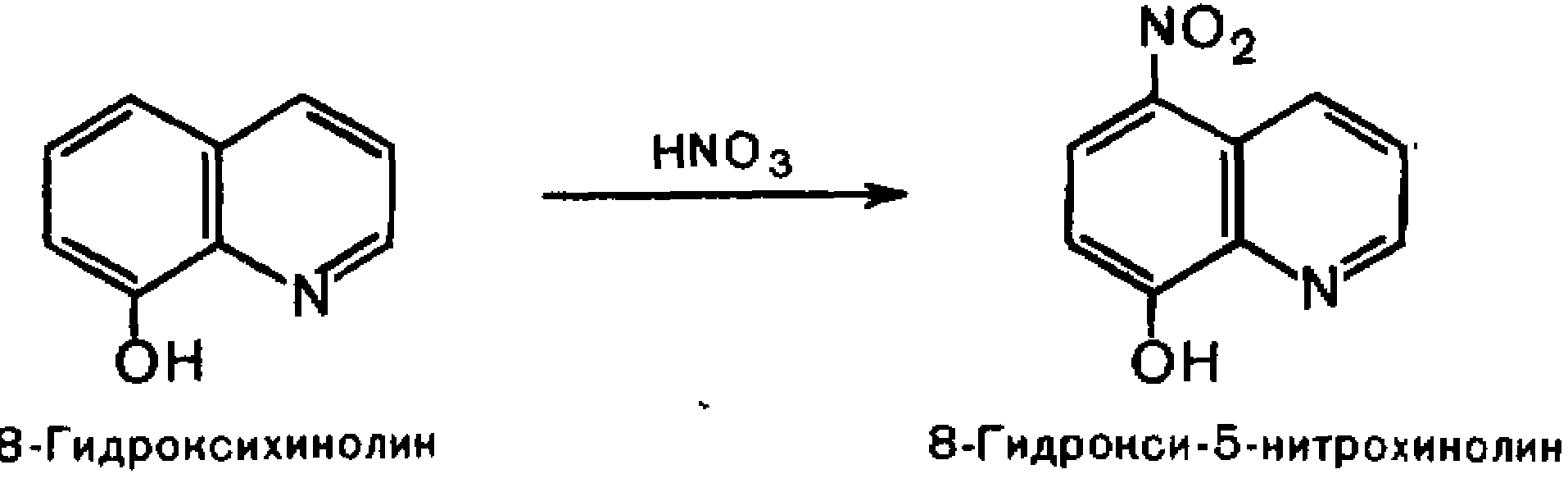
2. Пиразолон-5.
 При
получении лек. Средств пиразольного
ряда в кач-ве исходного соединения
используется ацетоуксусный эфир. Его
конденсация с фенилгидразином
получают1-фенил-3-метилпиразолон-5.
Метилирование последнего ведет к
антипирину. А. Обладает ароматических
характером, нитрозируется в 4-е положение.
Восстановление приводит к амидопирину.
Антипирин и амидопирин применяются в
медицине как жаропонижающее, болеутоляющее
и успокаивающее средства. Анальгин, по
активности и быстроте действия
превосходящий амидопирин и антипирин,
является сульфопроизводным амидопирина.
При
получении лек. Средств пиразольного
ряда в кач-ве исходного соединения
используется ацетоуксусный эфир. Его
конденсация с фенилгидразином
получают1-фенил-3-метилпиразолон-5.
Метилирование последнего ведет к
антипирину. А. Обладает ароматических
характером, нитрозируется в 4-е положение.
Восстановление приводит к амидопирину.
Антипирин и амидопирин применяются в
медицине как жаропонижающее, болеутоляющее
и успокаивающее средства. Анальгин, по
активности и быстроте действия
превосходящий амидопирин и антипирин,
является сульфопроизводным амидопирина.

Барбитуровая
кислота. Представляет собой циклический
уреид малоновой кислоты. М\б получена
взаимодействием малонового эфира с
мочевиной, в присутствии этоксида
натрия. Большую роль играет в кач-ве
снотворных ипротивосудорожных средств
играют барбитураты ( 5,5-дизамещенные
производные этой кислоты). Их получают
как Б. кислоту, использую дизамещенные
эфиры малоновой кислоты. Они легко дают
водорастворимые соли с эквивалентом
щелочи. Примеры: Барбитал (5,5
диэтилбарбитуровая кислота), Барбитал
натрий, фенобарбитал (5-этил-5-фенилбарбитуровая
кислота)(люминал). Тиамин (витамин В1)
– один из важнейших витаминов. Недостаток
витамина В1
приводит к заболеванию, известному как
«бери-бери». Потребность этого витамина
связана с тем, что он входит в структуру
кофермента кокарбоксилазы, принимающего
участие в декарбоксилировании кетонокислот
и синтезе ацетилкофермента А


Гидроксипурины – 6-гидроксипурин (гипоксантин), 2,6-дигидроксипурин (ксантин) и 2,6,8-гидроксипурин (мочевая кислота) – образуются в ходе метаболизма в организме нуклеиновых кислот. У гидроксипуринов возможна лактим-лактамная таутомерия и миграция атома водорода м\у положениями 7и 9. Мочевая кислота – конечный продукт метаболизма пуриновых соединений в организме. М. кислота двухосновна, плохорастворима в воде, но легко в щелочах, образуя соли с щелочью. Соли М. кислоты называются уратами. При некоторых нарушениях в организме они откладываются в суставах, напр, при подагре, а также виде почечных камней. Ксантин и гипоксантин аналогичны мочевой кислоте. Амфотерны, образуют соли с щелочами и кислотами. N-метилзамещенные производные ксантина относятся к алкалоидам.


Биотин (витамин Н), его отсутствие в пище нарушает обмен белков и жирова в организме и ведет кожным заболеваниям. Молекула биотина – бициклическая система: тетрагидротиофеновое кольцо, содержащее остаток валериановой кислоты, конденсировано с мочевиной. В Б. 3 центра харальности – возможно 8 стереоизомеров биологически активен только 1. +-биотин. Биотин принимает участие в реакциях переноса карбоксильных групп. Пример: образование малонил КоА из ацетил КоА и диоксида углерода.


4
 5.
5.

Билет № 2.
1. Спиртами называются производные углеводородов, в молекулах которых содерж. Одна или несколько ОН групп, связанных с насыщ. атомами углерода. По числу Он групп делятся на двухатомные и одноатомные. Свойства: образование алкоголятов, образование сложных и простых эфиров, галогенирование, внутримолекулярная дегадратация. Биологически важные: глицерин,бутиловые и амиловые спирты(входят в состав сивушных масел)
Фенолы – производные Аренов, в которых один или несколько атомов водорода замещены на гидроксильные группы. Ф. в большинстве реакций по связи активнее спиртов, эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца. Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце. Фенол (антисептик, очень токсичен), Крезол (обеззараживающее ср-во)
Тиолы - содержат в молекуле меркаптогруппу —SH (сульфгидрильную группу), непосредственно связанную с орг. Радикалом. Полярность связи S-H значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов
Тиолы обладают слабыми кислотными свойствами. Кофермент А.
Сложные эфиры. Продукты замещения атомов водорода групп ОН в минер. или карбоновых к-тах на углеводородные радикалы. Большинство р-ций эфиров сложных связано с нуклеоф. атакой по карбонильному атому углерода и замещением алкоксигруппы. Жиры,воска
Простые эфиры - бесцв. жидкости (табл.) с характерным запахом; они не образуют межмол. водородных связей, в отличие от спиртов не ассоциированы и поэтому более летучи, чем спирты с тем же числом углеродных атомов. Эфиры простые плохо раств. в воде, хорошо - в орг. р-рителях, растворяют орг. Соед. диэтиловый эфир
Сульфиды. Тиоэфиры — жидкости или легкоплавкие твёрдые вещества, обладающие характерным «сераорганическим» запахом. Сульфиды органические -более слабые основания, чем простые эфиры, но обладают большей нуклеофиль-ностью. С разл. электроф. реагентами (к-ты Льюиса, соли тяжелых металлов) образуют донорно-акцепторные комплексы. Р-ция сульфидов органических с алкилиодидами, диалкилсульфатами и алкилсульфонатами, а также со спиртами в присут. к-т приводит к солям сульфония Тиоэфирная группа входит в состав важных биологических соединений — витамина B7 и незаменимой аминокислоты метионина.
Альдегиды и кетоны. Альдегиды и кетоны весьма схожи, различие заключается в том, что последние имеют при карбонильной группе два заместителя. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры: С=О <=> С+—О−. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная. Токсичны. Способны накапливаться в организме. Кроме общетоксичного, обладают раздражающим и нейротоксическим действием. Муравьиный альдегид(обладает способностью свертывать белки дезинфицирующее средство и консервант анатомических препаратов).
Карбоновые кислоты. Проявляют высокую реакционную способность и вступают в реакции с различными в-вами, образуя разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Сульфокислоты обладают всеми характерными св-вами кислот: образуют соли и эфиры (сульфонаты), галогенангидриды (сульфогалогениды), ангидриды, амиды и т.д. При восстановлении сульфокислот или сульфохлоридов цинковой пылью образуются сульфиновые кислоты RS(O)OH, при использовании сильных восстановителей или в кислой среде-тиолы RSH.
ульфокислоты мало распространены в природе. Из алифатических сульфокислот выделены таурин NH2CH2CH2SO2OH и цистеиновая к-та NH2CH(CH2SО2ОH)CООH-метаболиты обмена в-в животных; из ароматических-6-амино-1 -карбокси-10-метил-3-сульфофеназин (аэругинозин В).
2. Алкалоидами называют гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим действием. Алкалоид предствляют собой третичные амины и содержатся виде солей органических кислот. А бесцветные кристаллические вещества горького вкуса, практически не растворимы вводе, но растворимые в органических растворителях – эфире, хлороформе и т.д. Соли растворимы в воде и нерастворимы в орг. Растворителях. В основе структуры алкалоидов обычно лежит какой либо гетероцикл. К алкалоидам пуринового ряда относятся метилированные по азоту производные ксантина – 1,3,7-триметилксантин или кофеин, 1,3-диметилксантин или теофиллин и 3,7-диметилксантин или теобромин. Их природными источниками служат листья чая, зерна кофе, бобы какао. Кофеин может быть получен при метилировании ксантина, теофиллина и теобромина метилйодидом. Кофеин- эффективное средство, возбуждающее ЦНС и стимулирующее работу сердца. Теофиллин и теобромин обладают сильными мочегонными свойствами, т.е являются диуретиками.




4.

5.

Билет №3
1. Хроматография – метод основанный на различном распределении веществ между подвижной (поток жидкости или газов) и неподвижной (твердой или жидкой) фазами. Выделяют газовую, газожидкостную и жидкостную хроматографию. По типу взаимодействия разделенных веществ с фазами выделяют адсорбционную, распределительную, ионообменную, гель-хроматографию и электрофорез.. Адсорбционная хроматография основана на различном в относительном сродстве компонентов разделяемой смеси к твердым адсорбентам, в качестве которых используются порошкообразные вещества. Распределительная хроматография основана на разделении веществ за счет различия коэффициентах распределения между двумя или более несмешивающимися жидкими фазами или неподвижной жидкой и газовой фазами. Ионообменная хроматография обратимый обмен ионов, содержащихся в растворе разделяемой смеси, на ионы полимерных смол, называемые ионитами и используемых в качестве неподвижной фазы. Гельхроматография метод разделения, очистки и анализа веществ основанный на различии в размерах или массе молекул. Электрофорез – метод разделения смеси веществ под действием электрического тока. УФ-спектроскопия и спектроскопия в видимой области, применяется для идентификации и установления строения соединений,анализа их смесей, и кинетических исследований. ИК- спектроскопия в органической химии используется для идентификации и установления строения соединений, изучения внутри- и межмолекулярных взаимодействий (водородные связи), кинетического контроля реакций. ЯМР основан на способности ядер некоторых атомов, имеющих магнитный момент, поглощать электромагнитное излучение, когда они находятся во внешнем магнитном поле. ЭПР применяется для исследования парамагнитных молекул, т.е молекул с неспаренными электронами (свободные радикалы, ион-радикалы). Масс-спектрометрия используется для выяснения структуры орг.соединений, а также для определения их молекулярной массы.
2. α-аминокислоты – гетерофункциональные соединения. Они обязательно содержат карбоксильную группу и аминогруппу, находящиеся у одного и того же углеродного атома. Названия α-аминокислот строятся по систематической номенклатуре, но обычн используют и их тривиальные названия. Эти названия аминокислот чаще всего бывают связаны с источниками выделения. α-аминокислоты делятся на алифатические, ароматические и гетероциклические. С учетом общего числа карбоксильных и аминогрупп в молекуле, А. подразделяются на нейтральные, основные и кислые. Нахождение у одного и того же атома водорода уже сам по себе предопределяет хиральность α-углеродного атома. Большинство А. содержит один ассиметрический атом углерода и существует в виде двух оптических энантиомеров и одного рацемата. Искл: изолейцин, треонин, цистин и гидроксипролин. Все природные аминокислоты принадлежат к L-ряду. Аминокисл. D-ряда называют неприродными (не используются для построения белков). А. являются амфотерными соединениями, что обусловлен оналичием функциональных групп кислотного и основного характера. В водном растворе А. существует виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Положение равновесия зависит от pH среды

4. [ ] – основной. Включает 8π электронов, двойные связи и неподеленную электронную пару атомов азота, в положении 9, что соответствует правилу Хюккеля, где 4n+2 n=2


5. является структурным элементом многих биологически активных веществ –катехоламинов.
![]()
Билет № 4.
1. Конфигурация – это определенное пространственное расположение атомов в молекуле. Органические соединения могут при одинаковом составе и одинаковом химическом строении различаться конфигурацией. Такие соединения называются конфигурационными изомерами.
Конформации соединений с открытой цепью. Конформации – это пространственное расположение атомов в молекуле определенной конфигурации обусловленной поворотом вокруг одной или нескольких одинарных σ-связей. Конформ. В кот. Заместители находятся в наиб. Близком положении, обладают самой высокой энергией и называются заслоненными. Конф., в кот заместители расположены наиб., далеко друг от друга назыв., заторможенными. Напряжение, вызванное взаимодейств., противостоящих связей назыв., торсионным напряжением. В более сложных соединениях, возникает взаимное отталкивание объемистых заместителей, которое повышает энергию системы, т.е делает систему более напряженной. Напряж., возникающее при расположении заместителей на расстоянии, приблизиетльно равном сумме их Ван-дер-ваальсовых радиусов, называется Ван-дер-ваальсовым напряжением. Конформации с углом 600 м\у двумя СН3-группами называются скошенными, или гош-конформациями. Энергия скошенной конформ, выше энергии заторможенной конформ. В длинных углеродных цепях вращение может происходить вокруг нескольких C-C связей. Длинные цепи насыщенных углеводородов имеют зигзагообразную конформацию. Это наиболее выгодное положение цепи связано с тем, что атомы углерода в ней находятся по отношению друг к другу в анти-бутановой конформации. Проекционные формулы Ньюмена получаются при перенесении проекции молекулы вдоль С-С связи. Перспективные формулы и проекционные формулы Ньюмена удобны для изображения меняющегося пространственного расположения заместителей в следствие вращения вокруг С-С связи.




2 .
Восстановительное аминирование –
общий способ
.
Восстановительное аминирование –
общий способ
получения первичных аминов из альдегидов и кетонов. В орг-ме осуществляется такой же процесс только в кач-ве оксосоединений используются кетонокислоты, а восстанавливающим агентом является кофермент НАД*Н. В процессе этой реакции образуется только один стереоизомер, Аминокисл., L-ряда, что обусловлено стереоспецифическим строением фермента, катализирующим эту реакцию .Например: α-кетоглутаровая кислота превращ. в глутаминовую.

4. Статический фактор CH3C+CH2CH3 – влияние положительного индуктивного эффекта.
Динамический фактор: CH3C+CH2CH3 – более устойчивый карбкатион.

5.


Билет № 5.
1. Конфигурация – это определенное пространственное расположение атомов в молекуле. Органические соединения могут при одинаковом составе и одинаковом химическом строении различаться конфигурацией. Такие соединения называются конфигурационными изомерами.
![]()
![]()






2. Хим. Сво-ва аминокислот
Образование эфиров Образование галогенангидридов


Образование N-ацильных производных Образование оснований Шиффа
![]()

 Неокислительное
дезаминирование происходит с участием
ферментов в живых организмах и образуются
α,β непредельные кислоты:
Неокислительное
дезаминирование происходит с участием
ферментов в живых организмах и образуются
α,β непредельные кислоты:
HOOCCH(NH2)CH2CH(CH3)2 - HOOCCH=CH(CH3)2+NH3(фермент аспартаза). Образование солей. А. образуют основаниями обычные соли; с катионами тяжелых металлов – внутрикомплексные соли. Напр: с Cu(OH)2 дает хелатные соли синего цвета.

4.

![]()



5.

Билет №6
1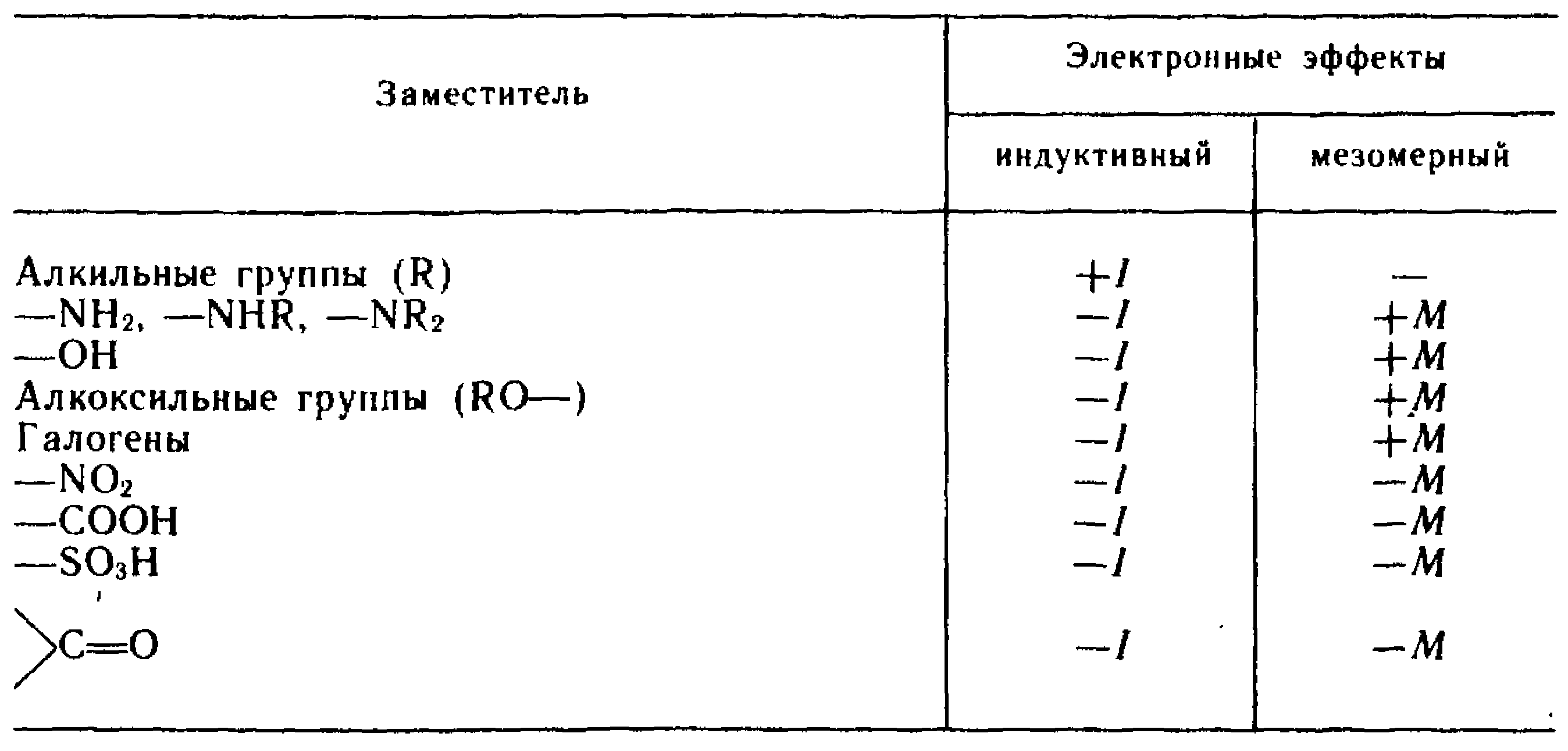
 .
Реакционная способность соединений в
знач. Степени зависит от характера
распределения электронной плотности
в нереагирующих молекулах. Распределение
электронной плотности является следствием
электронных эффектов заместителей.
Индуктивный эффект – это передача
электронного влияния заместителей по
цепи σ-связей. заместитель притягивающий
Эл. Плотность проявляет отриц индуктивный
эффект. Если заместитель увелич Эл.
Плотность в цепи, то он проявляет полож.
Инуктив., эффект. +I
эффектом обладают алкильные группы,
атомы металлов и анионы. Отриц. Индуктив.
Эффектом обладает большинство
электроотрицательных заместителей.
.
Реакционная способность соединений в
знач. Степени зависит от характера
распределения электронной плотности
в нереагирующих молекулах. Распределение
электронной плотности является следствием
электронных эффектов заместителей.
Индуктивный эффект – это передача
электронного влияния заместителей по
цепи σ-связей. заместитель притягивающий
Эл. Плотность проявляет отриц индуктивный
эффект. Если заместитель увелич Эл.
Плотность в цепи, то он проявляет полож.
Инуктив., эффект. +I
эффектом обладают алкильные группы,
атомы металлов и анионы. Отриц. Индуктив.
Эффектом обладает большинство
электроотрицательных заместителей.
![]()

![]()

![]()

2.




![]()
![]()
![]()

4. Реакции электрофильного замещения

5. 1,2) мономолекулярное нуклеофильное замещение 3)нуклеофильное присоединение

Билет №7.
1.
2 .
.

3.

4.


5.


Билет № 8.
1 .
.
![]()
![]()
2




![]()




![]() .
Моносахариды:
Классификация-
альдозы (моносахариды содержащие
альдегидную группу)- кетозы (моносахариды
содержащие кетозную группу)
.
Моносахариды:
Классификация-
альдозы (моносахариды содержащие
альдегидную группу)- кетозы (моносахариды
содержащие кетозную группу)
Моносахариды в зависимости от длины углеродной цепи (3-10 атомов) делятся на триозы, пентозы, гексозы, гептозы и т.д. Стереоизомерия:Относительная конфигурация моносахаридов, т. е принадлежность к D- или L- стереохимическому ряду, определяется путем сравнения конфигурации хирального атома углерода имеющего наибольший номер, с конфигурацией хирального центра в D- или L- глицериновом альдегиде
Открытые и циклические формы: Пяти- и шестиугольные цепи могут иметь клешневидную конформацию. За счет внутримолекулярного воздействия гидроксильной и альдегидной (кетонной) групп образуется циклический полуацеталь. В циклической группе появляется дополнительный центр хиральности (ранее ассиметрический атом углерода входил в оксогруппу). Это хиральный центр называется аномерным. У α-аномера конфигурация совпадает с конфигурацией «концевого» хирального центра. У β-аномера – противоположна. Фуранозы и пиранозы α- и β-аномеры: Для 5ти и 6ти членных цепей может быть характерна клешневидная конформация. У альдогексоз в реакцию с альдегидной группой приемущественнао вступает гидроксильная групп С5’, так как при этом образуется термодинамически устойчивый шестичленный цикл (пиранозный). Если в реакцию вступает гидроксильная группа у С4, то полуацеталь содержит 5ти членный цикл, называемый фуранозным. Аномерные атомы углерода в α и β-формах имеют противоположную конфигурацию. Но из-за наличия нескольких центров хиральности не являются энантиомерами, а относятся как диастереомеры. Эпимеры и аномеры являются частным случаем диастереомеров. Эпимеры различаются конфигурацией только одного хирального атома углерода. Аномеры – конфигурации отличающиеся по аномерному атому. Формулы Хеуорса: Формулы Фишера неудобны для изображения оксидного цикла, поэтому в циклической форме их принято записывать формулами Хеуорса. Правила перехода от формул Фишера к формулам Хеуорса: 1. В формуле Фишера производят четное число перестановок заместителей при том атоме углерода, гидроксильная группа которого участвует в образовании цикла. Внизу должна оказаться ОН – группа 2. Все заместители, находящие слева от линии углеродной цепи в фишеровской проекции, располагают над плоскостью Хеуорса Цикло-оксо таутомерия (кольчато-цепной): Существование в виде равновесной смеси открытой и циклических форм.
Конформация пиранозных форм моносахаридов: Установлено, что из 2х конформаций пиранозного цикла в D-глюкопиранозе осуществляется та, в которой все большие по размеру заместители – первичноспиртовая и гидроксильные группы – находятся в эваториальном положении. Полуацетальная гидроксильная группа у β-аномера D-глюкопиранозы занимает экваториальное положение, у α-аномера – аксиальное положение. Поэтому в смеси преобладает β-аномер(68%)Стремление RO-группы занять не экваториальное, а аксиальное положение в данном случае связано с так называемым аномерным эффектом. Он является результатом отталкивания между сближенными в пространстве электронными парами двух атомов кислорода.
