
- •Государственное бюджетное образовательное учреждение
- •Содержание
- •Тема 1. Первый закон термодинамики. Термохимия 4
- •Тема 1. Первый закон термодинамики. Термохимия Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •II. Первый закон термодинамики
- •Лабораторная работа «Тепловой эффект реакции нейтрализации»
- •Теоретическая часть
- •Порядок выполнения работы
- •Определение постоянной калориметра
- •Сильным основанием
- •Расчет ошибки эксперимента
- •Тема 2. Второй закон термодинамики
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •Тема 3. Фазовое равновесие Учебные цели
- •Учебные вопросы
- •Тема 4. Коллигативные свойства растворов Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •I. Растворы: классификация, способы выражения концентрации растворов
- •II. Закон Рауля для разбавленных растворов неэлектролитов. Следствия закона о повышении температуры кипения и понижении температуры замерзания раствора
- •Тема 5. Двойные жидкие системы Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •Тема 6. Буферные растворы Учебные цели
- •Литература
- •Теоретическая часть
- •Методические указания студентам по подготовке к занятию
- •Лабораторная работа «Буферные растворы»
- •Порядок выполнения работы Приготовление фосфатных буферных растворов
- •Определение меры буферной емкости
- •Тема 7. Электрическая проводимость растворов Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •Лабораторные работы «Кондуктометрическое титрование» «Определение степени и константы диссоциации слабого электролита»
- •Теоретическая часть
- •Порядок выполнения работы «Кондуктометрическое титрование»
- •Порядок выполнения работы «Определение степени и константы диссоциации слабого электролита»
- •Тема 8. Потенциометрия Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятиям
- •II. Классификация элементов, измерение эдс
- •III. Значение потенциометрических измерений. Определение рН среды потенциометрическим методом
- •Тема 9. Химическая кинетика и катализ Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятиям
- •III. Влияние температуры на скорость реакции. Уравнения Вант-Гоффа и Аррениуса
- •IV. Сложные реакции. Принцип независимости
- •Тема 10. Адсорбционные процессы на границе жидкость-газ Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •I. Поверхностная энергия и поверхностные явления
- •III. Адсорбция на границе газ-жидкость
- •Тема 11. Адсорбционные процессы на границе твердое тело - раствор Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •I. Молекулярная адсорбция
- •II. Ионная адсорбция
- •Тема 12. Адсорбция на границе жидкость-жидкость. Эмульсии Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •I. Определение, классификация и свойства эмульсий
- •II. Устойчивость и разрушение эмульсий. Обращение фаз
- •Тема 13. Строение мицеллы лиофобных золей Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •Тема 14. Устойчивость, коагуляция и стабилизация гидрофобных золей Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •III. Особые явления, наблюдающиеся при электролитной коагуляции
- •Тема 15. Молекулярно-кинетические и оптические свойства дисперсных систем Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •II. Оптические свойства дисперсных систем. Методы исследования, основанные на оптических свойствах
- •Тема 16. Коллоидная химия высокомолекулярных соединений. Набухание вмс Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •III. Полимерные электролиты
- •Тема 17. Коллоидная химия высокомолекулярных соединений. Вязкость растворов вмс Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •III. Вискозиметрия и её применение
- •Тема 18. Свойства гелей и студней. Коллоидные поверхностно-активные вещества Учебные цели
- •Учебные вопросы
- •Литература
- •Методические указания студентам по подготовке к занятию
- •Олишевец Людмила Ивановна
Тема 6. Буферные растворы Учебные цели
Поддержание кислотно-щелочного баланса на необходимом уровне является одним из важнейших факторов общего гомеостаза живых организмов. Это выражается в достаточно постоянных значениях рН биологических сред и в способности восстанавливать рН при поступлении в эти среды кислот и оснований. В результате жизнедеятельности в организме образуется большое количество углекислоты (до 13 моль ежесуточно). При некоторых патологических процессах, например при диабете, образуется значительное количество нелетучих кислот (до 1 моль в сутки ацетоуксусной и β-оксимасляной кислот). От кислот организм освобождается благодаря физиологическим процессам: дыханию (от летучей кислоты СО2) и мочевыделению (от нелетучих кислот). Основания, которые образуются в процессе метаболизма аминокислот и белков, выводятся через почки. Но с помощью физиологических процессов кислоты и основания выводятся из организма достаточно медленно, а быстрая их нейтрализация и поддержание рН осуществляется за счет физико-химических процессов в буферных системах. Основными буферными системами организма являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Все эти системы имеются в крови, где с их помощью строго поддерживается рН=7,40±0,05, несмотря на поступление из кишечника и тканей значительного количества кислот и небольшого - оснований.
Буферные растворы находят широкое применение в аналитической химии, например, при количественном определении ионов металлов в биологических жидкостях методом комплексонометрического титрования.
Изучив тему вы должны
«знать»
Что такое буферные растворы, их классификацию.
Состав и механизм действия кислотных и основных буферных растворов.
Что такое буферная емкость, от каких факторов она зависит.
«уметь рассчитывать»
рН буферного раствора по уравнению Гендерсона-Хассельбаха.
«иметь практические навыки»
Готовить 0,1н и 0,01н фосфатные буферные растворы.
Определять и рассчитывать рН приготовленных буферных растворов.
Определять величину меры буферной емкости методом титрования.
Работать с мерной химической посудой.
Литература
Беляев А.П., Кучук В.И., Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия: Учебник / Под ред. Проф. Беляева А.П. – М.: ГЭОТАР - Медиа, 2008, стр. 216-219.
Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия: учебник для фармацевтических ВУЗов и факультетов/ под ред. Евстратовой К.И. – М.: Высш. шк., 1990,
стр. 128-131.
Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.З. Общая химия. Химия биогенных элементов: учебник для ВУЗов/ под ред. Ершова Ю.А. – 2-е изд., испр. и доп. – М: Высш. шк., 2000,
стр. 108-119.
Теоретическая часть
Буферным называют раствор, способный поддерживать практически постоянное значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи. Компонентами протолитических буферных растворов являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару.
Буферные системы делятся на кислотные и основные. Кислотные буферные растворы содержат слабую кислоту (донор протона) и соль этой кислоты (акцептор протона). К ним относятся ацетатная буферная система - СН3СООNa, СН3СООН; гидрокарбонатная - NaНСО3, Н2СО3; гидрофосфатная – Na2HPO4, NaH2PO4. Основными буферными растворами называются растворы, содержащие слабое основание (акцептор протона) и соль этого основания (донор протона). К основным буферным растворам относится аммиачный буфер - NH3·Н2О, NH4Cl.
Механизм буферного действия рассмотрим на примере ацетатного буферного раствора. В кислотной буферной системе наблюдаются два процесса: один обратимый – диссоциация слабой кислоты:
СН3СООН ↔ Н+ + СН3СОО-
другой необратимый – диссоциация соли:
СН3СООNa → Na+ + СН3СОО-
По закону действующих масс константа диссоциации для уксусной кислоты
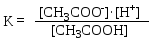
![]()
Концентрация в растворе акцептора протона (СН3СОО-) определяется в основном концентрацией соли СН3СООNa, т.к. диссоциация слабой уксусной кислоты в присутствии сильного электролита – её соли, подавляется. Т.к. уксусная кислота диссоциирует очень слабо, то считают, что концентрация её не изменилась. Поэтому уравнение (1) можно представить в виде
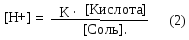
Логарифмируя уравнение (2), получают
lg[Н+] = lgК + lg[кислота] - lg[соль].
Меняют знаки на обратные:
-lg[Н+] = -lgК - lg[кислота] + lg[соль], т.е.
рН = рКа - lg[кислота] + lg[соль], т.е.
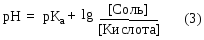
В соответствии с уравнением Гендерсона - Хассельбаха (3), рН кислотной буферной системы зависит от показателя константы диссоциации слабой кислоты рКа и отношения концентраций акцептора протона (соли) и донора протона (кислоты) в растворе.
При добавлении небольших количеств сильной кислоты (например, НCl→Н+ + Cl-), казалось бы должно произойти увеличение концентрации ионов водорода. Однако этого не происходит, т.к. катионы Н+ связываются акцептором протона буферного раствора c образованием малодиссоциирующей уксусной кислоты:
Н+ + СН3СОО- → СН3СООН
Значение рН среды не изменяется.
При добавлении небольших количеств щелочи (например, NaOH→Na+ + OH-) анионы ОН- связываются донором протона с образованием малодиссоциирующего соединения – воды:
OH- + СН3СООН → СН3СОО- + Н2О
Значение рН среды поддерживается постоянным.
При разбавлении буферного раствора водой концентрация кислоты и соли изменяются в одинаковое число раз и их отношение остается постоянным, например,
[Н+] = К · 0,1 / 0,1 = К · 0,01 / 0,01 = К · 0,001 / 0,001 = const.
Защитные свойства буферных растворов по отношению к действию кислот и щелочей будут сохраняться до тех пор, пока концентрации компонентов буферного раствора, связывающих Н+ или ОН-, будут больше концентрации добавляемых ионов:
с(Н+)добавл<[акцептор протона]; с(ОН-)добавл<[донор протона].
Для характеристики сопротивляемости буферных растворов к добавлению кислот или оснований введено понятие буферная емкость. Буферная емкость – способность буферного раствора сохранять постоянство рН при добавлении некоторого количества кислоты или щелочи.
Мерой буферной емкости (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу
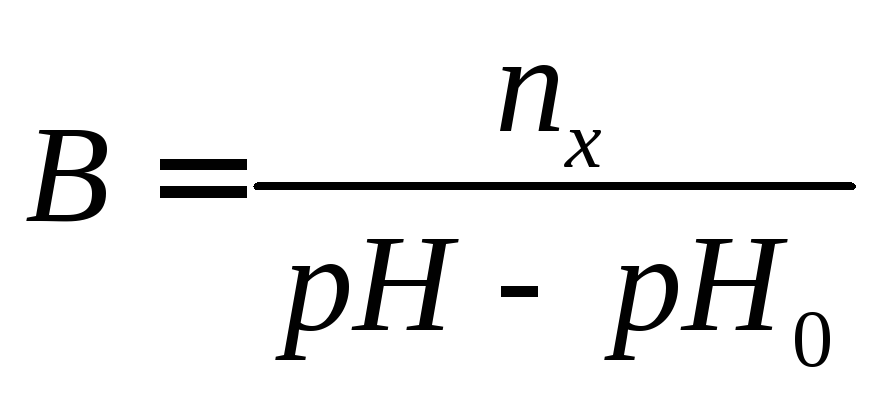 (4),
(4),
где nx – количество моль-эквивалентов кислоты или щелочи,
рН0 и рН – водородный показатель буферного раствора до и после титрования.
Мера буферной емкости зависит от концентраций компонентов в буферном растворе. Чем выше концентрация компонентов, тем больше буферная емкость. Максимальное буферное действие будет наблюдаться при равных концентрациях компонентов в смеси. В таких буферных растворах рН = рКа (4).
