
Repetitor_po_khimii_posle_RIO_16_11
.pdf2) металлы, оксиды которых летучи при высоких температурах: V, W, Mo Os, Ru, Ir, и сплавы, содержащие значительные количества этих металлов.
Параболическая зависимость – сплошная пленка с хорошей адгезией, продолжающая нарастать во времени, вследствие наличия пор. Характерна для Fe < Co < Cu < Ni (металлы расположены по возрастанию устойчивости к газовой коррозии в атмосфере), а также
Mn, Be, Zn, Ti.
Логарифмическая зависимость – пленки с хорошей адгезией и малой пористостью, характерны для Si, Al, Cr (расположены в ряд по возрастанию устойчивости).
Нужно отметить, что окисление некоторых металлов (Fe, Ni, Cu, Al, Zn, Ti, Ta) с изменением внешних условий происходит по разным законам.
10.4. Электрохимическая коррозия. Поляризация и перенапряжение
Электрохимическая коррозия протекает при контакте металла с растворами электролитов. Например, наиболее распространенная атмосферная коррозия протекает в тонких пленках электролитов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (О2, SO2, CO2, NO2, NaCl и др.). Учитывая, что поверхность металла всегда энергетически неоднородна (из-за наличия примесей в металле, различия по химическому и фазовому составу сплава др.), на участках металла, имеющих более отрицательное значение потенциала, идет окисления этого металла. Таким образом, при электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных гальванических микроэлементов.
Во время работы микрогальванического элемента одновременно протекают два электродных процесса.
1) Анодный – процесс выхода ионов металла в раствор с
появлением на его поверхности избытка электронов.
Например: Zn0 – 2ē → Zn2+
Al0 – 3ē → Al3+
Fe0 – 2ē → Fe2+ .
130

2) Катодный – ассимиляция избыточных электронов ионами,
или молекулами электролита: |
|
|
|
2Н+ + 2ē → Н2, |
|
|
|
Сu2+ + 2ē → Cu, |
|
|
|
2НOH + 2ē = Н20 + 2ОН-. |
|
|
|
Термодинамическая |
вероятность |
протекания |
коррозии |
рассчитывается по разности |
потенциалов: |
G0 = –zF(φ0ок |
– φ0вос) и |
∆ G0 < 0, если φ0ок > φ0вос. |
|
|
|
10.4.1. Поляризация и перенапряжение. Величина коррозионного тока после замыкания цепи быстро падает и через определенное время становится постоянной. Уменьшение разности потенциалов, по сравнению с начальной, связано с процессом поляризации. Поляризация – изменение потенциалов в результате протекания тока. Вещества, уменьшающие поляризацию, называют
деполяризаторами.
Причина поляризации – замедление процессов на аноде и катоде.
Причины анодной поляризации, т.е. отставания процесса выхода ионов в электролит от перехода электронов с анодных участков на катодные, заключаются в следующем:
1)замедленность анодной реакции коррозии металла, приводящей к возникновению электрохимической поляризации,
называемой перенапряжением ионизации металла;
2)замедленность диффузии ионов металла от поверхности в объем раствора, которая приводит к концентрационной поляризации анода.
Причинами катодной поляризации, т.е. отставания процесса ассимиляции электронов от поступления на катодные участки электронов, являются:
1)замедленность катодной деполяризационной реакции;
2) замедленность диффузии деполяризатора из объема электролита к катодной поверхности или продуктов катодной деполяризационной реакции в обратном направлении.
Скорость коррозии определяется разностью потенциалов, с
учётом величины перенапряжения: |
E′ =φ′кат – φ′ан, |
где φ′кат= φ0кат – кат; φ′ан = φ0ан + |
ан. |
131

Следовательно, с учетом поляризации термодинамическая
вероятность процесса рассчитывается по формуле:
G′ = –zF E′ = –zF [(φ0кат – кат) – (φ0ан + ан)].
На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной.
10.5.Коррозия с водородной деполяризацией и её термодинамическая вероятность
Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией с
водородной деполяризацией.
С водородной деполяризацией корродируют металлы в растворах кислот, например, стальные железнодорожные цистерны, металлические резервуары и аппараты на химических заводах, металлическое оборудование травильных отделений прокатных цехов и цехов гальванических покрытий, в которых осуществляется кислотное травление окалины и ржавчины.
Электрохимическая коррозия с водородной деполяризацией возможна в растворах при наличии ионов водорода:
а) в виде Н+ (раствор неокислительных кислот); б) в виде НОН (раствор нейтральных солей).
Тип катодного процесса зависит от характера среды раствора электролита:
в кислой среде, при pH < 7, 2Н+ + 2ē = Н2;
в нейтральной и щелочной, pH ≥ 7, 2НOH + 2ē = Н20 + 2ОН-.
Процесс термодинамически возможен в тех случаях, когда равновесный потенциал металла отрицательнее водородного в данных условиях.
Представим схему работы короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите при наличии ионов водорода (рис. 10.4).
132

Рис. 10.4. Схема электрохимической коррозии с водородной деполяризацией
Приведенную выше схему рассмотрим на примере коррозии изделия из цинка, находящегося в контакте с медью в растворе электролита pH < 7.
1. Поместим цинковую пластину в раствор соляной кислоты
(HCl(разб)). Цинк – восстановитель. Взаимодействие идет по реакции: |
|||||||||||||||
|
|
|
|
|
|
|
|
Zn0 |
+ 2HCl = ZnCl2 + Н2↑ |
|
|
|
|||
Zn |
0 |
= Zn |
2+ |
+ 2ē |
|
0 |
= - 0,76 В, |
|
|
|
|||||
|
|
|
|
Mez |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
/ Me |
|
|
|
|
|
|
2Н+ + 2ē = Н2. |
|
φ0H+/H = - 0,059 pH. |
|
|
|
||||||||||
Поскольку |
φ0ок > φ0вос, следовательно, ∆G0 |
< 0; с цинковой |
|||||||||||||
пластины наблюдаем выделение водорода. |
|
|
|
||||||||||||
2. Помещаем в этот раствор медную пластину, не касаясь |
|||||||||||||||
цинковой. Реакция с медью должна проходить по уравнению: |
|||||||||||||||
|
|
|
|
|
|
|
Cu0 |
+ 2HCl = CuCl |
2 |
+ Н ↑ |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
Cu |
0 |
= Cu |
2+ |
+ 2ē |
|
0 |
= + 0,34 В, |
|
|
|
|||||
|
|
|
|
Mez |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
/ Me |
|
|
|
|
|
|
2Н+ + 2ē = Н2. |
|
φ0H+/H = - 0,059 pH. |
|
0 |
|
||||||||||
Установив, |
что |
0 |
ок < |
0 |
|
|
∆G |
> 0, делаем |
|||||||
|
вос, следовательно, |
|
|||||||||||||
вывод – реакция термодинамически невозможна, водород с медной пластины не выделяется.
3. Коснемся медной пластиной цинковой, начинает работать коррозионный гальванический элемент и наблюдается интенсивное выделение водорода с медной пластины.
После контакта металлов цинк, как элемент с более отрицательным потенциалом, отдает электроны, т.е. окисляется: А: Zn0 - 2ē = Zn2+. Ионы металла, образовавшиеся в процессе окисления, переходят в электролит. Электроны, освободившиеся
133

при этом, могут перемещаться к катодному участку (в данном примере Cu), что на рисунке 10.4 показано стрелками. Процесс коррозии будет длиться до тех пор, пока электроны будут удаляться с катодного участка. В противном случае начинается поляризация металлов, то есть отклонение потенциала цинка в более положительную сторону, а меди – в более отрицательную. Разность потенциалов уменьшается, коррозия замедляется, вплоть до прекращения. Однако медь – металл, и является лишь проводником электронов. Ионы водорода подходят к меди, снимают избыток электронов К: 2Н+ + 2ē = Н2, и потенциал меди становится более положительным, то есть разность потенциалов увеличивается – коррозия ускоряется.
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. Таким образом, ионы водорода играют роль деполяризатора.
Чтобы рассмотреть кинетику процесса, необходимо учесть
перенапряжение разрядки водорода на том или ином металле. Так как величина перенапряжения восстановления водорода на цинке
больше ( ηН 2 (Zn) = 0,83), чем на меди ηН 2 (Cu) = 0,64, то водород
на меди разряжается быстрее, чем на цинке, поэтому на меди мы видим более интенсивное выделение водорода.
Термодинамическая вероятность процесса рассчитывается по
формуле: G′ = –zFE′ = –zF [(φ0ок – ок) – (φ0вос + вос)].
Значение перенапряжения может оказать существенное влияние на значение ∆G0 , вплоть до изменения знака на обратный.
10.6. Коррозия с кислородной деполяризацией
Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода,
называются коррозией с кислородной деполяризацией.
В случае, когда коррозия протекает с кислородной деполяризацией, то роль деполяризатора выполняет кислород, растворенный в водном растворе. Этот вид коррозии наиболее распространен в природе: он наблюдается при коррозии металлов в атмосфере (ржавление металлического оборудования различных заводов), в воде (различные охладительные системы, в том числе
134
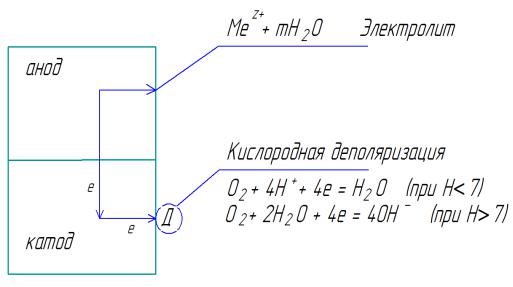
доменных, мартеновских и других печей, металлическая обшивка речных и морских судов) и в почве (трубопроводы).
Рис. 10.5. Схема электрохимической коррозии с кислородной деполяризацией
Взависимости от рН среды возможны два процесса
восстановления кислорода: |
|
при pH < 7, O2 + 4Н+ + 4ē = Н2O, |
φ0 =1,23 В; |
при pH ≥ 7, O2 + 2НOH + 4ē = 4ОН-, |
φ0 =0,40 В. |
Процесс кислородной деполяризации возможен тогда, когда потенциал металла отрицательнее потенциала кислородного электрода в данных условиях.
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к торможению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается.
10.7. Защита металлов от коррозии
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, изменением состава металла, изоляцией поверхности металла от окислителя, снижением концентрации окислителя и др. Выбор того или иного способа определяется его экономичностью и эффективностью. Все методы защиты условно делятся на следующие группы:
1) электрохимическая защита; 2) изменение свойств коррозионной среды; 3) защитные покрытия; 4) легирование металлов; 5) рациональное конструирование.
135

10.7.1. Электрохимическая защита основана на торможении анодных или катодных реакции коррозионного процесса. Заключается в уменьшении скорости электрохимической коррозии при поляризации электрода от источника постоянного тока или при контакте с добавочным электродом, являющимся анодом по отношению к корродирующей системе. Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала –
протектора, а также катодной (катодная защита) или анодной
(анодная защита) поляризацией за счет извне приложенного тока. Наиболее применима в коррозионных средах с хорошей ионной электрической проводимостью.
Катодную защиту с поляризацией от внешнего источника тока применяют для защиты подземных сооружений (трубопроводы и кабели различных назначений, фундаменты, буровое оборудование), оборудования, эксплуатируемого в контакте с морской водой (корпуса судов, металлические части береговых сооружений, морских буровых платформ), внутренних поверхностей аппаратов и резервуаров химической промышленности. Часто катодную защиту применяют одновременно с нанесением защитных покрытий.
При организации катодной защиты (рис. 10.6) отрицательный полюс внешнего источника тока присоединяют к защищаемой металлической конструкции, а положительный полюс –
Рис. 10.6. Схема защиты внешним током:
А– конструкция; Б – анодное заземление
квспомогательному электроду, работающему как анод. В процессе защиты анод разрушается и его необходимо периодически менять. Источниками внешнего тока служат станции катодной защиты.
136

Протекторная защита является разновидностью катодной защиты. Защищают конструкцию присоединением протектора, другого металла или сплава, имеющих в данной среде более отрицательный потенциал, чем защищаемый металл (рис. 10.7). Протектор (анод) будет разрушаться, а изделие (катод) останется неизменным.
Для защиты стальных конструкций в морской воде или грунте используют магний и его сплавы, цинк, сплав алюминия и цинка.
Рис. 10.7. Схема протекторной защиты:
А – трубопровод; Б – протектор; В – проводник
Анодная защита. При анодной защите защищаемый металл
при растворении покрывается пассивной пленкой, например:
2Cr + 3H2O – 6ē → Cr2O3 + 6H+.
В качестве катодов используют малорастворимые материалы Pt, Ta, Pb, Ni и т.д. Этот метод применим лишь к металлам и сплавам, способным легко пассивироваться при смещении их потенциала в положительную сторону. Используется в химической промышленности.
10.7.2. Обработка окружающей среды. В промышленных условиях эксплуатации в ряде случаев уменьшение потерь от коррозии может быть достигнуто при помощи изменения состава агрессивной среды. Используют два приема:
 снижение агрессивности окружающей среды за счет удаления веществ, вызывающих коррозию металлов;
снижение агрессивности окружающей среды за счет удаления веществ, вызывающих коррозию металлов;
 ингибиторная защита, т.е. введение в агрессивную среду специальных веществ, которые вызывают значительное снижение скорости коррозионного процесса. Такие вещества называют ингибиторами коррозии.
ингибиторная защита, т.е. введение в агрессивную среду специальных веществ, которые вызывают значительное снижение скорости коррозионного процесса. Такие вещества называют ингибиторами коррозии.
137
Снижение агрессивности окружающей среды осуществляется за счет:
1)удаления кислорода при помощи деаэрации раствора, насыщения его азотом или добавления в него поглотителей кислорода (гидразин, сульфит натрия), либо пропусканием раствора через нагретую металлическую стружку;
2)устранения кислот (ионов водорода) путем нейтрализации раствора гашеной известью или едким натром;
3)удаления солей из воды, идущей на питание паровых котлов, путем обработки ее ионообменными смолами;
4)замены воздуха на инертный газ, ваккумирования или
использования поглотителей СО2.
Ингибиторная защита. Ингибиторами коррозии называют химические соединения, которые, присутствуя в коррозионной системе в достаточной концентрации, уменьшают скорость коррозии без значительного изменения концентрации любого коррозионного реагента. Другими словами – это вещества, которые пассивируют поверхность металлов и препятствуют развитию коррозионных процессов.
Действие ингибиторов обусловлено изменением состояния поверхности металла вследствие адсорбции ингибитора или образования с катионами металла труднорастворимых соединений.
Ингибиторы подразделяются:
 по механизму своего действия – на катодные, анодные и смешанные;
по механизму своего действия – на катодные, анодные и смешанные;
 по химической природе – на неорганические, органические и летучие;
по химической природе – на неорганические, органические и летучие;
 по сфере своего влияния – в кислой, щелочной и нейтральной среде.
по сфере своего влияния – в кислой, щелочной и нейтральной среде.
Неорганические катодные ингибиторы ограничивают скорость коррозии металлов путем повышения перенапряжения катодного процесса и сокращения площади катодных участков, применяются в тех случаях, когда коррозия протекает с водородной деполяризацией, используют соли AsCl3, Bi(SO4)3.
Анодные неорганические ингибиторы образуют на поверхности металла тонкие (~ 0,01 мкм) пленки, которые замедляют переход металлов в раствор, различают:
138
пленкообразующие ингибиторы, такие как NaOH, Na2CO3,
фосфаты – создают на поверхности металла фазовые или адсорбционные пленки;
пассиваторы (окислители) К2Сr2O7, Na2Cr2O7, NaNO2 – тормозят анодную реакцию растворения металла благодаря образованию на
поверхности оксидной пленки. |
|
Катодно-анодные (смешанные) ингибиторы |
КBr, KI, |
xSiO2∙Me2O – задерживают в равной степени анодный и катодный процессы за счет образования на поверхности металла хемосорбционного слоя; силикаты – нейтрализуют растворенный в воде углекислый газ и образуют защитную пленку.
Экранирующие катодные ингибиторы ZnCl2, ZnSO4,
Ca(HCO3)2 |
– образуют на микрокатодах нерастворимые соединения, |
отлагающиеся в виде изолирующего защитного слоя. |
|
Органические ингибиторы – ингибиторы смешанного |
|
действия: |
амины (применяют в кислых средах); тиолы |
(меркаптаны): тиомочевина, бензотриазол; спирты (в водных системах охлаждения, в морской и речной воде): этиленгликоль, глюконат натрия; комплексоны и их фосфоросодержащие аналоги (применяют для нейтральных сред): ЭДТА, НТФ, ОЭДФ.
Летучие ингибиторы – современное средство защиты от атмосферной коррозии металлических полуфабрикатов и готовых изделий на время транспортировки и хранения. Принцип действия заключается в образовании паров, которые диффундируют через слой воздуха к поверхности металла и защищают ее, способны защищать от коррозии длительное время (более 3 месяцев) даже после удаления их из упаковочного пространства.
10.7.3. Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется
изделие из металла. |
|
|
|
Различают: 1) |
неорганические |
защитные |
покрытия, |
2) гальванические |
покрытия, 3) |
жаростойкие |
покрытия, |
4) органические защитные пленки (лакокрасочные покрытия).
139
