
МУ по лаб.р. 2013
.pdfпроисходит с окраской метилового оранжевого? Почему? На изменение концентрации каких ионов указывает изменение окраски метилового оранжевого (прил. 4)? Напишите уравнение диссоциации кислоты при добавлении к ней ацетата натрия. Как изменяется при этом степень диссоциации СН3СООН и концентрация ионов Н+?
Опыт 3. Гидролиз солей. Определение рН раствора при помощи универсального индикатора
Приготовьте в 3 пробирках растворы солей, указанных в табл. 5.1. Для этого в каждую пробирку налейте до 1/4 объема дистиллированной воды и добавьте по 2–3 микрошпателя кристаллов солей.
|
|
|
|
|
Таблица 5.1 |
|
|
|
|
|
|
№ |
Формула |
рН раствора |
|
Окраска |
Реакция среды: |
п/п |
соли |
по универ- |
Окраска |
фенолфталеина |
кислая, |
|
|
сальной ин- |
лакмуса |
|
щелочная, |
|
|
дикаторной |
|
|
нейтральная |
|
|
бумаге |
|
|
|
1 |
NaCl |
|
|
|
|
2 |
Al2(SO4)3 |
|
|
|
|
3 |
Na2CO3 |
|
|
|
|
Поместите на индикаторную бумагу по 2 капли каждого раствора. Сравните окраску еще сырого пятна, полученного на бумаге, с цветовой шкалой. На последней указано, при каких значениях рН индикаторная бумага окрашивается в тот или иной цвет. Сделайте вывод о величине рН данного раствора и укажите реакцию среды
(прил. 6).
Испытайте реакцию среды в каждой пробирке с помощью лакмуса и фенолфталеина. Результаты опыта занесите в табл. 5.1.
Напишите ионные и молекулярные уравнения реакции гидролиза указанных солей без учета ступенчатого гидролиза.
Опыт 4. Влияние температуры на степень гидролиза
Налейте 1–2 мл дистиллированной воды и растворите в ней 2 микрошпателя ацетата натрия. Напишите ионное и молекулярное уравнения гидролиза этой соли. С помощью универсальной индикаторной бумаги определите рН среды. Добавьте в пробирку 2, 3 капли фенолфталеина, при этом жидкость остается бесцветной, так как
51
концентрация ионов гидроксида недостаточна для того, чтобы вызвать изменения окраски фенолфталеина. Осторожно нагрейте пробирку на спиртовке, не доводя содержимое до кипения. Что произошло? Объясните наблюдаемое явление. Какой вывод можно сделать? В каком направлении смещается направление гидролиза? Укажите причины влияния температуры на степень гидролиза.
На основании данного опыта сделайте вывод о том, при каком температурном режиме необходимо хранить растворы солей, подверженных гидролизу.
Контрольные вопросы
1.Что называется раствором? Перечислите виды растворов.
2.Что называется электролитом? Перечислите виды электро-
литов.
3.Что называется степенью электролитической диссоциации? От чего она зависит?
4.Как определяется константа диссоциации и от чего она зави-
сит?
5.Что называют рН среды? Как ее можно определить экспериментально?
6.Что называется гидролизом соли? От чего зависит степень гидролиза? Что необходимо делать для понижения степени гидролиза солей?
7. Кислая или щелочная среда наблюдается при растворении в воде следующих солей: Al(NO3)3, K2CO3, ZnSO4, Li2S? Ответ подтвердите соответствующими молекулярными и ионно-молекуляр- ными уравнениями.
При сливании растворов CrCl3 и Nа2СО3 образуется осадок. Объясните причину и напишите соответствующие уравнения в молекулярном и ионно-молекулярном виде.
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк.,
2000. – С. 204–250.
2.Фролов, В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С. 176–216.
52
Лабораторная работа 6
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Цель работы: экспериментально ознакомиться с принципом построения ряда активности металлов, работой гальванического элемента и процессом электролиза.
Теоретические сведения
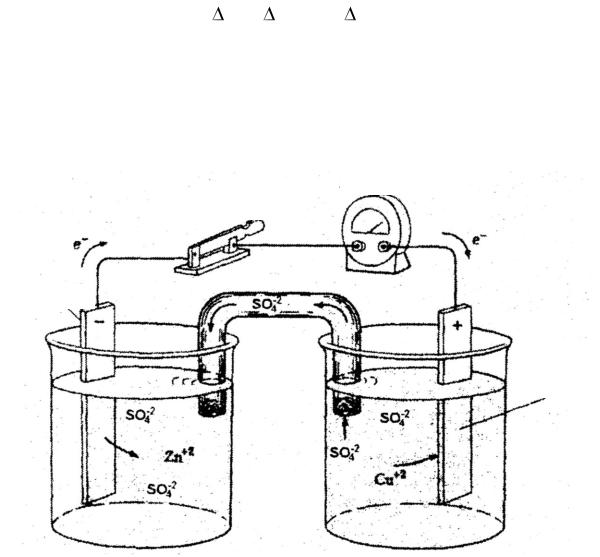
Электрохимическими называются процессы, связанные с взаимным превращением электрической и химической энергий. Преобразование энергии химической (окислительно-восстановительной) реакции в электрическую осуществляется в гальванических элементах. Если взять два металла с различными электродными потенциалами, соединить их проводом, опустить в растворы их солей, соединенных между собой электролитическим ключом, то получится гальванический элемент (рис. 6.1).
Интенсивность реакции окисления-восстановления, протекающей в гальваническом элементе, характеризуется величиной разности потенциалов – электродвижущей силой гальванического элемента
(ЭДС).
Электрод, на котором происходит процесс окисления, называется анодом, а электрод, на котором происходит процесс восстановления, называется катодом.
Электродный потенциал металла определяется процессом перехода ионов металла в раствор (окисление) и обратным процессом присоединения ионами металла электронов (восстановление), т. е. окислительно-восстановительным равновесием:
Me0 |
Men + +ne–. |
||||
ЭДС гальванического элемента вычисляют по уравнению |
|||||
Нернста: |
|
|
|
|
|
Е |
Е0 |
RT |
ln |
C1 |
, |
|
|
||||
|
|
nF |
C2 |
||
где E – ЭДС гальванического элемента; |
E0 – стандартная ЭДС; R – |
||||
универсальная газовая постоянная, равная 8,316 Дж/(моль·К); Т – температура, K; n – число электронов, переносимых в окислительновосстановительной реакции; F – постоянная (число Фарадея), равная 96 500 K; C1 и C2 – концентрации ионов соответствующих металлов в растворе. Стандартную ЭДС гальванического элемента можно
53
подсчитать, если из стандартного электродного потенциала катода вычесть стандартный электродный потенциал анода:
E0 = E0катод – E0анод
Стандартным электродным потенциалом Е0 называется потен-
циал растворения металла, погруженного в раствор собственного иона с концентрацией (или активностью), равной единице (г ион/л). Измерение Е0 производится по сравнению с нормальным водородным электродом, потенциал которого условно принят равным нулю (прил. 7).
Вольтметр
Переключатель
Zn – анод
Cu – катод
Рис. 6.1. Схема гальванического элемента Даниэля-Якоби
Располагая металлы в порядке возрастания их стандартных элек-
тродных потенциалов, получим электрохимический ряд стандартных электродных потенциалов металлов (прил. 8). В этот ряд всегда помещается водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. Положение того или иного металла в ряду напряжения и характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях.
Величина ЭДС работающего гальванического элемента всегда меньше, чем рассчитанная по формуле Нернста, вследствие поляризации электродов (изменения их потенциалов при работе гальванического
54
элемента). Наибольшее значение при работе гальванических элементов имеет катодная поляризация, возникающая за счет накопления избыточных электронов на катоде, после чего его потенциал становится более отрицательным. Разность между фактическим потенциалом катода и теоретическим электродным потенциалом называется перенапряжением на катоде. Величина перенапряжения зависит от материала катода, состояния его поверхности, температуры и плотности тока.
Точное измерение ЭДС гальванического элемента требует применения специальных приборов, обеспечивающих протекание через гальванический элемент ничтожно малого тока. Если допустить протекание значительного тока, то напряжение гальванического элемента понижается, так как он обладает внутренним сопротивлением. Кроме того, вокруг электродов происходит изменение концентрации ионов в растворе.
Экспериментально установлено, что ЭДС гальванического элемента зависит не от размера и формы твердых электродов, а от концентрации ионов. Если концентрации реагентов повышаются относительно концентраций продуктов, то это приводит к повышению степени самопроизвольности протекающей в гальваническом элементе реакции и возрастанию его ЭДС и наоборот. Во время работы гальванического элемента происходит расходование реагентов и образование продуктов. Связанное с этим уменьшение концентраций реагентов и возрастание концентраций продуктов вызывает постепенное уменьшение ЭДС элемента.
Если систему, состоящую из двух электродов и раствора или расплава электролита, включить в цепь постоянного тока, то у электродов начинают протекать реакции окисления-восстановления: у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель присоединяет электроны (из сети) и восстанавливается.
Процесс окисления-восстановления, который осуществляется под действием постоянного электрического тока, называется электролизом. Химические реакции, протекающие при электролизе, зависят от растворенного электролита, растворителя и материала электродов. Химические превращения за счет внешней электрической энергии, осуществляются в электролизерах.
Различают электролиз с инертными и активными анодами. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (платина, иридий, графит, уголь, в определенных условиях – железо, никель, золото, свинец, алюминий и др.), а активным – анод, материал которого может окисляться в ходе электролиза.
55
Какие электрохимические процессы будут протекать у электродов прежде всего зависит от соотношения электродных потенциалов соответствующих электрохимических систем (прил. 7 и 8).
На катоде восстанавливаются электрохимические системы, имеющие наибольшее значение электродного потенциала, а на аноде окисляются электрохимические системы с наименьшим электродным потенциалом.
Методика и порядок выполнения работ
Опыт 1. Качественное определение электрохимической активности металлов
Установите опытным путем относительную активность пяти металлов: меди, железа, олова, свинца и цинка. Для этого в пять пробирок налейте по 1–2 мл раствора следующих солей: сульфата цинка, сульфата железа (II), хлорида олова (II), ацетата свинца, сульфата меди. Во все растворы (за исключением раствора соли цинка) опустите на 2–3 мин по 1 грануле металлического цинка. Что происходит на поверхности цинка во всех пробирках? Напишите уравнения реакций взаимодействия цинка с растворами взятых солей в ионном виде. Какова роль цинка в этих реакциях? Какова его восстановительная активность по сравнению с железом, оловом, свинцом и медью?
Проведите аналогичные опыты со всеми остальными металлами. Наблюдайте каждый раз, в каких пробирках происходит вытеснение металла из его соли. Напишите уравнения протекающих реакций с указанием направления перехода электронов.
На основании сделанных наблюдений заполните табл. 6.1.
Таблица 6.1
Погруженный в раствор металл |
|
Ионы металлов в растворе |
|
||||
|
|
|
|
|
|
|
|
|
Zn+2 |
|
Fe+2 |
Sn+2 |
Pb+2 |
|
Cu+2 |
Zn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
|
Знаком плюс под соответствующими ионами металлов обозначайте вытеснение металлов из раствора соли при действии того или другого чистого металла, и знаком минус – тот случай, когда вытеснения не
56
происходит. Какой из исследованных металлов самый активный, а какой наименее активный? Расположите все эти металлы в ряд по убыванию их восстановительной активности. Выпишите под каждым металлом значение его стандартного электродного потенциала (прил. 8). Принимая электродный потенциал водорода равным нулю, поместите водород в полученный ряд активности. Какие из исследованных металлов могут вытеснять водород из разбавленных кислот?
Опыт 2. Изготовление гальванического элемента
иознакомление с его работой
Водин микростакан (см. рис. 6.1) налейте почти доверху 1М раствор сульфата меди и опустите в него медный электрод, в другой налейте 1М раствор сульфата цинка и опустите в него цинковый электрод. Оба полуэлемента поставьте на подставку и соедините растворы электролитным мостиком (U-образной трубкой), заполненным насыщенным раствором хлорида калия. Отклонение стрелки вольтметра,
скоторым соединены взятые электроды, указывает на возникновение электрического тока, обусловлено-различной величиной электродных
потенциалов Zn+2/ Zn0 и Cu+2/Cu0.
Выпишите стандартные электродные потенциалы меди и цинка и укажите направление движения электронов во внешней цепи . Напишите уравнения химических реакций, протекающих на электродах, и суммарное уравнение окислительно-восстановительного процесса, в результате которого в данном гальваническом элементе возникает электрический ток. По выписанным значениям стандартных электродных потенциалов цинка и меди вычислите стандартную ЭДС изготовленного гальванического элемента.
Опыт 3. Электролиз водных растворов солей с нерастворимым анодом
Электролиз иодида калия. Налейте в электролизер раствор иодида калия, к которому добавлен фенолфталеин и крахмальный клейстер. Опустите в оба колена электролизера графитовые электроды, присоединенные проводом к выпрямителю, и подключите выпрямитель к сети переменного тока.
Почему на катоде не выделяется металлический калий? Появление каких ионов в процессе электролиза обусловило окрашивание в розовый цвет раствора в катодном пространстве? Напишите уравнение
57
катодного процесса. Что произошло с иодид ионами на аноде? Чем обусловлено синее окрашивание раствора в анодном пространстве? Напишите уравнение анодного процесса.
Примечание. После окончания опыта и отключения электродов для полного удаления йода с графитового анода промойте его раствором гипосульфита, а з а- тем дистиллированной водой.
Электролиз дихлорида олова. Налейте в электролизер раствор дихлорида олова. Опустите в оба колена графитовые электроды, присоединенные к выпрямителю, и подключите выпрямитель к сети переменного тока. Через 1–2 мин наблюдайте на графитовом катоде появление блестящих кристаллов олова. Через 4–5 мин пропускания тока выньте из электролизера графитовый анод, прибавьте в раствор 3, 4 капли раствора иодида калия и крахмального клейстера и наблюдайте изменение цвета.
Напишите уравнение катодного и анодного процессов. Окисление или восстановление ионов Sn2+ происходит на катоде? Окисление или восстановление ионов Сl– осуществляется на аноде? Почему изменилась окраска раствора в анодном пространстве при добавлении иодида калия и крахмала?
Опыт 4. Электролиз водного раствора сульфата меди с нерастворимым и растворимым анодом
Налейте в электролизер 1М раствор сульфата меди, опустите в него графитовые электроды, присоединенные к выпрямителю, и подключите выпрямитель к сети переменного тока. Какое вещество выделилось на катоде? Выделяется ли газ? Напишите уравнения катодного и анодного процессов на графитовых электродах. Отключите выпрямитель от сети.
Выньте электроды и поменяйте их местами, вследствие чего анодом окажется электрод, покрытый медью. Вновь опустите электроды в электролизер и подключите выпрямитель к сети переменного тока. Наблюдайте на аноде постепенное растворение меди и отсутствие выделения газа. Напишите уравнение анодного процесса, протекающего при электролизе с графитовым электродом, покрытым медью.
Контрольные вопросы
1. Никелевые пластины опущены в растворы MgSO4, NaCl, CuSO4, CuCl2, ZnCl2, Pb(NO3)2. С какими солями никель будет реагировать? Напишите уравнения реакций в молекулярной и ионной формах.
58

2. В каком направлении будут перемещаться электроны по проволоке, соединяющей полюсы элементов:
Mg Mg(NO3)2 |
Pb(NO3)2 Pb |
Pb Pb(NO3)2 |
Cu(NO3)2 Cu |
Cu Cu(NO3)2 |
AgNO3 Ag |
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите уравнения процессов, протекающих на никелевых электродах в первом и во втором случаях.
Напишите уравнения реакций катодного и анодного процессов, протекающих при электролизе перечисленных ниже водных растворов с графитовыми электродами: а) хлорида меди (II); б) гидроксида калия.
Библиографический список
1.Коровин Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк.,
2000. – С. 251–309.
2.Фролов В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С. 268–301.
59

Лабораторная работа 7
КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
Цель работы: экспериментально ознакомиться с основными видами коррозионных процессов и способами защиты металлов от коррозии.
Теоретические сведения
Самопроизвольно протекающий процесс разрушения металлов вследствие химического или электрохимического взаимодействия его с внешней средой называется коррозией. Широко известны такие коррозионные явления, как ржавление железа на воздухе, образование окалины на железе при высокой температуре, разъедание металлов кислотами.
Коррозия – это разрушение металла в результате его физико-
химического взаимодействия с окружающей средой.
При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
Различают два вида коррозии: химическую и электрохимическую.
Химическая коррозия происходит в среде неэлектролита, например в агрессивных органических жидкостях, таких как нефть, бензин, керосин или в газах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером могут служить реакции:
2Fe + 3Cl2 (t) |
2FeCl3 |
4Fe + 3O2 (t) |
2Fe2O3 |
Электрохимическая коррозия металлов происходит в результате действия микрогальванических элементов на их поверхности в среде электролита.
Электрохимическая коррозия возникает при наличии разности потенциалов в электропроводящей среде, т. е. в среде электролита, например при соприкосновении металлов с водой, растворами электролитов, атмосферным воздухом и другими влажными газами. В этих случаях процесс коррозии сопровождается перемещением электронов с одних участков металла к другим, т. е. появлением электрического тока. При этом на одних участках поверхности металла протекают катодные, а на других – анодные процессы. В качестве
60
