
МУ по лаб.р. 2013
.pdf
Отмерьте цилиндром 25 мл 1М раствора кислоты и вылейте во внутренний стакан калориметра. В другой цилиндр налейте 25 мл 1М раствора основания.
Измерьте температуру раствора кислоты с точностью до 0,1 °С. Температура основания такая же, так как оно хранится в одних условиях с кислотой. Не вынимая из раствора кислоты термометр, вылейте раствор основания в кислоту. Осторожно перемешайте раствор, наблюдая за изменением температуры раствора. Определите наибольшую его температуру как tKОH. Данные эксперимента запишите в табл. 3.1.
Таблица 3.1
№ |
Исходные вещества |
Объем V, мл |
Температура t, |
С |
||||
зада- |
|
|
|
|
|
|
|
|
кислота |
основание |
кислота |
основание |
tнач |
tкон |
|
t |
|
ния |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
HCl |
KOH |
25 |
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
HNO3 |
KOH |
25 |
25 |
|
|
|
|
3 |
CH3COOOH |
KOH |
25 |
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
CH3COOOH |
NH4OH |
25 |
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Теплота, выделенная при реакции нейтрализации, расходуется на нагревание раствора, а теплотой, расходуемой на нагревание калориметра, можно пренебречь.
Вычислите теплоту нейтрализации 25 мл 1М раствора кислоты 25 мл 1М раствором основания по формуле
Q = Cp mр-ра t,
где Ср – удельная теплоемкость раствора при постоянном давлении; mр-ра – общая масса раствора в калориметре; t – изменение температуры в калориметре.
Удельную теплоемкость раствора при постоянном давлении Cp принимают равной теплоемкости воды, т. е. 4,184 Дж / (г·град).
Общая масса раствора, равная сумме масс кислоты и основания,
определяется как произведение плотности раствора 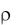 на его общий объем:
на его общий объем:
Vр-ра = Vкисл + Vоснов, т. е. mр-ра = Vр-ра.
Плотность раствора принимается равной 1 г/см3.
31

Изменение температуры в калориметре из-за теплового эффекта реакции нейтрализации определяется простым вычитанием с учетом полученного знака:
t = tконеч – tнач.
Учитывая, что энтальпия реакции нейтрализации H относится к молю вещества и выражается в килоджоулях на моль (кДж/моль), вычислите ее по формуле
H = –Q/ , |
(3.1) |
где – число молей реагентов. В нашем случае |
= 0,025, так как |
в 25 мл 1М раствора кислоты задержится 0,025 моля кислоты.
Зная, что теоретическое значение энтальпии реакции нейтрализации сильной одноосновной кислоты сильным основанием в разбав-
ленном растворе Hтеорет = –57,27 кДж/моль, рассчитайте погрешность эксперимента для заданий 1 и 2 по следующей формуле:
|
Нтеорет |
|
Нпракт |
100 %. |
||
|
|
|
|
|
|
|
|
|
Нтеорет |
|
|||
|
|
|
||||
|
|
|
|
|||
Объясните, почему энтальпия реакций нейтрализации сильной кислоты сильным основанием есть величина постоянная (задания 1 и 2 в табл. 3.1), а энтальпии реакций нейтрализации в заданиях 3 и 4 не постоянны и отличаются от энтальпии в заданиях 1 и 2.
Опыт 2. Определение теплового эффекта растворения безводной соли
Во внутренний стакан калориметра налейте 25 мл дистиллированной воды и измерьте ее температуру с точностью до 0,1 °С. Температуру соли примите равной температуре воды. Высыпьте в воду навеску заданной соли, осторожно перемешивая содержимое стакана до полного растворения соли. Отметьте максимальную температуру раствора с точностью до 0,1 °С. Данные эксперимента запишите в табл. 3.2.
Таблица 3.2
№ |
Формула |
Масса соли m, |
Объем воды V, |
Температура t, |
С |
|
задания |
и название |
г |
мл |
|
|
|
tнач |
tкон |
t |
||||
|
соли |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
32

Растворение безводной соли можно рассматривать как совокупность одновременно протекающих процессов разрушения кристаллической решетки соли и гидратации образовавшихся ионов (прил. 4). Поэтому энтальпия реакции растворения Hраств равна алгебраической сумме изменения энтальпии при разрушении кристаллической решетки Hкр.р и изменения энтальпии при гидратации образовавшихся ионов Hгидр:
Hраств = Hкр.р + Hгидр.
Зная общую массу раствора mобщ, равную сумме массы соли mсоли и массы воды mводы, приняв удельную теплоемкость раствора Ср равной теплоемкости воды, т. е. 4,184 Дж/(г·град), а его плотность равной единице, определите количества теплоты Qраств, выделяющейся при растворении безводной соли в пересчете на 1 моль безводной соли по формулам (3.1) и (3.2).
Опыт 3. Практическое задание. Определение энергии Гиббса
Выполняется по заданию преподавателя по приведенным ниже условиям и данным табл. 3.3 (прил. 5).
По уравнению G = H – T S рассчитайте энергию Гиббса при T = 298 К и при температуре Т, заданной в табл. 3.3.
Сделайте обоснованные выводы о возможности протекания реакции при этих температурах. Определите количество теплоты, поглощенной или выделенной при протекании реакции, в пересчете на заданное количество вещества (прил. 7).
Контрольные вопросы
1.Дайте определение энтальпии химической реакции.
2.Дайте формулировку закона Гесса и приведите пример его применения для химических реакций, протекающих через промежу-
точные стадии.
З. Что называется энтальпией образования и энтальпией разложения вещества?
4.Как можно рассчитать энтальпию химической реакции, если известны энтальпии образования исходных веществ и продуктов реакции?
5.Вычислите энтальпию реакции полного сгорания ацетилена C2H2 (стандартные энтальпии образования см. в прил. 5).
6.Используя данные прил. 6, сравните энтальпии растворения безводных и гидратированных солей и сделайте вывод.
33
Таблица 3.3
№ |
Реакция |
Т, К |
Количество вещества |
|||
п/п |
|
|
|
Масса |
|
Объем |
1 |
Fe3O4(т) +H2(г) = 3FeO(т) +H2O(г) |
900 |
10 кг FeO |
|
|
|
2 |
H2(г) +CO2 = H2O(г) + CO(г) |
2000 |
|
|
10 л CO2 |
|
3 |
CO(г) + FeO(т) = CO2(г) +Fe(т) |
500 |
|
|
2 |
л CO2 |
4 |
CH4(г) + CO2(г) = 2CO(г) + 2H2(г) |
1600 |
|
|
4 |
л CO |
5 |
PbO(т) + H2(г) = Pb(т) +H2O(г) |
450 |
1 |
кг PbO |
|
|
6 |
2CuCl(т) + H2(г) = 2Cu(т) + 2HCl(г) |
550 |
|
|
2 |
л H2 |
7 |
CaCO3(т) = CaO(т) + CO2(г) |
500 |
|
|
7 |
л CO2 |
8 |
MgCO3(т) = MgO(т) + CO2(г) |
500 |
|
|
100 л CO2 |
|
9 |
2PbSO4(т) = 2PbO(т) + 2SO2(г) + O2(г) |
450 |
20 кг SO2 |
|
|
|
10 |
Ca(OH)2(т) = CaO(т) + H2O(г) |
570 |
5 |
кг CaO |
|
|
11 |
3Fe2O3(т) = 2Fe3O4(т)+ 1/2O2(г) |
900 |
7 |
кг Fe2O3 |
|
|
12 |
FeO(т) + H2(г) = Fe(т) + H2O(г) |
660 |
|
|
10 л H2 |
|
13 |
Fe3O4(т) + 4H2(г) = 3Fe(т) + 4H2O(г) |
700 |
|
|
2 |
л H2 |
14 |
C(графит) + 2H2 O(г) = CO2(г) + 2H2(г) |
1200 |
1 |
кг C |
|
|
15 |
Al2 O3(т) + C(графит) = 2Al(т) +3CO(г) |
900 |
5 |
моль Al2O3 |
|
|
16 |
Fe3O4(т) + 4CO(г) = 3Fe(т) + 4CO3(г) |
1000 |
1 |
кг Fe |
|
|
17 |
Mg(т) + CO2(г) = MgO(т) + CO(г) |
800 |
1 |
кг Mg |
|
|
18 |
TiCl4(ж) + 2Mg(т) = Ti(т) + 2MgCl2(г) |
700 |
10 кг Ti |
|
|
|
19 |
Al2 O3(т) + 3C(графит) = 2Al(т) + 3CO(г) |
800 |
|
|
3 |
л CO |
20 |
H2S(г) + 3/2O2(г) = H2O(г) + SO2(г) |
500 |
|
|
1 |
л H2S |
21 |
H2(г) + 1/2O2(г) = H2O(г) |
300 |
|
|
1 |
л O2 |
22 |
2CO2(г) + H2O(г) = C2H2(г) + 1/2O2(г) |
500 |
|
|
2 |
л C2H2 |
23 |
H2O2(г) = H2O(г) + 1/2O2(г) |
1000 |
|
|
2 |
л H2O |
24 |
C(алмаз) С(графит) |
3000 |
1кг C(графит) |
|
|
|
25 |
CaO(т) + CO2(г) + CaCo3(т) |
300 |
|
|
2 |
л CO2 |
26 |
2NaHCO3(т) = Na2CO3(т) + CO2(г) + |
600 |
5 |
кг Na2CO3 |
|
|
|
H2O(г) |
|
|
|
|
|
27 |
C2H4(г) + H2(г) = С2 H6 |
400 |
|
|
1 |
л C2H4 |
28 |
KСlO3(т) = KCl(т) + 3/2O2(г) |
800 |
|
|
2 |
л O2 |
29 |
2Al(т) + 3Cl2(г) = 2AlCl3(т) |
700 |
1 |
кг Al |
|
|
30 |
Fe2O3(т) + 3CO(г) = 3CO2(г) + 2Fe(т) |
1000 |
6 |
кг Fe |
|
|
Условные обозначения: г – газ; ж – жидкость; т – твердое (кристаллическое) вещество. Данные для расчета приведены в прил. 5.
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк.,
2000. – С. 116–143.
2.Фролов, В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С. 141–144
34
Лабораторная работа 4
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы: научиться определять скорость реакции; ознакомиться с различными факторами, влияющими на скорость реакции, химическим равновесием
Теоретические сведения
Раздел химии, изучающий скорость химических процессов и влияние на нее различных факторов, а также механизм реакций, называет-
ся химической кинетикой.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
Средняя скорость реакции вычисляется по формуле
V = |
С2 |
С1 |
или V = |
С |
, |
|
|||||
ср |
|
|
ср |
|
|
|
2 |
1 |
|
|
|
где C1 – начальная концентрация вещества; С2 – конечная концентрация вещества; 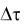 – промежуток времени, за который концентрация изменилась от C1 до С2
– промежуток времени, за который концентрация изменилась от C1 до С2
Истинная скорость реакции в данный момент определяется как производная от концентрации по времени:
dC
Vист = d .
Рассматривая кинетику химических реакций, следует иметь в виду, что характер взаимодействия зависит от агрегатного состояния продуктов и реагентов.
Продукты и реагенты, вместе взятые, образуют физико-хими- ческую систему. Совокупность однородных частей системы, обладающих одинаковым химическим составом и физическими свойствами, и отделенных от остальных частей системы поверхностью раздела, называется фазой. Системы, состоящие из одной фазы, называются гомогенными, а системы, содержащие несколько фаз, – гетероген-
ными.
На скорость реакции влияют природа веществ, их концентрация, температура, присутствие катализатора.
35

Зависимость скорости гомогенной реакции от концентрации реагирующих веществ выражена в законе действия масс.
Скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Так, для реакции аА + bВ сС + dD закон действия масс записывается в следующем виде:
V = k [A]a[B]b,
где [А] и [В] – концентрация веществ А и В; а и b – их стехиометрические коэффициенты; k – коэффициент пропорциональности, называемый константой скорости. Сумма показателей степени в этом выражении называется порядком реакции N = а + b.
При повышении температуры скорость реакции увеличивается. В количественном отношении влияние температуры на скорость гомогенных химических реакций может быть выражено приближенно
правилом Вант-Гоффа.
Повышение температуры на 10 ºС увеличивает скорость гомогенных химических реакции в 2–4 раза.
Наиболее общая зависимость скорости реакции от температуры выражается уравнением Аррениуса:
|
|
|
Еакт |
|
Еакт |
|
|
k = k |
0 |
е RT |
, или ln k = В |
, |
|||
|
|||||||
|
|
|
|
RT |
|||
|
|
|
|
|
|||
где Eакт – энергия активации, т. е. энергия, которой должны обладать молекулы в момент столкновения, чтобы быть способными к данному химическому взаимодействию.
Для гетерогенных процессов скорость реакции зависит от величины поверхности раздела между фазами, на которой происходит сама реакция, и пропорциональна площади поверхности соприкосновения реагирующих веществ.
Под химическим равновесием понимают состояние, когда скорости прямой и обратной реакции равны между собой. Для обратимой реакции аА + bВ сС + dD скорость прямой реакции Vпр = k1
[A]a[B]b равна скорости обратной реакции Vобр = k2 [C]c[D]d, т. е. Vпр = Vобр. Откуда k1 [A]a[B]b = k2 [C]c[D]d, а отношение констант прямой (k1) и обратной (k2) реакций называется константой равновесия K:
36

|
k1 |
|
|
С |
|
|
с |
|
D |
|
|
d |
|||||
|
|
|
|
|
|
||||||||||||
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
||
k2 |
|
|
A |
|
a |
|
|
|
B |
|
b |
||||||
|
|
|
|
|
|
||||||||||||
Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от их концентрации
Переход системы из одного равновесного состояния в другое называется смещением химического равновесия. Оно подчиняется
принципу Ле Шателъе.
Если изменить одно из условий, при которых система находится в состоянии химического равновесия (концентрацию, температуру, давление), то в системе протекают процессы, ослабляющие произведенное изменение.
Методика и порядок выполнения работы
Опыт 1. Влияние концентрации на скорость реакции
Зависимость скорости реакции от концентрации исследуется на примере реакции между тиосульфатом натрия Na2S2O3 и серной кислотой H2SO4:
Na2S2O3 + H2SO4 Na2SO4 + H2S2O3
Образовавшаяся серноватистая кислота неустойчива и распадается по схеме
H2S+22O3 H2S + 4O3 + S
Сера в начале реакции появляется в мелкодисперсном состоянии, ее можно обнаружить по появлению голубоватой опалесценции – явления рассеивания света на мелкодисперсных частицах.
Предварительно проделайте качественный опыт. Для этого внесите в пробирку 5–10 капель 1н раствора тиосульфата натрия и 3–5 капель 2н раствора серной кислоты. Постарайтесь заметить появившуюся через некоторое время очень слабую опалесценцию, которая затем усиливается, переходя в явную муть.
Для проведения опыта заготовьте в пяти пробирках равные объемы тиосульфата натрия различной концентрации, добавив в четыре пробирки воду, как указано в табл. 4.1.
37

Таблица 4.1
№ |
|
Количество |
|
Концен |
ln C, |
Время |
Скорость |
ln V, |
Поря- |
||
про- |
капель раствора |
|
трация |
усл. |
течения |
реакции |
c–1 |
док |
|||
бир- |
Na2S2O3 |
Во- |
H2SO4 |
|
Об- |
С, |
ед |
реакции |
V = C/ , |
|
реак- |
ки |
|
ды |
|
|
щее |
|
|
, c |
с–1 |
|
ции |
|
|
|
|
|
|
усл. ед |
|
|
|
|
|
1 |
2 |
3 |
4 |
|
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
3 |
12 |
1 |
|
16 |
1 |
0 |
|
|
|
|
2 |
6 |
9 |
1 |
|
16 |
2 |
0,69 |
|
|
|
|
3 |
9 |
6 |
1 |
|
16 |
3 |
1,10 |
|
|
|
|
4 |
12 |
3 |
1 |
|
16 |
4 |
1,39 |
|
|
|
|
5 |
15 |
0 |
1 |
|
16 |
51 |
1,61 |
|
|
|
|
Впробирку 1 добавьте 1 каплю 2н раствора серной кислоты
ивстряхните ее. В момент прибавления кислоты пустите секундомер, по которому определите время от начала реакции до появления слабой опалесценции. Аналогично повторите опыт с заготовленными растворами тиосульфата натрия.
Данные опыта занесите в табл. 4.1. Приняв концентрацию тиосульфата в первой пробирке за единицу, постройте график, откладывая на оси абсцисс концентрации, а на оси ординат – относительную скорость реакции, т. е. величины, обратные времени.
Каким должен быть график при идеальном выполнении закона действия масс? Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Как согласуются ваши наблюдения с законом действия масс?
Практическое задание. Определение порядка реакции
по одному из компонентов
Полученные экспериментальные данные позволяют определить порядок реакции по одному из компонентов – Na2S2O3, поскольку в опыте изменяли концентрацию только одного из компонентов.
Записанное ранее для реакции аА + bВ сС + dD – выражение закона действующих масс:
V = k[A]a[B]b
содержит произведение концентрации исходных веществ в степенях а и b. Величины а и b определяют порядок реакции по реагенту А и В соответственно, а их сумма показывает на общий порядок реакции N. Обычно пишут, что а и b равны стехиометрическим коэффициентам, стоящим перед этими компонентами в уравнении реакции. Однако
38
это верно только для тех случаев, когда уравнение химической реакции строго описывает механизм протекания реакции. В этом случае порядок реакции является целым числом и совпадает по величине с молекулярностъю реакции – числом молекул, участвующи х в одном химическом акте взаимодействия. В подавляющем большинстве случаев суммарная реакция, аналогичная реакции
Na2S+22O3 + H2S+6O4 Na2S+6O4 + S0 + H2S+4O3 |
(4.1) |
не соответствует механизму протекания реакции, и поэтому порядок реакции по стехиометрическим коэффициентам такой суммарной реакции определить нельзя, и он, как правило, не является целым чи с- лом.
В нашем опыте изменяли концентрацию только одного компонента – тиосульфата натрия, поэтому в выражении для скорости этой реакции
V = k [Na2S2O3]a[H2SO4]b
Концентрацию серной кислоты можно считать постоянной и ввести в константу скорости реакции. Окончательно имеем:
V = k1 [Na2S2O3]a
где а – порядок реакции по тиосульфату натрия. В этой формуле k1 – новое значение константы скорости реакции:
k1 = k [H2SO4]b
В общем виде это выражение можно записать как
V = k Ca
Это степенное выражение после логарифмирования имеет вид
Ln V = ln k + a·ln C.
Графически в логарифмических координатах ln V = f(ln С) оно может быть представлено прямой (рис. 4.1) (сравните с известным из аналитической геометрии уравнением прямой у = m + nх, где у = ln V; m = ln k; n = а; х = ln С). Значит, на графике экспериментальные данные должны лежать на прямой, угловой коэффициент которой будет равен порядку реакции а.
Отклонения экспериментальных данных от линейной зависимости (рис. 4.1) связаны с неизбежными погрешностями при приготовлении растворов и определении времени протекания реакции.
39
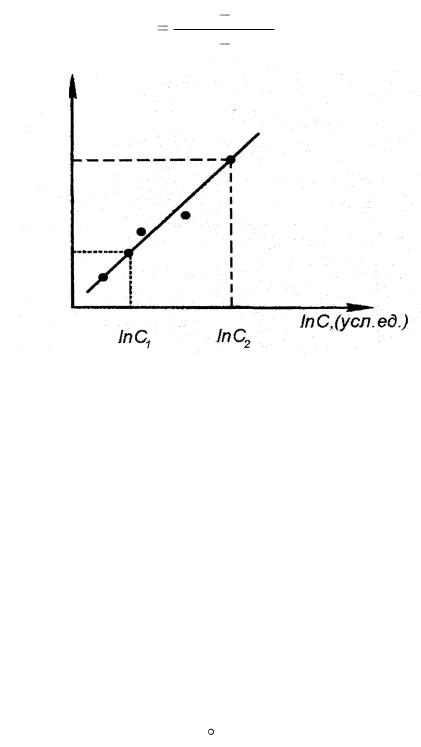
Вычисление углового коэффициента выполняется по двум произвольным точкам на прямой и соответствующим им значениям ln V и ln C по схеме:
ln V2 = ln k + a ln C2; ln V1 = ln k + a ln C1
аlnV2 lnV1 .
ln C2 ln C1
ln V, (c–1)
lnV2
lnV1
lnC1 |
lnC2 |
lnC, (усл. ед.) |
|
|
|
Рис. 4.1. Зависимость скорости гомогенной реакции от концентрации в логарифмических координатах
Определите порядок реакции, а по тиосульфату натрия и его значению сделайте вывод: описывают ли уравнении реакции (4.1) механизм протекания процесса?
Опыт 2. Влияние температуры на скорость химической реакции
Опыт проводится с постоянной концентрацией тиосульфат натрия Na2S2O3 при пяти различных значениях температуры.
При комнатной температуре в пробирку внесите 10 капель 1н раствора тиосульфата натрия, добавьте в нее 1 каплю 2н раствора серной кислоты. По секундомеру определите время от начала реакции до появления слабой опалесценции. Затем проделайте опыт при температуре на 10 °С выше комнатной. Для этого залейте в термостат воду нужной температуры (tкомн + 10 С). В одну из пробирок термостата внесите 7, 8 капель 2н раствора серной кислоты, а в другую – 10
40
