
МУ по лаб.р. 2013
.pdfЛабораторная работа 2
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: изучить различные окислительно-восстанови- тельные реакции, сильные окислители и восстановители, влияние среды на протекание окислительно-восстановительных реакций, проявление окислительно-восстановительных свойств элементов в зависимости от степени их окисления.
Теоретические сведения
Все химические реакции можно разделить на два типа: обменные и окислительно-восстановительные.
Обменными реакциями называются реакции, протекание которых не сопровождается изменением степеней окисления элементов, входящих в состав реагирующих веществ. Примером такой реакции является реакция нейтрализации.
Окислительно-восстановительными реакциями (ОВР) называют-
ся реакции, протекающие с изменением степени окисления некоторых элементов, входящих в состав реагирующих веществ.
Степень окисления характеризует состояние элемента в веществе, насыщенность его электронами. Формально степень окисления может быть положительной, нулевой и отрицательной. Она проставляется справа от элемента, вверху.
Положительная степень окисления равна числу электронов, смещенных от данного атома (например: Н+1Сl, С+4О2, Н3Р+5О4).
Отрицательная степень окисления равна числу электронов, сме-
щенных в сторону данного атома от атомов связанных с ним элемен-
тов (например, НСl1–, H2S–2, N–3H3).
При определении степени окисления по формуле необходимо помнить следующее:
– степень окисления кислорода в соединениях равна –2. Исключения составляют OF2, где степень окисления кислорода равна +2;
21
Н+12О–12, где степень окисления кислорода –1; O+12F–2, где степень окисления кислорода +1;
–степень окисления водорода в соединениях равна +1. Исключение составляют гидриды, где степень окисления –1 (например, Na+H–);
–степень окисления простых веществ всегда равна 0;
–алгебраическая сумма всех степеней окисления элементов, входящих в электронейтральное соединение, равна 0. Например:
H2+1 S+6 O4–2 , где 2(+1) + (+6) + 4(–2) = 0;
– подавляющее число элементов проявляет в соединениях переменную степень окисления (например, H2S–2, S+2O, S+4O2, S+6O3).
В любой окислительно-восстановительной реакции должен быть окислитель и восстановитель.
Окислитель – это элемент, принимающий электроны. Процесс присоединения электронов называется восстановлением, т. е. окислитель в ходе реакции восстанавливается, степень его окисления понижается, например:
S0 + 2e– |
S–2, |
Fe+3 +1e– |
Fe+2, |
Mn+7 +5e– |
Mn+2, |
Cr+6 + 3e– |
Cr+3. |
Сильными окислителями являются фтор и другие галогены в свободном состоянии, кислород, сера, а также вещества, содержащие элементы в высшей степени окисления: Sn+4О2, KMn+7O4, К2Сг2+6О7.
Восстановитель – это элемент, отдающий электроны. Процесс отдачи электронов называется окислением, т. е. восстановитель в ходе реакции окисляется, степень его окисления повышается, например:
|
Ca0 – 2e– |
Ca+2, |
|
|
|
S–2 – 8e– |
S+6, |
|
|
|
Sn+2 –2e– |
Sn+4 |
|
|
Сильными |
восстановителями |
являются |
водород, |
все металлы |
в свободном состоянии, а также вещества, |
содержащие элементы |
|||
с отрицательной степенью окисления: Cl–, Br–, S–2. |
|
|||
Элементы |
в промежуточной степени окисления |
могут быть |
||
окислителями и восстановителями в зависимости от реагентов и сре-
ды. Например: Cl2 + H2O–2 |
O2 + 2HCl – пероксид водорода – вос- |
становитель; MnO + H2O–2 |
MnO2 + H2O – пероксид водорода – |
окислитель. В пероксиде водорода кислород имеет промежуточную
22
степень окисления (–1), поэтому H2O2 в одних реакциях может проявлять восстановительные свойства, в других – окислительные.
Следует помнить, что рассмотрение реакции окислениявосстановления как процесса отдачи и присоединения электронов не всегда отражает истинное положение вещей, так как в большинстве случаев происходит не перенос электронов, а только смещение электронного облака связи от одного атома или иона к другому. Поэтому правильнее говорить об изменении электронной плотности у восстановителя и окислителя и характера поляризации атомов.
Различают три типа окислительно-восстановительных реакций. Межмолекулярные реакции протекают с изменением степени
окисления атомов в различных молекулах, т. е. окислитель и восстановитель находятся в разных веществах, например:
2KN+5O3 + C0 = 2KN+3O2 +С+4O2
Внутримолекулярные реакции осуществляются с изменением степени окисления разных атомов в одной и той же молекуле. При этом атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления, например:
2Cu(N+5O3–2)2 (t) 2CuO +O20 +4N+4O2
Реакции самоокисления-самовосстановления, или диспропорцио-
нирования (дисмутации), происходит одновременно с увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
4Na2S+4O3 (t) 3Na2S+6O4 + Na2S–2
Существует два метода составления окислительно-восста- новительных реакций: метод электронного баланса и электрон- но-ионный метод. Оба метода основаны на законе сохранения заряда. Мы будем использовать метод электронного баланса для составления окислительно-восстановительных реакций.
Порядок выполнения работы следующий:
1.Записать уравнение реакции с указанием исходных и образующихся веществ.
2.Определить степень окисления элементов в веществах правой
илевой частей уравнения реакции, отметить элементы, степень окисления которых изменилась.
23

3. Составить уравнения процессов окисления и восстановления, найти наименьшее общее кратное для числа электронов, отданных при окислении и принятых при восстановлении.
4.Расставить, исходя из электронного баланса, коэффициенты при окислителе и восстановителе в уравнении реакции.
5.Расставить в соответствии с материальным балансом осталь-
ные коэффициенты в уравнении реакции.
6. Сделать проверку, сравнив сумму каких-либо атомов (удобнее это сделать для кислорода или водорода, если они имеются) в левой и правой части окислительно-восстановительной реакции.
Приведем пример использования метода электронного баланса при составлении уравнения окислительно-восстановительной реак-
ции:
16H+1Cl–1 + 2K+1 Mn+7O4–2 =5Cl20 + 2K+1 Cl–1 + 8H2+1 O–2 + 2Mn+2Cl2–1
5 |
2Cl–1 – 2e– |
Cl20 |
восстановитель, окисление |
|
|
10 |
|
2 |
Mn+7 + 5e– |
Mn+2 |
окислитель, восстановление |
Суммарное уравнение: 10Cl– + 2Mn+7 |
5Cl02 + 2Mn+2 |
||
Методика и порядок выполнения работы
Опыт 1. Взаимодействие сероводорода с йодной водой
В пробирку с 5, 6 каплями сероводородной воды прибавьте такое же количество йодной воды. Отметьте обесцвечивание йода и появление осадка серы. Напишите уравнение реакции и укажите переход электронов, которым она сопровождается. Какой элементарный ион в данной реакции является восстановителем?
Опыт 2. Взаимодействие хлорида олова с цинком
В пробирку с 5, 6 каплями раствора хлорида олова SnCl внесите гранулу цинка. Через некоторое время наблюдайте на поверхности гранулы цинка появление блестящих кристаллов олова.
Напишите уравнение реакции взаимодействия хлорида олова с цинком. Какой ион является окислителем?
Опыт 3. Влияние степени окисления соединений серы на ее окислительно-восстановительные свойства
24
В 3 пробирки внесите по 3 капли раствора перманганата калия КMnO4 и 1 каплю раствора серной кислоты H2SO4 (для создания кислой среды). В первую пробирку прилейте 3 капли свежеприготовленной сероводородной воды H2S, во вторую добавьте, несколько кристаллов сульфита натрия Na2SO3, а в третью – 3 капли концентрированной серной кислоты. Отметьте, в каких пробирках произошло обесцвечивание раствора КMnО4. Напишите уравнения реакций, учитывая что марганец в степени окисления +7 (Mn+7) переходит в кислой среде в марганец со степенью окисления +2 (Мn+2). Почему не обесцвечивается раствор в одной из пробирок?
Опыт 4. Влияние среды на процесс восстановления перманганата калия сульфитом натрия
В 3 пробирки внесите по 3, 4 капли раствора перманганата калия КMnО4. В первую пробирку добавьте 2 капли раствора серной кислоты, во вторую – такое же количество раствора гидроксида калия КОН, в третью – столько же воды. Во все три пробирки внесите по два микрошпателя кристаллического сульфита натрия и перемешайте растворы до полного растворения кристаллов. Через 3–4 мин отметьте изменение окраски раствора во всех трех случаях. Напишите уравнения реакций, учитывая, что окраска соединений марганца зависит от его степени окисления:
ион [Mn+7O4]–1 – фиолетовая; ион [Mn+6 O4]–2 – зеленая;
ион Mn+2 – слабо-розовая, практически бесцветная; ион Mn+4O2 – бурая.
Опыт 5. Окислительно-восстановительные свойства пероксида водорода
5.1. Взаимодействие пероксида водорода с сульфидом свинца
Внесите в пробирку 2 капли раствора ацетата свинца (II). Добавьте 2 капли сероводородной воды и наблюдайте выделение черного осадка сульфида свинца PbS. В эту же пробирку прибавьте 3–5 капель 3%-го раствора пероксида водорода. Что происходит с осадком? Напишите уравнения реакций, учитывая, что сульфид свинца окисляется до сульфата свинца. Какое вещество в данной реакции явилось окислителем и какое – восстановителем?
5.2. Взаимодействие пероксида водорода с диоксидом свинца
25
Внесите в пробирку по 3 капли 3%-го раствора пероксида водорода и 2н раствора азотной кислоты. Добавьте несколько кристаллов диоксида свинца. Наблюдайте бурную реакцию растворения диоксида свинца РbО2, которая сопровождается выделением кислорода.
Образование свинца в степени окисления +2 можно легко обнаружить с помощью качественной реакции на ион свинца Рb+2. Для этого к полученному раствору следует прибавить 1 каплю раствора йодида калия. Происходит выпадение осадка иодида свинца РbI2, окрашенного в желтый цвет.
Напишите уравнение реакций, учитывая, что ион свинца Рb+4 восстанавливается до иона свинца Рb+2. Окислителем или восстановителем является здесь пероксид? Сделайте заключение об окислитель- но-восстановительных свойствах пероксида водорода.
Контрольные вопросы
1.Какие реакции называются окислительно-восстановительными?
2.Назовите сильные окислители и сильные восстановители.
3.Как составить окислительно-восстановительную реакцию методом электронного баланса?
4.Назовите типы окислительно-восстановительных реакций. Перечислите и дайте определения, приведите примеры.
5.Какой элемент в периодической системе Д. И. Менделеева является самым сильным восстановителем, а какой – самым сильным окислителем?
6.Что называют степенью окисления?
7.В каком из соединений кислород проявляет положительную степень окисления: H2O; Н2О2; СО2; OF2?
8.Какое из веществ является только восстановителем: Fe; SO3;
Cl2; НNО3?
9. Какой элемент в III периоде Периодической системы Д. И. Менделеева, будучи в свободном состоянии, является самым сильным окислителем: Na; Al; S; Сl2?
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш.шк.,
2000. – С. 251–259.
2.Глинка, Н. Л. Общая химия / Н. Л. Глинка. – Л. : Химия, 1984. –
С. 264.
26

3. Фролов, В. В. Химия / В. В. Фролов. –М. : Высш.шк., 1979. –
С. 254–267.
Лабораторная работа 3
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: ознакомиться с экспериментальным определением тепловых эффектов химических реакций.
Теоретические сведения
При химических реакциях происходит не только изменение химического состава вещества, но и изменение полной энергии системы за счет повышения или понижения химической составляющей этой энергии. Полная энергия системы складывается из кинетической энергии поступательного, колебательного и вращательного движений всех элементарных составных частей вещества, а также потенциальной энергии их взаимодействия. Химической энергией является та часть полной энергии вещества, которая вносится в систему кинетической и потенциальной энергиями ионов и более крупных составляющих вещества: атомов, молекул, различного рода надмолекулярных образований и т. д. При постоянном объеме системы, когда V – const, а V = 0 (изохорные условия, реализуемые, например, в автоклавах) полная энергия системы называется внутренней энергией и обозначается символом U. При постоянном давлении Р = const (наиболее часто реализуемые условия, называемые изобарными), кроме внутренней энергии U, необходимо учитывать также работу расширения Арасш = Р V, которая совершается при изменении температуры за счет термического расширения вещества. В этом случае полный запас энергии системы, складывающийся из внутренней энергии U и работы расширения Арасш, называется энтальпией и обозначается символом Н:
H = U + Арасш = U + Р V,
Энтальпию Н можно рассматривать как меру полной энергии системы, способной изменять свой объем.
27

Величина полной энергии вещества огромна, но ее абсолютное значение неизвестно. Поэтому в термодинамических расчетах используют не абсолютные значения U и Н, а их изменения U и H, связанные с химическими превращениями вещества. Эти изменения рассчитываются как разница между величинами U и Н для конечных и начальных состояний системы, т. е. для продуктов реакции и исходных веществ:
U = Uкон – Uнач;
H = Hкон – Hнач.
Такая простая процедура расчета возможна потому, что внутренняя энергия U и энтальпия Н являются функциями состояния системы и не зависят от пути перехода системы из одного состояния в другое, а определяются только значениями в конечном и исходном состояниях.
Если вещества, образующиеся при реакции, обладают меньшим запасом полной энергии, чем вещества, вступающие в реакцию, то в процессе реакции эта энергия выделяется (наиболее часто в виде теплоты Q, но возможны также и другие формы энерговыделения: излучение света, звука, например при взрыве). Такие реакции, сопровождающиеся понижением полной энергии системы ( Hреак 0, Uреак 0), на-
зываются экзотермическими (в общем случае – экзоэнергетическими).
Если вещества, образующиеся при реакции, обладают большим запасом полной энергии, чем вещества, вступающие в реакцию, то при протекании этой реакции необходимая энергия в виде теплоты будет поглощаться из окружающей среды. Такие реакции, сопровождающиеся повышением полной энергии системы(( Hреак 0, Uреак 0), на-
зываются эндотермическими (в общем случае эндоэнергетическими).
Количество энергии (в частности, теплоты Q), которое выделяется или поглощается при химической реакции, называется энергетиче-
ским (тепловым при выделении теплоты) эффектом реакции. Энер-
гетические (тепловые) эффекты химических реакций, протекающих в изохорных условиях (например, в автоклавах), возникают при изменении внутренней энергии системы, поэтому QV = Uреак. При протекании реакции в наиболее распространенных изобарных условиях такой энергетический (тепловой) эффект связан с изменением энтальпии при химическом превращении и называется энтальпией химиче-
ской реакции Hреак, т. е. QP = – Hреак.
Энтальпия химической реакции зависит от температуры, поэтому для широкого использования величин энтальпий реакций в расчетах их значения пересчитываются на условия стандартного состояния
(T = 298 К, Р = 100 кПа) и обозначаются H0298. В условиях стандартного состояния протекает ограниченное число реакций, поэтому пере-
28

счет результатов термодинамических расчетов из стандартного состояния в условия реального протекания реакции производится с учетом температурной зависимости теплоемкости всех участвующих в реакции веществ.
Для расчета энтальпий химических реакции используют закон Гесса.
Энтальпия химической реакции не зависит от пути протекания процесса, а определяется только состоянием исходных веществ и продуктов реакции.
Энергическое состояние каждого вещества может быть охарактеризовано энтальпией образования этого вещества.
Энтальпией образования Hобр вещества называется количество энергии, выделяемое или поглощаемое при образовании одного моля этого вещества из простых веществ. Энтальпия образования вещества в системе СИ измеряется в килоджоулях на моль (кДж/моль). Энтальпия образования для стандартных условий обозначается H0обр (или латинский вариант H0f, где f – первая буква слова formation – образование) и называется стандартной энтальпией образования.
Закон Гесса имеет два следствия.
Следствие 1. Энтальпии образования и разложения одного и того же вещества равны по абсолютной величине, но противоположны по знаку:
|
H (г) + 1/2O |
(г) = H O(г), H0 |
|
= –241,9 кДж, |
|
||||||
|
2 |
|
2 |
|
2 |
реак |
|
|
|
|
|
|
H O (г) = H (г) + 1/2O |
(г), H0 |
|
= + 241,9 кДж. |
|
||||||
|
2 |
|
2 |
|
2 |
реак |
|
|
|
|
|
|
Следствие 2. Энтальпия химической реакции |
H0реак равна раз- |
|||||||||
ности между |
энтальпиями |
образования |
продуктов |
реакции |
|||||||
i· |
H0обр.прод |
и |
энтальпиями |
образования |
исходных |
веществ |
|||||
i |
H0обр.реаг с учетом их стехиометрических коэффициентов |
i: |
|||||||||
|
|
H0реак = |
i |
H0обр.прод – |
i H0обр.реаг, |
|
|||||
где – условное обозначение суммы. Например, для реакции |
|
||||||||||
|
|
|
a A + b B |
c C + d D, |
|
|
|
||||
|
H0реак = (c |
H0обр.C +d |
H0обр.D) – a |
H0обр.A + b |
H0обр.B), |
||||||
где A, B и C, D – реагенты и продукты реакции; a, b, c, d – соответствующие стехиометрические коэффициенты при реагентах
и продуктах реакции; H0обр.C, H0обр.D, H0обр.A, H0обр.B – энтальпии образования реагентов и продуктов реакции.
Энтальпия реакции дает возможность рассчитать, какое количество теплоты выделится или поглотится при протекании реакции,
29
но не позволяет определить возможность ее самопроизвольного протекания в конкретных условиях. Критерием самопроизвольного протекания химической реакции для изобарных условий является энергия Гиббса реакции Gреак, которая определяется суммарным изменением энергии Гиббса реакции как термодинамической системы.
Изменение энергии Гиббса системы выражается формулой
G = H – T S,
где S – изменение энтропии: Т – абсолютная температура.
Энергия Гиббса – это функция состояния системы, определяющей величину той части энтальпии, которая еще не рассеялась и за счет которой система может совершать работу. Самопроизвольное возрастание энтропии S, сопровождающее приближение системы к равновесию, характеризуется переходом энтальпии Н из концентрированной формы энергии Гиббса G в рассеянную Т · S. Таким образом, в самопроизвольных процессах энергия Гиббса убывает ( G 0). При достижении равновесия она принимает минимальное значение (G = Gmin), а ее приращение обращается в ноль ( G = 0). Термодинамический анализ возможности протекания химической реакции, таким образом, состоит в определении величины и знака энергии Гиббса ре-
акции |
Gреак. При Gреак 0 самопроизвольное протекание реакции |
возможно, при Gреак = 0 реакция находится в состоянии равновесия, |
|
а при |
Gреак 0 самопроизвольное протекание реакции запрещено. |
Методика и порядок выполнения работы
Опыт 1. Определение энтальпии реакции нейтрализации одноосновной кислоты раствором основания
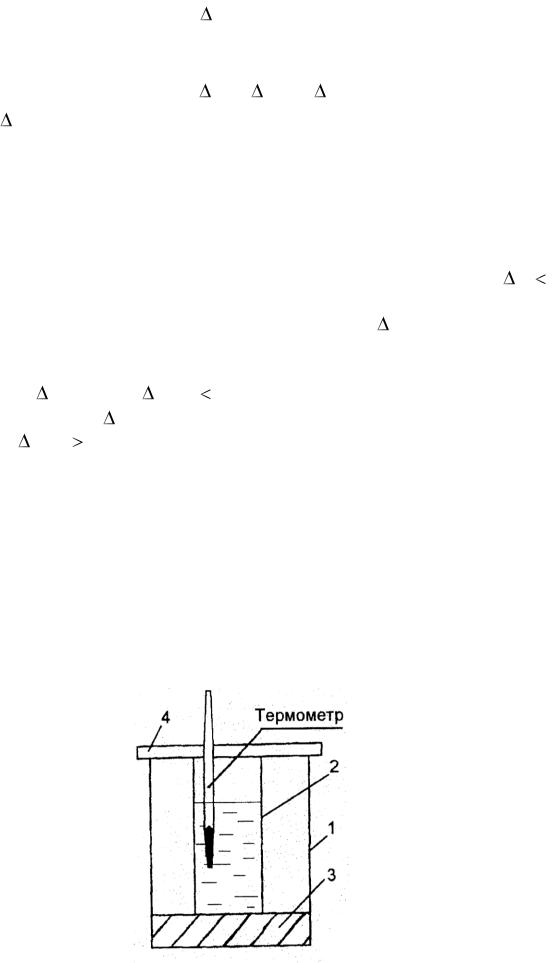
Определение тепловых эффектов химических реакций и физикохимических процессов проводят в специальных приборах – калориметрах (рис. 3.1).
Калориметр состоит из наружного 1 и внутреннего 2 стаканов. Внутренний стакан ставится на асбестовую прокладку 3 в целях
уменьшения |
закрывается пластиковой |
крышкой 4, через |
стакан вставлен термометр |
с ценой деления 0,1
|
|
Термометр |
||||
4 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
3
