
МУ по лаб.р. 2013
.pdf
капель 1н раствора тиосульфата натрия. |
Через 2–3 |
мин добавьте |
1 каплю 2н раствора серной кислоты из |
пробирки, |
находящейся |
в термостате, в пробирку с раствором тиосульфата натрия. По секундомеру отсчитайте время появления голубоватой опалесценции.
Повторите опыт 4 раза, увеличивая температуру воды в термостате каждый раз на 10 °С. Данные наблюдения занесите в табл. 4.2.
|
|
|
|
|
|
Таблица 4.2 |
|
|
|
|
|
|
|
№ |
Температура |
Время |
Скорость |
ln V, |
1/T, К–1 |
Энергия |
наблю- |
раствора Т, |
течения |
реакции |
c–1 |
|
активации |
дения |
К |
реакции |
V = C/ , c–1 |
|
|
реакции Еа кт, |
|
|
, с |
|
|
|
кДж/моль |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
Представьте полученные результаты графически в координатах V – скорость реакции, Т – температура. Сделайте вывод о характере зависимости скорости химической реакции от температуры.
Практическое задание. Определение энергии
активации реакции
По экспериментальным данным о влиянии температуры на скорость химической реакции можно определить энергию активации реакции. Из общего выражения:
Eакт
V V0 e RT
следует, что энергия активации Еакт экспоненциально влияет на скорость и не зависит от температуры реакции. Логарифмирование позволяет получить это выражение в виде прямой в полулогарифмических координатах ln V = f (1/T):
ln V ln V0 |
Еакт |
1 |
, |
|
R |
|
T |
||
|
|
|
||
где Еакт – угловой коэффициент этой прямой.
R
41
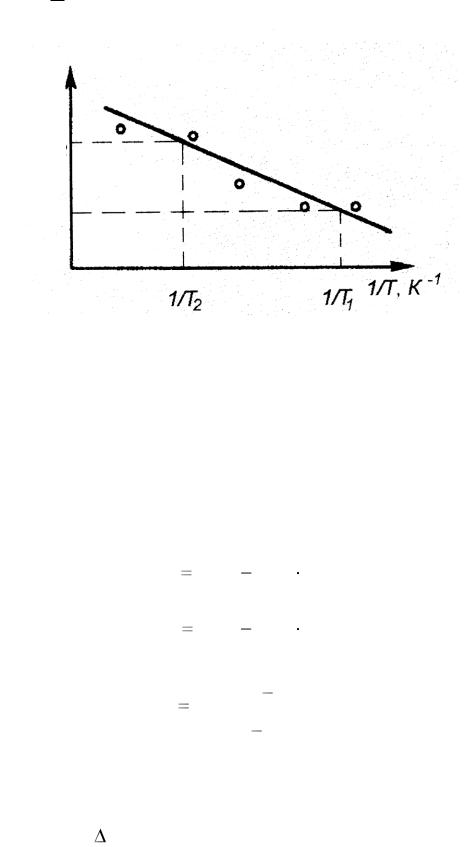
На рис. 4.2 построена линейная зависимость ln V от обратной
температуры 1 по экспериментальным данным, взятым из табл. 4.2.
Т
ln V, (c–1)
lnV2
lnV1
|
|
33 |
|
1/T2 |
|
1/T1 |
1/T, K–1 |
|
|
|
|
|
|
|
|
Рис. 4.2. Температурная зависимость скорости реакции взаимодействия тиосульфата натрия с серной кислотой в полулогарифмических координатах
Расчет энергии активации выполняют как определение углового коэффициента прямой, построенной по экспериментальным результатам (аналогично опыту 1), по двум произвольным точкам, лежащим на прямой.
В расчетах значение универсальной газовой постоянной необходимо принять равной 8,3 Дж / (моль · К):
ln V2 |
ln V0 |
Еакт |
1 |
|
, |
||
R |
|
T2 |
|
||||
|
|
|
|
|
|
||
ln V1 |
ln V0 |
|
Еакт |
1 |
, |
||
|
R |
|
T1 |
||||
|
|
|
|
|
|
||
Откуда |
|
|
|
|
|
|
|
Е |
R(ln V2 |
ln V1) . |
||||
акт |
1 |
|
1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
T1 |
T2 |
|||
По величине энергии активации сделайте вывод о степени влияния температуры на скорость исследованной реакции и укажите, чем Еакт отличается от Н реакции.
42
Опыт 3. Влияние катализатора на скорость химической реакции
Налейте в 2 пробирки по 5 капель 3%-го раствора пероксида водорода H2O2. В одну внесите на кончике микрошпателя несколько крупинок диоксида марганца МпО2. Другую пробирку оставьте для сравнения. Объясните наблюдаемое явление. Напишите уравнение реакции разложения пероксида водорода.
Опыт 4. Скорость реакции в гетерогенных процессах
Поместите в одну пробирку маленький кусочек мрамора, а в другую – примерно такое же количество измельченного мрамора. В обе пробирки одновременно добавьте по одной капле 0,1н раствора соляной кислоты. Наблюдайте за скоростью реакции в обеих пробирках. Напишите уравнение реакции. Какой фактор в данном случае влияет на увеличение скорости реакции?
Опыт 5. Химическое равновесие
Влияние концентрации реагирующих веществ на химическое равновесие исследуйте на примере реакции
FeCl3 + 3KCNS Fe(CNS)3 + 3KCl
Красное окрашивание роданида железа Fe(CNS)3 позволяет следить за сдвигом химического равновесия при изменении концентрации реагирующих веществ.
В 4 пробирки внесите по 5 капель разбавленных растворов хлорида железа FeCl3 и роданида калия KCNS.
Легким встряхиванием размешайте растворы. Одну из пробирок оставьте в качестве контрольной. Во вторую пробирку введите 2, 3 капли концентрированного раствора хлорида железа, в третью – 2, 3 капли концентрированного раствора KCNS, в четвертую насыпьте микрошпатель твердого хлорида калия и встряхните, чтобы ускорить растворение соли. Сравните окраску раствора в трех пробирках с окраской в контрольной пробирке и объясните происходящие изменения, исходя из принципа Ле Шателье. Напишите выражение для константы равновесия данного процесса. Будет ли правильным утверждение, что изменение концентрации реагирующих веществ повлекло за собой изменение величины константы равновесия?
43
Контрольные вопросы
1.Как определяется скорость реакции?
2.От каких факторов зависит скорость химической реакции?
3.Объясните влияние температуры на скорость химической реакции.
4.Каким законом описывается влияние концентрации реагирующих веществ на скорость химической реакции?
5.Объясните роль катализатора в повышении скорости химической реакции.
6.Какой принцип объясняет направление смещения химического равновесия?
7.Какие реакции называются обратимыми?
8.Укажите, какие из приведенных ниже систем являются гомогенными, а какие – гетерогенными:
2BaCl(ж) + Na2SO4(ж) |
NaCl(ж) +BaSO4(ж) |
N2(r) + O2(r) |
2NO(r) |
CO(r) + H2O(r) |
CO2(r)+ H2(r) |
FeO(k) + CO(r) |
Fe(k) + CO2(r) |
CaCO3(k) CaO(k) + CO2(k)
9. В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций:
2SO2(r) + O2(r) |
2SO3(r) |
H = –196,46 кДж; |
N2(r) + O2(r) |
2NO(r) |
H = +176,74 кДж; |
H2(r) + Br2(r) |
2HBr(r) |
H = –70,22 кДж; |
N2O4(r) 2NO2(r) |
H = +54,34 кДж. |
|
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк.,
2000. – С. 167–203.
2.Фролов, В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С. 118–140.
3.Глинка, Н. Л. Общая химия / Н. Л. Глинка. – Л. : Химия, 1987. –
С. 173–198.
44
Лабораторная работа 5
РАСТВОРЫ ЭЛЕКТРОЛИТОВ И ГИДРОЛИЗ СОЛЕЙ
Цель работы: изучить основные свойства растворов электролитов и особенности гидролиза солей.
Теоретические сведения
Вещества, проводящие электрический ток, принято делить на проводники первого и второго рода. К проводникам первого рода относят металлы и полупроводники, в которых электропроводность осуществляется отрицательно заряженными частицами – электронами; к проводникам второго рода – электролиты.
Электролитами называются вещества (твердые и жидкие), содержащие положительно и отрицательно заряженные ионы, существующие независимо от внешних электрических и магнитных полей. Следовательно, в проводниках второго рода электропроводность осуществляется за счет положительно и отрицательно заряженных ионов.
Образование ионов в электролитах происходит в результате диссоциации – распада ионных соединений и веществ с ковалентной полярной связью под действием температуры (плавление) или растворителя (растворение). Существуют твердые электролиты (например, оксид циркония ZrO2 с добавками CaO, V2O2), в которых под действием температуры происходит диссоциация связи металлкислород,
и ионы кислорода O–2 и металла Me+n обретают способность перемещаться в электрическом поле. К жидким электролитам относятся расплавы оксидов и солей и растворы солей, кислот и оснований. Несмотря на различные способы образования, все электролиты обладают рядом общих свойств.
Теория электролитической диссоциации (ТЭД). Основы ТЭД заложил шведский физико-химик Сванте Аррениус (1887). Согласно ТЭД, при растворении в воде электролиты под действием полярных молекул воды распадаются на положительные ионы – катионы
(например, Ca2+, Na+, H+) и отрицательные ионы – анионы (например,
OH–, SO32–, SO42–).
Количественно этот процесс характеризуется степенью диссо-
циации α:
45

α равна отношению числа распавшихся молекул к общему числу молекул электролита в растворе.
Величина α изменяется от нуля до единицы. Степень диссоциации зависит от природы электролита, его концентрации в растворе и температуры. По степени диссоциации в растворе все электролиты можно условно разделить на две группы:
– сильные электролиты обладают степенью диссоциации α 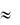 1, которая почти не зависит от концентрации раствора. К ним относятся водные растворы большинства солей, щелочи и растворы сильных кислот HNO3, HCl и др.;
1, которая почти не зависит от концентрации раствора. К ним относятся водные растворы большинства солей, щелочи и растворы сильных кислот HNO3, HCl и др.;
– у слабых электролитов α < 1 и уменьшается с ростом концентрации. К ним относятся вода, ряд слабых кислот, основания р-, d- и f-элементов.
Между этими двумя группами нет четкой границы. Одно и то же вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
Процесс диссоциации одноосновной кислоты НСl можно выра-
зить уравнением |
|
HCl |
H+ + Cl–. |
Многоосновные кислоты, основания металлов, имеющих степень окисления +2 и выше, диссоциируют ступенчато. Например, диссоциация ортофосфорной кислоты происходит в три ступени:
H3PO4 |
H2PO4– + H+ – 1 ступень; |
|
H2PO4– |
HPO42– + H+ – 2 |
ступень; |
HPO42– |
PO43– + H+ – 3 |
ступень. |
Суммарный процесс диссоциации ортофосфорной кислоты можно записать в виде уравнения
H3PO4 3H+ + PO43–.
Как всякая химическая реакция, диссоциация является обратимым процессом, который при достижении равновесия можно охарак-
теризовать константой диссоциации:
K |
|
H |
|
3 |
|
РО43 |
|
|
. |
||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
Н3РО4 |
|
|
|
||||||
|
|
|
|||||||||
|
|
|
|
|
|||||||
В случае ступенчатой диссоциации каждая ступень имеет свою константу диссоциации. Например, для раствора ортофосфорной кислоты при температуре 25 °С:
46

K |
|
H |
|
|
Н2 |
РО4 |
|
|
7,1 10 3; |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
Н3РО4 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
K2 |
|
|
H |
|
|
Н2 |
РО4 |
2 |
|
1,9 10 6 ; |
||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
Н2РО4 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
K3 |
|
|
|
H |
|
|
|
РО43 |
|
3,5 10 13. |
||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
НРО4 |
2 |
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Константа диссоциации убывает с ростом номера ступени диссоциации потому, что с повышением отрицательного заряда кислотного остатка возрастает энергия, необходимая для отрыва от него положительно заряженного иона водорода. Константа диссоциации зависит от температуры и природы электролита, но, в отличие от степени диссоциации, не зависит от концентрации.
Ионное произведение воды. Химически чистая вода является слабым электролитом. Условно реакция диссоциации молекул воды записывается следующим образом:
H2O H+ + OH–
При температуре 22 °С концентрация ионов мала: [Н+] = [ОН–]= 10–7 моль/л,
поэтому концентрацию недиссоциированных молекул воды можно считать постоянной величиной: [H2O] = const. Тогда постоянным будет и произведение ионов – ионное произведение воды ПР:
ПР =[H+] [OH–] = 10–14
Водородный показатель. Соотношением концентраций ионов водорода и гидроксида характеризуется основность и кислотность раствора. Чистая вода, в которой концентрации ионов [Н+] и [ОН–] равны, считается нейтральной средой. В кислых растворах [Н+] 10–7 моль/л, а [ОН–] 10–7моль/л, в основных растворах [Н+] 10–7моль/л,
а [ОН–] 10–7моль/л. Для удобства основность или кислотность водных сред принято количественно характеризовать водородным показателем рН – отрицательным десятичным логарифмом концентрации ионов водорода в растворе:
pH = – lg[H+].
47

Очевидно, что для чистой воды рН = 7, для кислых сред рН 7, а для основных – рН > 7.
Задача. Вычислить рН 0,01 М раствора соляной кислоты. Решение
[H+] = CHCl = 0,01 = 10–2 моль/л, pH = –lg[H+] = lg 10–2 = 2,
pH = 2.
Гидролиз солей. Гидролизом называют процесс разложения водой веществ, составные части которых в этом процессе соединяются с составными частями воды. При гидролизе солей продукты их диссоциации (анионы Аn– и катионы Kt+) взаимодействуют с продуктами диссоциации воды с образованием слабого электролита-основания или кислоты по схеме:
An– + H2O = HAn +OH–
Kt+ + H2O = KtOH + H+
Гидролизу подвергаются соли, образованные либо сильной кислотой и слабым основанием, либо сильным основанием и слабой кислотой, либо слабым основанием и слабой кислотой.
Как и любой другой химический процесс, гидролиз можно представить в виде молекулярных и ионных уравнений.
Гидролиз по катиону. Для примера рассмотрим гидролиз СuCl2 – соли, образованной сильной кислотой HCI и слабым многокислотным основанием Сu(ОН)2. В обычных условиях гидролиз этой соли протекает ступенчато. Гидролиз по катиону представляется молекулярным уравнением (первая ступень):
CuCl2 + H2O |
CuOHCl +HCl, pH 7; |
в ионно-молекулярной форме:
Cu2+ + 2Cl– + H2O |
(CuOH)+ H+ + 2Cl–, pH 7. |
Сокращенное ионно-молекулярное уравнение гидролиза имеет
вид:
Cu2+ + H2O (CuOH)+ + H+, pH 7.
В растворе возникает избыток ионов водорода Н+, поэтому раствор CuCI2 – соли сильной кислоты и слабого основания – имеет кислую реакцию (рН 7).
Гидролиз по аниону. Рассмотрим гидролиз соли, образованной сильным основанием и слабой многоосновной кислотой, например
48

Na2S. В обычных условиях реализуется только первая ступень гидролиза таких солей по аниону. Суммарное молекулярное уравнение этого процесса имеет вид
Na2S + 2H2O NaHS +NaOH pH 7,
или в ионно-молекулярной форме
2Na+ +S2– + H2O |
2Na+ + HS– +OH– pH 7. |
Сокращенное ионно-молекулярное уравнение имеет вид
S2– +H2O HS– + OH– pH 7.
В растворе Na2S появляется избыток ионов ОН–. Обобщая, можно заключить, что в результате гидролиза раствор соли сильного основания и слабой кислоты имеет щелочную реакцию (рН 7).
Рассмотрим теперь гидролиз соли, образованной слабым основанием и слабой кислотой, например (NH4)2S. Гидролиз таких солей часто протекает необратимо, т. е. сопровождается полным разложением соли.
Суммарное молекулярное уравнение гидролиза сульфида аммо-
ния (NH4)2S следующее: |
|
(NH4)2S + 2H2O |
2NH4OH + H2S |
Ионно-молекулярное уравнение гидролиза |
|
2(NH4)+ + S2– +2H2O |
2NH4OH + H2S |
Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от соотношения констант диссоциации кислоты и основания, образующих соль.
При составлении ионно-молекулярных уравнений гидролиза растворов солей необходимо помнить, что формулы веществ, выпадающих в осадок, газообразных, малодиссоциирующих, записывают в молекулярном, а не в ионном виде.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, т. е. раствор такой соли имеет нейтральную реакцию: рН = 7.
Пример: при растворении K2SO4 гидролиза не происходит:
K2SO4 +2H2O |
2KOH + H2SO4 |
2K+ +SO42– + 2H2O 2K+ + 2OH– + 2H+ + SO42– |
|
2H2O |
2OH– + 2H+ |
49
Ионы K+ и SO42– остаются в растворе в виде гидратированных ионов. Слабых электролитов, веществ, выпадающих в осадок, и газообразных соединений в этом процессе не образуется.
Методика и порядок выполнения работы
Опыт 1. Исследование электропроводимости растворов электролитов
Всухой стаканчик внесите немного хлорида натрия NaCl. Опустите в соль электроды для проверки электропроводности. Не прикасаясь к электродам, включите прибор в сеть. Проводит ли сухая соль электрический ток? Отключите прибор от сети. В другой стаканчик налейте 20–30 мл дистиллированной воды. Поместите в воду электроды прибора. Уберите руки и включите прибор в сеть. Проводит ли дистиллированная вода электрический ток? Внесите в стаканчик 5, 6 микрошпателей соли NaCl. Что наблюдается? Запишите результаты опыта и объясните, почему сухая соль и дистиллированная вода не проводят электрический ток, а раствор соли – проводит.
В4 стаканчика емкостью 50 мл налейте по 10 мл следующих веществ: в первый – 0,1 н раствор соляной кислоты; во второй – 0,1 н раствор гидроксида натрия; в третий – концентрированную уксусную кислоту; в четвертый – концентрированный раствор гидроксида аммония. Определите электропроводность каждого из этих растворов, погружая в них электроды. После каждого испытания промывайте электроды в стаканчике с дистиллированной водой!
По степени накала лампочки сделайте вывод о силе исследованных кислот и основания.
Слейте вместе содержимое стаканчиков с уксусной кислотой и гидроксидом аммония и определите электропроводность этой смеси. Почему степень накала лампочки в этом случае отличается от ее накала при определении электропроводности уксусной кислоты и гидроксида аммония, взятых отдельно? Опишите наблюдаемые явления и сделайте выводы об их причинах.
Опыт 2. Понижение степени диссоциации слабого электролита
К разбавленному раствору уксусной кислоты СН3СООН (4-6 капель), окрашенному каплей метилового оранжевого в розовый цвет, прибавьте 3, 4 микрошпателя ацетата натрия CH3COONa. Что
50
