
МУ по лаб.р. 2013
.pdfВ результате реакции количество атомов в молекуле может увеличиваться (синтез), уменьшаться (разложение) или оставаться постоянным (изомеризация, перегруппировка).
В ходе реакции изменяются связи между атомами и порядок размещения атомов в молекулах.
Химические реакции выявляют и характеризуют химические свойства данного вещества.
Исходные вещества, взятые для проведения химической реакции, называются реагентами, а новые вещества, образующиеся в результате химической реакции, – продуктами реакции.
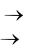
В общем виде химическая реакция изображается следующим бразом:
Реагенты → Продукты
Изучение курса химии позволяет получить современное научное представление о материи и формах ее движения, о веществе как одном из ее видов, механизме превращения химических соединений. Необходимо прочно усвоить основные законы химии, изучить механизмы реакций и физико-химических процессов, овладеть техникой химического эксперимента и химических расчетов.
Знания химии полезны любому человеку, поскольку он постоянно сталкивается с различными веществами и с различными процессами, так как научно-технический прогресс вызывает к жизни все новые материалы, новые машины, аппараты и приборы, в которых широко используются достижения химии.
11
Лабораторная работа 1
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: повторить классификацию и номенклатуру неорганических соединений и экспериментально изучить основные химические реакции с их участием.
Теоретические сведения
Все вещества в природе делятся на простые и сложные.
Простые вещества состоят из атомов одного элемента, например S, O2, Cl2, Na, P. Простые вещества разделяют на металлы и неметаллы. Это деление основано на различиях в физических свойствах простых веществ.
Металлы отличаются характерным металлическим блеском, ковкостью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей тепло- и электропроводностью. При комнатной температуре все металлы, кроме ртути, находятся в твердом состоянии. В периодической системе элементов Д. И. Менделеева (прил. 10) металлами являются все s-, d-, f-элементы и половина р-элементов, расположенных слева под диагональю, проходящей от бора к астату.
Неметаллы в твердом состоянии не обладают характерным для металлов блеском, хрупки, очень плохо проводят тепло и электри - чество. Некоторые из них при обычных условиях газообразны. В Периодической системе элементов Д. И. Менделеева неметаллами являются р-элементы, которые находятся справа над диагональю, проходящей от бора к астату.
В состав сложных веществ входят два или более элемента (на-
пример, Н2О, НСl, Н3РО4, Na2CO3).
Сложные вещества делятся на органические и неорганические. Органическими принято называть соединения углерода (напри-
мер, СН3СООН – уксусная кислота, С2Н5ОН – этиловый спирт). Простейшие соединения углерода (СО, СO2, Н2СО3 и карбонаты,
HCN
и цианиды, карбиды и некоторые другие) обычно рассматривают в курсе неорганической химии.
Все остальные вещества называются неорганическими (иногда – минеральными). Неорганические вещества делятся на пять главных классов: оксиды, кислоты, основания, амфотерные гидроксиды и соли.
12

Кислородсодержащие кислоты, основания и амфотерные гидроксиды по своей природе можно объединить в самостоятельный класс гидроксидов.
Оксиды
Оксидами называются все соединения, состоящие из кислорода и какого-нибудь элемента. Если элемент образует несколько оксидов, то по числу атомов кислорода, приходящихся на атом элемента, оксиды называются таким образом: монооксидом углерода – СО, диоксидом углерода – СO2 и т. д.
Большинство оксидов непосредственно или косвенным путем образуют с водой соединения, носящие название гидроксидов. Например:
CaO + H2O = Ca(OH)2 – основной гидроксид кальция;
SO2 + H2O = H2SO3 – кислотный гидроксид (IV) серы или сернистая кислота.
При нагревании гидроксиды, кроме гидроксидов щелочных и щелочноземельных металлов, разлагаются на оксид и воду:
Cu(OH)2 (t) |
CuO + H2O |
H2SO3 (t) |
SO2 + H2O |
Гидроксиды, в зависимости от их свойств, относят или к классу кислот, или к классу оснований. Кроме того, существуют гидроксиды, обладающие одновременно свойствами и кислот, и оснований. Они называются амфотерными гидроксидами. В соответствии с этим оксиды и образующиеся гидроксиды делятся на три группы: кислотные, основные и амфотерные.
Кислотные оксиды – это оксиды, гидроксиды которых являются кислотами. Это главным образом оксиды неметаллов (SO3, NO2), хотя некоторые высшие оксиды металлов тоже являются кислотными (СrОз, Мп2О7). Многие кислотные оксиды непосредственно соединяются с водой, образуя кислоты:
SO3 + H2O H2SO4 – кислотный гидроксид серы (VI), или серная кислота;
CrO3 + H2O H2CrO4 – кислотный гидроксид хрома (VI), или хромовая кислота.
Гидроксиды других кислотных оксидов получают косвенным пу-
тем.
Кислотные оксиды иногда называют ангидридами соответствующих кислот (например, Р2О5 – ангидрид фосфорной кислоты, или просто фосфорный ангидрид).
13

Главный отличительный признак кислотных оксидов – их способность взаимодействовать с основаниями с образованием солей. Например:
CO2 + 2NaOH Na2CO3 + H2O.
Кислоты, как правило, не взаимодействуют с кислотными оксидами, кроме окислительно-восстановительных реакций.
Основные оксиды – оксиды, гидроксиды которых являются основаниями. Основные оксиды образуются исключительно металлами. Только оксиды щелочных и щелочноземельных металлов непосредственно соединяются с водой, образуя растворимые в воде основания – щелочи. Например:
Na2O + H2O = 2NaOH, CaO + H2O = Ca(OH)2
Большинство же основных оксидов не взаимодействуют с водой; соответствующие им основания получают косвенным путем и нерастворимы в воде (прил. 3). Все основные оксиды взаимодействуют с кислотами, образуя соли, но не взаимодействуют с основаниями, например:
MgO + H2SO4 MgSO4 +H2O
Амфотерные оксиды (Аl2О3, Сr2О3, ZnO и др.) обладают одновременно свойствами и кислотных, и основных оксидов. Они взаимодействуют и с кислотами, и с основаниями с образованием солей. Например:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] – тетрагидроксоалюминат натрия;
Al2O3 + 6HCl = 2AlCl3 + 3H2O – хлорид алюминия.
Все оксиды рассмотренных групп обладают свойством образовывать соли, поэтому их часто объединяют под общим названием соле-
образующие оксиды.
Безразличные оксиды – оксиды, которые ни прямым, ни косвенным путем не образуют гидроксидов и не взаимодействуют ни с к и- слотами, ни с основаниями (например, NO, СО).
Особую группу оксидов образуют так называемые пероксиды. Это соединения некоторых металлов, которые только формально (по их составу) могут быть отнесены к классу оксидов, а по существу они являются солями пероксида водорода Н2О2 (например, Na2O2 – пероксид натрия, ВаО2 – пероксид бария).
Кислоты. Кислотные гидроксиды
14

Соединяясь с водой, оксиды неметаллов образуют вещества, относящиеся к классу кислот. Такие кислоты называются кислородными (например, H2SO4, H2CO3, HNO3) в отличие от бескислородных кислот, не содержащих кислорода (например, HCI, HF).
К классу кислотных гидроксидов относятся гидроксиды некоторых металлов в высшей степени окисления, например:
H2Cr2O7 – дихромовая кислота, или кислотный гидроксид
Cr (VI), HMnO4 – марганцевая кислота, или кислотный гидроксид
Mn (VII).
Водные растворы кислот имеют кислый вкус и окрашивают лакмус (прил. 4) и универсальную индикаторную бумагу в красный цвет. По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов, различают кислоты одноосновные (например,
HNO3), двухосновные (например, H2SO4) и трехосновные (например,
Н3PО4).
Все кислоты взаимодействуют с основаниями с образованием соли и воды, например:
HNO3 + KOH = KNO3 + H2O,
HMnO4 + KOH = KMnO4 + H2O.
Такие реакции называются реакциями нейтрализации.
Если от молекулы кислоты мысленно отнять один или несколько атомов водорода, способных замещаться атомами металлов, то останется группа атомов (а иногда и один атом), которая называется кислотным остатком и участвует в химических реакциях как единое целое. Например, у серной кислоты два кислотных остатка: HSO4 и SO42-; фосфорной кислоты Н3РО4 три кислотных остатка: H2PO4-, НРО42- и PO43- На этом основании молекулы всех кислот можно считать состоящими из атомов водорода и кислотных остатков (табл. 1.1).
У перечисленных выше кислот все атомы водорода могут быть замещены атомами металла, так что их основность прямо определяется числом атомов водорода в молекуле. Однако в уксусной кислоте СН3СООН из четырех атомов водорода только один замещается атомом металла, т. е. уксусная кислота – одноосновная кислота. Оказывается, что в молекулах кислородных кислот только те атомы водорода способны замещаться атомами металлов, которые связаны с атомами кислорода, например:
H+ |
O |
O |
H |
|
\ |
|
|
H+ O |
P = O |
H+ O C |
C H |
15

/ |
|
H+ O |
H |
фосфорная кислота |
уксусная кислота |
(трехосновная) |
(одноосновная) |
В приведенных структурных формах видим, что в молекуле фосфорной кислоты все атомы водорода связаны с атомами кислорода, а в молекуле уксусной кислоты три атома водорода связаны с атомом углерода и только один – с атомом кислорода. Этот атом водорода и замещается атомом металла.
Основания
Основаниями называются гидроксиды типичных металлов, взаимодействующие с кислотами с образованием солей. В состав молекулы любого основания входит атом металла и одна или несколько гидроксидных групп ОН-. Количество гидроксидных групп у основания определяет его кислотность. Например: NaOH, Mg(OH)2, Bi(OH)3. При действии кислоты с основанием гидроксидная группа OH– замещается кислотным остатком, и, таким образом, получается соль (реакция нейтрализации):
NaOH + НСl = NaCl + Н2О
Большинство оснований нерастворимы в воде. Основания, образованные наиболее активными металлами и растворимые в воде, называются щелочами (например, NaOH, КОН). Их растворы мылкие на ощупь и окрашивают лакмусовую бумагу в синий цвет, а фенолфталеин – в розовый (прил. 4).
Амфотерные гидроксиды
Гидроксиды, которые могут взаимодействовать как с кислотами (подобно основаниям), так и с основаниями (подобно кислотам), бразуя в том и другом случае соли, называются амфотерными гидроксидами. Примером может служить Zn(OH)2:
Zn(OH)2 + 2HCl = ZnCl2 +2H2O
основание хлорид цинка – соль соляной кислоты;
H2ZnO2 + 2NaOH = Na2ZnO2 +2H2O
кислота цинкат цинка – соль цинковой кислоты.
Соли
16
Соли – это продукты замещения атомов водорода в кислотах атомами металла, или продукты замещения гидроксогрупп в основаниях кислотными остатками. Формулы и названия солей наиболее распространенных кислот приведены в табл. 1.1. Таким образом, молекулы всех солей состоят из кислотных остатков и металла. Большинство солей – это твердые кристаллические вещества. Различают три главных вида солей: нормальные, кислые и основные.
Нормальные соли – продукты полного замещения атомов водорода в молекулах кислот на атомы металлов или гидроксидных групп в молекулах оснований на кислотные остатки. Например:
H3PO4 |
+ 3NaOH |
Na3PO4 + 3H2O |
Cu(OH)2 |
+ 2HNO3 |
Cu(NO3)2 + 2H2O. |
Кислые соли – продукты неполного замещения атомов водорода в кислотах на атомы металлов. Кислые соли содержат в своем составе водород, способный замещаться металлом. Например: KH2PO4 – дигидрофосфат калия, NaHSO4 – гидросульфат натрия. Кислые соли образуются двух или трехосновными кислотами.
Основные соли – продукты неполного замещения гидроксидных групп в основаниях на кислотные остатки. Например, CuOHCl – гидроксохлорид меди (II), (CuOH)2CO3 – гидроксокарбонат меди (II).
Названия кислых и основных солей. Число незамещенных атомов водорода в составе кислой соли обозначается с помощью греческих приставок: два – дигидро; три – тригидро; четыре – тетрагидро и т. п. Например, Ca(H2PO4)2 –дигидрофосфат кальция, MgHPO4 – гидроортофосфат магния. Число незамещенных групп OH– в составе основной соли обозначается аналогично: MgOHCl – гидроксохлорид магния; (BaOH)2SO4 – гидроксосульфат бария; [Al(OH)2]2SO4 – дигидроксосульфат алюминия.
|
|
Таблица 1.1 |
Соли наиболее часто встречающихся кислот |
||
|
|
|
Название кислоты |
Формула |
Название соли |
|
|
|
Азотистая |
HNO2 |
Нитрит |
|
|
|
Азотная |
HNO3 |
Нитрат |
Борная |
H3BO3 |
Борит |
Бромоводородная |
HBr |
Бромид |
|
|
|
Двухромовая |
H2Cr2O7 |
Бихромат |
Кремневая |
H2SiO3 |
Силикат |
Марганцовая |
HMnO4 |
Перманганат |
Серная |
H2SO4 |
Сульфат |
17
Название кислоты |
Формула |
Название соли |
Сернистая |
H2SO3 |
Сульфит |
Сероводородная |
H2S |
Сульфид |
Соляная |
HCl |
Хлорид |
Тиосерная |
H2S2O3 |
Тиосульфат |
Угольная |
H2CO3 |
Карбонат |
|
|
Окончание табл. 1.1 |
|
|
|
Название кислоты |
Формула |
Название соли |
|
|
|
Уксусная |
CH3COOH |
Ацетат |
Фосфорная |
H3PO4 |
Фосфат |
Фтороводородная |
HF |
Фторид |
Хлорноватая |
HClO3 |
Хлорат |
Хлорноватистая |
HClO |
Гипохлорит |
|
|
|
Хромовая |
H2CrO4 |
Хромат |
Цианистоводородная |
HCN |
Цианид |
(синильная) |
|
|
|
|
|
Хлорная |
HClO4 |
Перхлорат |
Методика и порядок выполнения работы
Опыт 1. Получение основного оксида разложением гидроксида металла
Налейте в пробирку 5–7 капель 1н раствора сульфата меди и добавьте такой же объем 2н раствора щелочи. Образовавшийся голубой осадок гидроксида меди (II) нагрейте на пламени спиртовки, пока он не превратится в оксид меди (II). Какой цвет получился из оксида меди (II)? Напишите уравнение реакции разложения гидроксида меди (II). Экспериментально проверьте, взаимодействует ли полученный оксид со щелочью и с кислотой. Запишите вывод.
Опыт 2. Получение щелочи взаимодействием основного оксида с водой
В пробирку налейте 5–7 капель дистиллированной воды и растворите в ней 1 микрошпатель оксида кальция СаО. Каплю полученного раствора нанесите на лакмусовую бумагу. К какому классу соединений относится образовавшееся вещество? Напишите уравнение реакции.
18
Опыт 3. Получение нерастворимого основания
В пробирку, содержащую 5–7 капель раствора хлорида никеля (II), добавьте 10–15 капель 2н раствора щелочи. Отметьте цвет выпавшего осадка. Напишите уравнения реакции.
Опыт 4. Получение кислоты реакцией двойного обмена
В пробирку внесите 10 капель 2н раствора ацетата свинца Рb(СН3СОО)2 и прилейте такой же объем 2н раствора серной кислоты H2SO4. По запаху определите образовавшуюся кислоту. Напишите уравнение реакции.
Опыт 5. Получение солей взаимодействием кислоты с основанием (реакция нейтрализации)
В пробирку, содержащую 5–7 капель 2н раствора NaOH, добавьте 1 каплю фенолфталеина. Затем добавьте по каплям 1н раствор НСl. Когда реакция станет нейтральной (произойдет обесцвечивание), прибавлять кислоту прекратите. Несколько капель раствора поместите в фарфоровую чашечку и осторожно выпарьте воду на пламени спир-
товки. Кристаллы какой соли получились? Напишите уравнение реакции.
Опыт 6. Получение соли взаимодействием металла с кислотой
Внесите в пробирку кусочек стружки магния и добавьте 3–4 капли 2н раствора серной кислоты H2SO4. Наблюдайте энергичное выделение пузырьков водорода. По окончании реакции каплю раствора поместите в фарфоровую чашечку и выпарьте воду на пламени спиртовки. Кристаллы какой соли получились? Напишите уравнение реакции получения соли.
Опыт 7. Получение соли взаимодействием основного оксида с кислотой
К 10–15 каплям серной кислоты добавьте 2 микрошпателя оксида меди (II) и нагрейте. Как только образуется голубой раствор, соберите
19
его пипеткой и выпарьте до образования кристаллов соли. Напишите уравнение реакции.
Контрольные вопросы и задания
1.К каким классам неорганических соединений относятся сле-
дующие вещества: HF, PbO2, Hg2SO4, Ni(OH)2, FeS, Na2CO3?
2.Составьте формулы: а) кислых калиевых солей фосфорной кислоты; б) основной цинковой соли угольной кислоты Н2СО3.
3.Какие вещества получаются при взаимодействии: а) кислот
с солью; б) кислот с основанием; в) соли с солью; г) основания
ссолью? Приведите примеры реакций.
4.С какими из перечисленных ниже веществ будет реагировать
соляная кислота: N2O5, Zn(OH)2, CaO, AgNO3, H3PO4, H2SO4? Составь-
те уравнения возможных реакций.
5.Укажите, к какому типу оксидов относится оксид меди, и докажите это с помощью химических реакций.
6.Закончите уравнения реакций:
Mg(OH)2 +H2SO4 =
NaOH + H3PO4– =
Ca(OH)2 + H2CO3 =
7.В этих реакциях возможна замена основного гидроксида на оответствующий оксид. Проведите эти замены и составьте уравнения реакций.
8.Назовите три способа получения солей. Ответ подтвердите уравнениями реакций.
9.Какие из перечисленных ниже веществ могут реагировать
между собой: NaOH, H3PO4, AI(OH)3, SO3, H2O, СаО? Ответ подтвердите уравнениями реакций.
Библиографический список
1.Глинка, Н. Л. Общая химия / Н. Л. Глинка. – Л. : Химия, 1984. –
С. 39 – 44.
2.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк.,
2000. – С. 10–13, 341–343.
20
