
- •Що таке пептиди?
- •Яка їх історія.
- •Класифікація і будова пептидів.
- •Синтез пептидів.
- •Види пептидів:
- •Їх утворення.
- •Сполуки, що володіють гормональною активністю (глюкагон, вазопрессин, кальцитонін і ін.) і гормони Гіпоталамуса;
- •1. Тиролиберин (Піро-Глу-Гіс-Про-nh 2):
- •Речовини, що регулюють травні процеси (гастрит, секретин та ін);
- •Пептиди, що регулюють апетит (ендорфіни, нейропептид-y, лептин і ін);
- •Сполуки, що володіють знеболюючим ефектом (опіоїдні пептиди);
- •Органічні речовини, що регулюють вищу нервову діяльність, біохімічні процеси, пов'язані з механізмами пам'яті, навчання, виникненням почуття страху, люті і ін.:
- •Пептиди, що регулюють артеріальний тиск і тонус судин (ангіотензин II, брадикінін, калідин та ін.)
-
Класифікація і будова пептидів.
Всі пептиди діляться на гомомірні і гетеромірні. Гомомірні пептиди при гідролізі утворюють тільки амінокислоти. Гетеромірні пептиди діляться на глік-, ліпо-, нуклео-, фосфопептиди та ін. Гомомірні і гетеромірні пептиди можуть бути лінійними і циклічними. Амінокислотні залишки в них з'єднані між собою тільки пептидними зв'язками (Пептидний (амидная) зв'язок — це вид хімічного зв'язку, який виникає внаслідок взаємодії α-аміногрупи однієї амінокислоти і α-карбоксигрупи іншої амінокислоти. Амідний зв'язок дуже міцний, і в нормальних клітинних умовах (37 °C, нейтральний ph) мимоволі не розривається. Пептидний зв'язок руйнується при дії на неї спеціальних протеолітичних ферментів (протеаз, пептідгідролаз).
O H O
// \ ǁ
R—
+ N—R→R—C—N—R'
+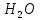
\ / |
OH H H
Пептиди, що містять в молекулі залишки тільки однієї амінокислоти, називаються гомополіамінокислотами, а містять однакові повторювані ділянки (з однієї або декількома амінокислотних залишків) регулярними пептидами. Особливу групу гетеромірних гетеродітних пептидів утворюють депсипептиди.
Сполуки, що містять більше ста амінокислотних залишків, зазвичай називаються білками.
За якісним складом розрізняють:
-
Гомопептиди - сполуки, що складаються тільки з амінокислотних залишків;
-
Гетеропептиди – речовини, до складу яких входять також небілкові компоненти.
Ланцюжок повторюваних атомів називається пептидним остовом: (-NH-CH-OC-). Ділянка (-CH-) з амінокислотним радикалом утворює сполучення (-NH-C (R1) H-OC-), зване амінокислотним залишком. N-кінцевий амінокислотний залишок має вільну α-аміногрупу (-NH), в той час як у C-кінцевого амінокислотного залишку вільною є α-карбоксильна група (OC-). Пептиди розрізняються не тільки за амінокислотним складом, але і за кількістю, а також розташуванню і з'єднанню амінокислотних залишків у поліпептидний ланцюжок. Незважаючи на однаковий кількісний і якісний склад, ці пептиди мають зовсім різні властивості (Пептиди постійно синтезуються у всіх живих організмах для регулювання фізіологічних процесів. Властивості пептидів залежать, головним чином, від їх первинної структури — послідовності амінокислот, а також від будови молекули та її конфігурації в просторі (вторинна структура)).
Структура важлива для першої стадії взаємодії речовини з нейроном, а саме для взаємодії пептиду з рецептором. Взаємодія пептиду з рецептором можна віднести до великої групи явищ біологічного «впізнавання», до якого відноситься взаємодія антигену з антитілом, ферменту з субстратом або токсину з його мішенню. Використовуючи сучасні фізико - хімічні методи дослідження, вчені визначають структуру, яку приймає гнучка молекула, взаємодіючи з рецептором, а потім змінюють структуру пептиду таким чином, щоб окремі частини молекули були жорстко закріплені в цій «працюючій» конформації. Результатом є потужне зростання активності синтетичних пептидів в порівнянні з натуральними, оскільки у натуральних пептидів в біологічних рідинах «активну структуру» має лише частина молекул.
При вивченні пептидів стає очевидною умовність поділу хімічних сигналів на медіатори (міжклітинний сигнал), гормони (транспорт на далекій відстані) і феромони (засіб спілкування між організмами).
Назви
пептидів утворюються з назв залишків
амінокислот, які входять до їх складу,
починаючи з N-кінцевої
амінокислоти. Причому в назвах амінокислот,
карбоксильні групи яких беруть участь
у реакції поліконденсації й руйнуються,
утворюючи ацильні залишки, суфікс «ін»
змінюється на «іл». Наведений трипептид
має назву аланіл-цистеїл-серин.
Низькомолекулярні пептиди за властивостями
відрізняються від білків — для них
нехарактерні денатурація та ефект
Тіндаля. Залежно
від амінокислотного складу пептиди
бувають кислими, лужними, нейтральними
і мають у дисоційованій формі позитивний,
негативний та нульовий заряди. В організмі
пептиди
можуть синтезуватися з амінокислот або
утворюватися при ферментативному
гідролізі білків. У тканинах та рідинах
організму міститься велика кількість
біологічно активних пептидів.
Кількість амінокислотних залишків у
структурі біологічно активних пептидів
коливається в середньому від 3 до 50.
Однак більшість біологічно активних
пептидів
має більше 10 амінокислот, наприклад,
нейропептид
-
 (регулятор апетиту) містить 36 амінокислот,
а кортиколіберин — 41 амінокислоту. У
деяких біологічно активних пептидах
існують незвичайні зв’язки між
амінокислотами, які не зустрічаються
в білках. Наприклад
пептиди,
які містять незвичайний для білків
зв’язок між амінокислотами трипептид
глутатіон, побудований з глутамату,
цистеїну та гліцину.
(регулятор апетиту) містить 36 амінокислот,
а кортиколіберин — 41 амінокислоту. У
деяких біологічно активних пептидах
існують незвичайні зв’язки між
амінокислотами, які не зустрічаються
в білках. Наприклад
пептиди,
які містять незвичайний для білків
зв’язок між амінокислотами трипептид
глутатіон, побудований з глутамату,
цистеїну та гліцину.
