
- •Що таке пептиди?
- •Яка їх історія.
- •Класифікація і будова пептидів.
- •Синтез пептидів.
- •Види пептидів:
- •Їх утворення.
- •Сполуки, що володіють гормональною активністю (глюкагон, вазопрессин, кальцитонін і ін.) і гормони Гіпоталамуса;
- •1. Тиролиберин (Піро-Глу-Гіс-Про-nh 2):
- •Речовини, що регулюють травні процеси (гастрит, секретин та ін);
- •Пептиди, що регулюють апетит (ендорфіни, нейропептид-y, лептин і ін);
- •Сполуки, що володіють знеболюючим ефектом (опіоїдні пептиди);
- •Органічні речовини, що регулюють вищу нервову діяльність, біохімічні процеси, пов'язані з механізмами пам'яті, навчання, виникненням почуття страху, люті і ін.:
- •Пептиди, що регулюють артеріальний тиск і тонус судин (ангіотензин II, брадикінін, калідин та ін.)
Вступ
Білки — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. Органічні сполуки, що містять в молекулі карбоксильну та аміно групи, називають амінокислотами. Амінокислоти є основою не тільки білків, а й пептидів, від яких безпосередньо залежить функціонування наших органів і систем. Пептидний зв'язок — хімічний зв'язок, що виникає між двома молекулами, коли карбоксильна група (-СООН) одної молекули реагує з аміногрупою (-NH2) іншої молекули, виділяючи молекулу води (H2O). Пептиди - це природні або синтетичні сполуки, які містять десятки, сотні або тисячі мономерних ланок — амінокислот. У 1900 році німецький хімік-органік Герман Еміль Фішер висунув гіпотезу про те, що пептиди складаються з ланцюжка амінокислот, утворених певними зв'язками. Пептиди, володіючи високою фізіологічною активністю, регулюють різні біологічні процеси. За своїм біорегуляторних дії пептиди прийнято ділити на кілька груп:
сполуки, що володіють гормональною активністю (глюкагон, окситоцин, вазопресин і ін);
речовини, що регулюють травні процеси (гастрин, шлунковий ингибирующий пептид та ін);
пептиди, що регулюють апетит (ендорфіни, нейропептид-Y, лептин і ін);
сполуки, що володіють знеболюючим ефектом (опіоїдні пептиди);
органічні речовини, що регулюють вищу нервову діяльність, біохімічні процеси, пов'язані з механізмами пам'яті, навчання, виникненням почуття страху, люті і ін;
пептиди, що регулюють артеріальний тиск і тонус судин (ангіотензин II, брадикінін та ін.)
Однак такий розподіл умовно, тому що дія багатьох пептидів не обмежується яким-небудь одним напрямком.
Розділ 1. Загальна характеристика пептидів.
Амінокислоти, що входять до складу білкової молекули, взаємодіють між собою за рахунок α-карбоксильних та α-амінних груп сусідніх амінокислот. При цьому утворюються амідні, або пептидні зв’язки. Залежно від їх кількості, розрізняють дипептиди, трипептиди , олігопептиди, поліпептиди.
Утворення пептидного зв’язка можна зобразити як відщеплення води від взаємодіючих карбоксильної та амінної груп сусідніх амінокислот:
H H H O H
| | | ǁ |
R
— C —COOH+
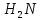 —C—R
—C—R
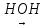 R—C—C—N—C—R
R—C—C—N—C—R
|
|
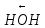 | | |
| | |
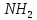 COOH
COOH
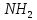 H COOH
H COOH
У молекулі білків група і
H O
| ǁ
—C— C— N—
|
H
багатократно повторюється,утворюючи скелет пептидного ланцюга:
R O R O R R
| ǁ | ǁ | |
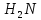 —C—C—N—C—C—N—C—CO
… NH—C—COOH
—C—C—N—C—C—N—C—CO
… NH—C—COOH
| | | | | |
H H H H H H
У кожному пептидному ланцюзі на одному кінці є вільна α-NH2-група(N-кінцева амінокислота), а на другому – вільна α-СООН-група(С-кінцева амінокислота). Структуру пептидів зображують, починаючи з N-кінцевої амінокислоти, тобто нумерацію амінокислотних залишків проводять із N-кінця. Наприклад:
Тир—Лей—Сер—Фен—Цис
1 2 3 4 5
Цей запис означає пентапептид(Винахід відноситься до нового пептиду, який виявляє протипухлинну активність, більш конкретно до пентапептид, способом його отримання і пептидними сполуками, які виявляють протипухлинну активність. Пентапептид був вперше виявлений і виділений нами з супернатанта короткочасної культури клітин кісткового мозку свині методом твердофазної екстракції і подальшим очищенням методом офВЕЖХ. Пентапептид отримують як твердофазним методом на полімерному носії, так і класичним пептидним синтезом в розчині. Пентапептид Val-Val-Tyr-Pro-Asp є імуномодулюючим пептидом, стимулюючим протипухлинну активність імунної системи людини. Він відрізняється від найближчих аналогів аллоферонов як первинною структурою, так і механізмом дії. На відміну від аллоферонов, пентапептид Val-Val-Tyr-Pro-Asp стимулює вироблення ендогенного інтерлейкіну-2. Механізм протипухлинного ефекту пентапептід Val-Val-Tyr-Pro-Asp заснований на відновленні функціональної активності Т-лімфоцитів, пригніченою продуктами пухлинних клітин в організмі пухлиноносія. Пентапептид не робить цитостатичної дії на пухлинну клітину, а сприяє відновленню протипухлинного імунітету, пригніченого пухлинними клітинами в організмі пухлиноносія), в якому вільна α-аміногрупа належить тирозину (N-кінець), а вільна α-карбооксильна група – залишку цистеїну (С-кінець). При читанні такого запису закінчення всіх амінокислот, за винятком останньої, змінюється на іл. Наприклад, назва три пептиду ТИР-АЛА-ЛЕЙ читається так: тирозин-аланіл-лейцин. Зрозуміло, що властивості пептидів і білків будуть залежати від кількості амінокислот, що входять до їх складу, виду амінокислот та порядку чергування їх у пептидному ланцюзі. Довжина пептидного ланцюга в пептидах і білках може коливатись у широких межах – від двох до сотні, а іноді тисяч амінокислотних залишків. Умовно всі пептидні сполуки, залежно від довжини ланцюга, ділять на олігопептиди (містять від 2 до 10 амінокислот), поліпептиди (від 10 до 40) і білки (більше 40).
-
Що таке пептиди?
Поширені назви пептидів відображає їхні фізіологічна дія, особливості структури, джерело, з якого вперше був виділений пептид, і т.і. Так, після виявлення опіоїдних пептидів вони отримали назву ендогенних морфіну, а пізніше інший пептид з ще більш сильною морфиноподібною дією так і був названий динорфінів. Холецистокинин в дослівному перекладі означає пептид, що викликає рух жовчного міхура. Нарешті, назва «речовина Р» відображає етап отримання активного препарату.
Ні локалізація, ні функція пептиду не можуть бути основою раціональної класифікації. Справді, дослідження показали, що аналогічні або дуже подібні з пептидами ссавців хімічні сполуки можуть бути виявлені у більш простих організмів, тобто в еволюційному плані пептидні регулятори виникають раніше, ніж нова структура і нова функція, для виконання якої природа пристосовує вже існуючий пептидний регулятор. Знання структури дуже важливо, воно дозволяє на логічно ясній основі об'єднати пептиди тварин різних видів у сімейства і зробити висновок про можливі схожості дій. Проте слід мати на увазі, що фізіологічний ефект визначається не тільки структурою пептиду, але й особливостями рецептора, з яким пов'язаний рецептор. Отже, за необхідності доводиться вивчати і сам пептид, і його біологічну дію у кожного виду.
У біохімії пептидами прийнято називати низькомолекулярні фрагменти білкових молекул, що складаються із невеликого числа амінокислотних залишків ( від двох до декількох десятків). Багато пептидів є біологічно активними речовинами.

Пептиди (грец. Peptos - перетравлений) — органічні сполуки, молекули яких побудовані із залишків α-амінокислот, з'єднаних у ланцюг пептидними (амідними) зв'язками-C (O) NH-. Це природні або синтетичні сполуки, які містять десятки, сотні або тисячі мономерних ланок — амінокислот. Умовно всі пептиди залежно від довжини ланцюга розділяють на олігопептиди (містять 2–10 амінокислот), поліпептиди (10–50) та білки (>50). Якщо середньою молекулярною масою амінокислоти вважати 100 Дал. Пептиди знаходитися у межах 200–1000 Да, поліпептиди — 1000–4000Да, а білків — від 4–5 тис. до декількох мільйонів. Молекули пептидів можуть бути лінійними або циклічними. На одному з кінців лінійні пептиди містять вільну карбоксильну (С-кінець), а на другому — вільну аміногрупу (N-кінець).
-
Яка їх історія.
Пептиди вперше були виділені з гідролізатів білків, отриманих за допомогою ферментації. У 1900 році німецький хімік-органік Герман Еміль Фішер висунув гіпотезу про те, що пептиди складаються з ланцюжка амінокислот, утворених певними зв'язками. І вже в 1902 році він отримав неспростовні докази існування пептидного зв'язку, а до 1905 року розробив загальний метод, за допомогою якого стало можливим синтезувати пептиди в лабораторних умовах. Поступово вчені вивчали будову різних сполук, розробляли методи розділення полімерних молекул на мономери, синтезували все більше і більше пептидів. У 1953 році Венсан дю Віньо синтезував окситоцин, перший поліпептидний гормон. У 1963 році, на основі концепції твердофазного пептидного синтезу (P. Мерріфілд) були створені автоматичні синтезатори пептидів. Використання методів синтезу поліпептидів дозволило отримати синтетичний інсулін і деякі ферменти. Сьогодні відомо понад 1500 видів пептидів, визначено їх властивості та розроблено методи синтезу.
