
- •Міністерство освіти і науки україни
- •Реферат
- •Розділ 1 огляд літератури
- •Класифікація захворювань, що вражають рослинні організми
- •1.2.Загальна характеристика фітопатогенних бактерій та факторів вірулентності
- •1.3. Типи патологічних змін у рослин, викликані бактеріями
- •1.4. Взаємовідносини фітопатогенних бактерій з рослинами-господарями та зовнішнім середовищем
- •1.5. Розповсюдження фітопатогенних бактерій
- •1.6. Біологія фітопатогенних бактерій
- •1.7. Фітопатогенні мікоплазми
- •Розділ 2 матеріали та методи досліджень
- •Розділ 3 результати досліджень та їх обговорення
- •Обстеження плодових культур на виявлення карантинних бактеріальних захворювань в Закарпатській області(2007-2013рр.)
- •Результати обстежень плодових культур на виявлення карантинних об’єктів в Берегівському районі
- •Висновки
- •Resume Bacterial diseases of fruit crops in Transcarpathian region
- •Резюме Бактеріальні хвороби плодових культур Закарпатської області
- •Список використаних джерел
- •Чалбаш Наталія Володимирівна «бактеріальні хвороби плодових культур закарпатської області»
Розділ 2 матеріали та методи досліджень
Рослинний матеріал для досліджень відбирали у багаторічних насадженнях Закарпатської області протягом 2010 – 2014 рр. Відбір зразків із симптомами бактеріального ураження органів дерев проводили в різні періоди вегетації – навесні (період цвітіння), влітку (інтенсивний ріст пагонів) та восени.
Виділення патогена. Висновок про природу патогена не можна зробити виходячи тільки з симптомів захворювання. Одні й ті ж або подібні симптоми можуть бути викликані видами мікроорганізмів, які часто дуже далекі один від одного в систематичному відношенні. Майже однотипні симптоми спостерігаються, наприклад, при бактеріозах квасолі, викликаних трьома різними організмами (Р.phaseolicola, Х.phaseoli і Х.рhаseolivar. fuscans). При встановленні діагнозу хвороби недостатньо одного лише уявлення про характер її симптомів. Для цього необхідно виділити і ідентифікувати збудника, і переконатися в патогенних властивостях ізольованої культури [19].
Найбільш доцільно дотримуватись постулатів Коха, які з невеликими змінами можуть бути використані при вивченні фітопатогепних мікроорганізмів.
1. Встановити наявність бактерії в ураженій тканині рослини після її мікроскопування.
2. Виділити бактерії в чисту культуру.
3. Провести зараження сприйнятливої рослини-хазяїна з метою одержання вихідних симптомів.
4 . Реізолювати бактерії з інокульованої тканини.
5. Порівняти вихідну і реізольовану бактеріальну культури і ідентифікувати бактерії.
При зборі зараженого матеріалу необхідно вжити заходів для подальшого успішного виділення бактерій. З практики добре відомо, що рослини, взяті з полів для дослідження причини їх захворювання, зазвичай сильно вражені. Виділення патогена з таких рослин досить складне або взагалі неможливе через заселення їх тканин вторинною сапрофітною мікрофлорою. Бактерії можна виділити значно успішніше зі свіжого рослинного матеріалу, на якому є первинні симптоми ураження. Мішечки з пластику непридатні для транспортування і зберігання уражених матеріалів через небезпеку розмноження в закритому і вологому середовищі постійно присутніх на матеріалі сапрофітів. Сухий матеріал більш придатний для виділення збудника, ніж вологий. Зразка для лабораторних досліджень слід перевозити і зберігати між двома шарами паперу [19].
У процесі вивчення уражених листків не рекомендується використовувати хімічні засоби для їх поверхневої стерилізації, так як ці речовини можуть легко дифундувати в тканині листа і вбити бактеріальні клітини. Для поверхневої дезінфекції матеріалу найбільш підходящим є розчин гіпохлоріта або іншого дезінфектанта. Найбільш поширений метод занурення матеріалу в 0,5 %-вий розчин хлорокса (Nа-гіпохлорита, розчин 1:9) на 2 хвилини, після чого матеріал ретельно промивають дистильованою водою і продовжують вивчення. При дослідженні листя найкраще промити їх поверхню проточною водопровідною водою.
Процес виділення збудника хвороби з листя полягає в наступному: частини ураженого листка разом зі здоровою тканиною вирізають стерильним ножем і поміщають на поверхню передметного скла, попередньо простерилізованого в полум'ї горілки. На поверхню предметного скла наносять одну краплю стерильної водопровідної або пептонної води і гострою бритвою роблять кілька зрізів листа в області ураження. Через 1-2 хв. бактерії почнуть дифундувати з ураженої тканини в пептонну воду. Препарат покривають покривним склом і вивчають під мікроскопом при збільшенні не менше 400 разів. Найкраще працювати із збільшенням 800-1500 разів [19].
На місці зрізу можна спостерігати невелику хмарку бактерій, що дифундують з пораженої тканини в зовнішнє середовище. Для їх детального розгляду можна використовувати масляну іммерсію або фазовий контраст. Опис цих методів можна знайти в будь-якому керівництві по мікробіології.
Можливість використовувати зрізи особливо важлива при вивченні уражень судинних пучків, захворювань стебла і провідних судин, коли досліджують ту частину, на якій помітні первісні симптоми захворювання. Уражені стебла ріжуть на частини довжиною 3-4 см, розщеплюють в довжину, і судинні пучки мацеруються. З більш мясистих стебел, коріння або бульб бактерії легко виділяють, здавивши пальцями уражені тканини так, щоб бактерії вийшли назовні разом з соком.
З пухлин і тканин ксилеми бактерії виділяють таким чином: невеликий шматочок ксилеми, промитої з поверхні, занурюють у спирт і підпалюють його. Спирт горить 1-2 сек., після чого поверхність стає стерильною. Для поверхневої стерилізації можна використовувати також 0,5%-вий розчин Хлорокса. Бактеріальний препарат з мацерованої знебарвленої тканини або живої тканини готовий для дослідження.
Аналогічні методи стерилізації та виділення патогена можуть бути використані при вивченні тих уражень, збудник яких знаходиться під насіннєвою оболонкою (наприклад, при захворюваннях квасолі). Якщо ж патоген поселяється па поверхні насіннєвої оболонки (при захворюваннях гороху або томатів), то проводити поверхневу стерилізацію не можна [19].
Мікроскопічне дослідження ураженої рослини.
Дослідження бактеріальних уражень рослин під микроскопом не дає достатньої інформації. Часто подібне вивчення рослинного матеріалу не дозволяє навіть визначити, чи є дане захворювання бактеріальним за походженням. Причина цього полягає в тому, що при такому дослідженні бактеріальні клітини часто можна сплутати з окремими клітинами рослини, зернами крохмалю і хлорофілу. Бактеріальні клітини, що містяться в рослині, часто не мають навіть тієї форми, яка притаманна їм при культивуванні на штучних поживних середовищах. Вони меншого розміру і неправильної палочковидної форми. Бактерії , що виявляються в препаратах зі старих плям виразки, втрачають свою рухливість. Значно легше вивчати бактерії з молодих уражених ділянок листка. На пізніх стадіях розвитку захворювання мікроскопічну картину дуже спотворює присутність сапрофітних мікроорганізмів, оскільки під мікроскопом їх неможливо відрізнити від фітопатогенних. Тому мікроскопічне дослідження служить лише для отримання загальної інформації про причину захворювання. Таке вивчення набуває значно важливіше значення при фарбуванні тканин, коли бактерії стають різко відмінними за забарвленням від здорових і уражених тканин рослини [16].
Мікроскопічне дослідження уражених тканин з використанням забарвлених зрізів (диференційне фарбування). При вивченні деяких зразків ураженого рослинного матеріалу, таких як стебло або шкірястий листок, зрізи можна приготувати, використовуючи гостру бритву. Тонкі зрізи готують з уражених тканин рослини, укладаючи їх між шматочками писушеної серцевини рослини бузини. Перед використанням край бритви змочують спиртом і отримані зрізи поміщають у воду. Метод диференційного фарбування по Стоутону:
Фарбування карболтіоніном 5 хв (0,1г тіоніна синього на 100мл 5%ного фенолу, що містить дистильовану воду).
Промивання у воді.
3. Перенесення в 95%-ний спирт.
4. Диференційне фарбування Оранжем G на протязі кількох хвилин. (Оранж G розчинений в абсолютному спирті.)
5. Промивання тканин абсолютним спиртом [19].
6. Після перенесення в ксилол зріз накривають покривним склом і поміщують в бальзам.
У готовому забарвленому препараті бактеріальніклітини темно-синього кольору, стінки клітин целюлози – жовті або зелені, лігніфіковані тканини – світло-сині [19].
Отримання чистих культур. Виділення патогeнів проводять на щільних середовищах. Після розливу їх і застигання в чашках Петрі чашки слід деякий час підсушити перед посівом бактерій. Це сприяє виділенню конденсаційної вологи, яка осідає на поверхні середовищ. Ці краплі конденсату не дають можливості отримати ізольовані колонії, так як бактерії плавають в них. Поверхня чашок Петрі з агаром підсушується 30 хв. при 50°С. Металевою петлею бактерії наносять штрихом на поверхню агару в чашках. На стерильному предметному склі готують суспепзію бактерій із заражених рослинних тканин.
Для отримання ізольованих колоній бактеріальну суспензію найкраще наносити штрихом. Спочатку петлю занурюють у суспензії бактерій і на поверхні чашки Петрі зліва направо наносять 5 штрихів. Потім петлю вносять в помум’я пальника і, повернувши чашку на 90°, роблять зправа на ліво ще 5 штрихів. Потім чашку знову повертають праворуч на 90° і роблять штрихи справа наліво. При цьому досягається таке разведеня суспензії, при якому виростають окремі колонії бактерій. Після 48-72год інкубації при 28°С різні типи колоній переносять в пробірки зі скошеним агаром. При вивченні бактеріальних культур, ізольованих з уражених рослинних тканин, звичайно досліджують морфологію клітин і колоній, біохімічні і патологічні методи [19].
Ідентифікація патогенна. Через морфологічні особливості бактерій для їх вивчення не завжди можуть бути використані методи, що застосовуються в мікології. Оскільки визначення грибів і вищих рослин основане на їх морфолог них ознаках, незначні морфологічні відмінності між окремими видами бактерій роблять можливим використанням цих же методів у мікробіoлогії. Деякі фітопатогенні бактерії настільки схожі, що їх не можна розрізнити, використовуючи тільки класичні методи ідентифікації. Для визначення патогенних бактерій використовують наступні критерії:
тест на патотснность для відбору патогенного ізолята;
вивчення морфології бактеріальної клітини і колонії;
визначення фізіологічних і біохімічних властивостей бактерій;
дослідження патогенності для визначення кола господарів [8].
Тест на патогенність для відбору патогенного ізолята. Найкраще спочатку виконати просте і швидке дослідження патогенності бактерій, так як згодом потрібно вивчати біохімію лише тих культур, патогенність яких доведена. Визначити патогенність культури можна протягом 24год, використовуючи метод інфікації Клемента. Він грунтується на реакції надчутливості рослин.
Культури бактерій, отримані після ізоляції, беруться з чашок і суспендується в стерильній водопровідній воді. Число бактеріальних клітин в 1мл такої суспензії, яке визначається за показником оптичної щільності, має становити 107-8. Шприцом суспензію вводять в міжклітинний простір здорового невідділеного листка тютюну. Цей метод дозволяє вводити кілька суспензій в різні ділянки одного і того ж листа тютюну.
Оскільки некрози або інші симптоми ураження на тютюні можуть викликатися тільки фітопатогенними бактеріями (не сапрофітами), то цей метод можна застосувати для швидкого відбору патогенного ізолята. Вивчати слід лише той ізолят, який індукує некрози на індикаторній рослині [19].
Зберігання бактеріальних культур. Зазвичай фітопатогенні бактерії зберігають свою вірулентність в лабораторних умовах тривалий час, але деякі види втрачають життєздатність відносно швидко. Псевдомонади залишаються життєздатними протягом багатьох місяців без пересіву, в той час як ксантомонади гинуть протягом 1-2 тижнів при рості на звичайних і використовуваних бактеріальних середовищах [19].
Методика діагностики опіку плодових Erwinia amylovora. Прискорена діагностика опіку плодових Erwinia amylovora.
Перший день:
А) Попередня діагностика Е. amylovora шляхом постановки реакції преципітації без виділення збудника:
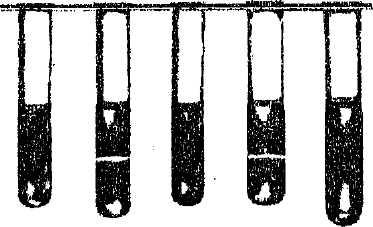
Рис 2.1. Кільця преципітації у 2-й та 4-й пробірках [8]
1. Стерильним скальпелем на межі ураженої і здорової кори роблять зрізи, добре подрібнюють і кладуть 1 грам в пробірку з 10 мл фізрозчину, який містить 5% сахарози;
2. Ставлять в термостат на 1 годину;
3. Частину приготовленої суміші кип'ятять протягом 30 хвилин;
4. Охолоджують і відбирають 1 мл екстракту, добавляють 0,5 мл нор-мальної кролячої сироватки;
5. Витримують в термостаті протягом 30 хв. при температурі 37°С і центрифугують 5 хв. при 3000 обертів.
6. В преципітаційні пробірки вносять: в одну 0,25 мл нормальної, в другу - 0,25 мл імунної до Е. amylovora сироватки крові кролика;
7. Із центрифугату обережно набирають надосадову рідину пастерівсь-кою піпеткою і обережно нашаровують її спочатку на поверхню нормальної, а потім імунної сироватки в преципітаційних пробірках. Облік реакції проводять через 30 хв., 2 години, 4 години (рис 2.1) [8].
Б) Зараження незрілих плодів груші чутливих сортів до Erwinia amylovora екстрактом з кори зразків: з некип'яченого екстракту, підготов-леного раніше для реакції кільцепреципітації, шприцом відбирають 0,5 мл рідини, нею інфікують попередньо вимиті і протерті 5% розчином перекису водню плоди груші і ставлять їх у вологу камеру при температурі 27°С. Облік проводять через 24,48 і 72 години.
При позитивній реакції спостерігається утворення на поверхні плода білої рідини (рис 2.2).

Рис. 2.2. Позитивна реакція Уайта
(виділення молочно-білого ексудату)[8]
В) Виділення бактерій на середовища:
З цього ж екстракту роблять висів бактерій на середовище Кінга та картопляний агар з дріжджовим екстрактом. Облік проводять через 24, 36,48 годин[4].
Другий день:
При наявності на середовищі Кінга нефлюорисцируючих слизистих колоній проводять їх відбір і сіють на селективні середовища Б3 та Кросса і Гурмана.
Облік характеру росту проводять через 24, 48, 60 годин. Колонії Erwinia amylovora на середовищі 03 мають оранжеве забарвлення, колонії інших видів набувають голубого або зеленого кольору.
На середовищі Кроса і Гудмана бактерії Erwinia amylovora утворюють колонії з кратероподібним заглибленням по середині, що добре спостерігається під мікроскопом при збільшенні 15х або 30" [8].
Склад поживних середовищ для ізоляції та ідентифікації
Картопляний агар з дріжджовим екстрактом
Картопля - 200 г
Агар-агар - 20 г
Дріжджовий екстракт – 10 мл
Водопровідна вода – 1000 мл
рН – 7,0 [8].
