- •1 Тема Свойства и строение конструкционных материалов
- •1.Цель дисциплины
- •2.Значение сварки в строительстве
- •3.Атомно-кристаллическое строение металлов
- •4.Металлическая связь и ее природа
- •5.Основные типы кристаллических решеток металла и их характеристики
- •6.Процессы плавления и кристаллизации металлов
- •6.Процессы плавления и кристаллизации металлов
- •7.Особенности жидкого состояния металлов
- •8.Образование и рост зародышей при кристаллизации
- •9.Термические кривые охлаждения и кристаллизации
- •10.Понятие о температуре ликвидус и солидус
- •11. Величина зерна
- •12. Основы теории сплавов
- •13. Диаграмма состояния системы железо-углерод: компоненты, фазы и структурные составляющие в сплавах железа с углеродом
- •14. Классификация железо-углеродистых сплавов по структуре (стали, чугуны)
- •15. Влияние углерода и постоянных примесей на структуру и свойства стали
- •16. Классификация и маркировка углеродистых и легированных сталей по химическому составу, назначению и качеству
- •2 Тема Основы теории и технологии термической обработки металлов
- •3.Рост зерна аустенита
- •4.Переохлаждение аустенита
- •5. Механизм перлитного превращения
- •6. Продукты распада аустенита, их строение и свойства
- •9.Закалка стали
- •В зависимости от требуемой температуры отпуск производится :
- •11. Виды и назначение отпуска
- •12.Стали для металлических конструкций и закладных деталей (горячекатаная, термически упрочненная, холоднодеформированная)
- •13.Проволочная арматурная сталь
- •14. Эффективность использования термически упрочненной арматуры в строительстве
- •3 Тема Классификация способов сварки
- •1.Сущность и классификация способов сварки плавлением, применяемых при изготовлении и монтаже строительных конструкций
- •2.Сварочная дуга, газовое пламя как источник тепла при сварке, тепловые процессы при сварке.
- •3.Преимущества и недостатки ручной, механизированной и автоматизированной дуговой сварки (рдс, под флюсом, в защитных газах, порошковой проволокой)
- •4 Тема Сварные соединения
- •5 Тема Технологические характеристики основных способов сварки наплавлением
- •Насыпная масса флюса и гранулометрический состав влияют на форму шва.
- •4.Электрошлаковая сварка
- •6.Технологические особенности cварки различных металлов и сплавов
- •7.Сварка углеродистых и легированных сталей
- •8. Сварка алюминия и его сплавов
- •9. Сварка титана и его сплавов
- •10.Сварка меди
- •11.Наплавка
- •12.Охрана труда при проведении сварочных работ
- •2.Стыковая сварка арматурных стержней.
- •3.Технология дуговой сварки каркасов, закладных деталей.
- •8 Тема Дефекты сварных соединений
- •1.Дефекты сварных соединений.
4.Металлическая связь и ее природа
Главной особенностью всех существующих металлов является их достаточно высокая электропроводность и теплопроводность. Благодаря таким свойствам, валентные электроны могут легко перемещаться в кристаллической решетке. Самую простую модель строения металла можно представить в следующем виде: в узлах кристаллической решетки расположены положительные ионы, которые тесно связаны электронным газом.Валентные электроны расположены одновременно на всех орбиталях атомов, даже соседних, таким образом, осуществляя между ними связь. Такую связь принято называть металлической. Она считается довольно прочной, потому что большая часть металлов имеет значительно высокую температуру плавления. Благодаря таким свойствам, у металлов повышается ковкость и пластичность. Ковкость - это способность расплющиваться в более тонкие листы, а пластичность - это способность металлов вытягиваться в длинную проволоку.Данные свойства объясняются возможностью подвижного электронного газа плоскостям, которые состоят из положительных ионов, без труда скользить друг по другу. Более подробное объяснение металлической связи позволяет увидеть метод молекулярных орбиталей. Как правило, в результате процесса образуются две орбитали: связывающая и разрыхляющая.
5.Основные типы кристаллических решеток металла и их характеристики
Есть три типа элементарных ячеек кристаллических решеток: объемноцентрированная кубическая (ОЦК),гранецентрированная кубическая (ГЦК) , гексагональная плотноупакованная (ГП).
схемы упаковки атомов: В кубической гранецентрированной решетке (ГЦК; А1) атомы расположены в вершинах куба и в центре каждой грани,В кубической объемноцентрированной решетке (ОЦК; А2) атомы расположены в вершинах куба, а один атом — в центре его объема, В гексагональной плотноупакованной решетке (ГП; А3) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома - в средней плоскости призмы. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности.
а)
гранецентрированная кубическая (ГЦК);
б) объемноцентрированная кубическая
(ОЦК);
в) гексагональная плотноупакованная
(ГП) решетка
6.Процессы плавления и кристаллизации металлов
Все металлы могут находиться в твердом, жидком или в газообразном состояниях. Переход из твердого состояния в жидкое происходит при определенной температуре плавления, переход из жидкого состояния в газообразное происходит при температуре кипения. Эти температуры зависят от давления. Температура плавления является одной из важнейших характеристик металла.
Кристаллизация – процесс фазового переходавещества из жидкого состояния в твёрдое кристаллическое с образованиемкристаллов.
Плавление твердого тела при его нагревании и обратный процесс кристаллизации жидкости при ее охлаждении относятся к явлениям, называемым фазовыми переходами 1 рода. Для фазового перехода 1 рода характерно изменение скачком термодинамических параметров вещества (плотность, теплоемкость, вязкость и т. п. ). При этом выделяется или поглощается определенное для данного вещества количество теплоты, называемое теплотой фазового перехода. Рассмотрим, как изменяется температура вещества при его плавлении и кристаллизации. Пусть к твердому телу подводится тепло с такой постоянной
скоростью,
что температура во всем объеме образца
успевает выравниваться и ее можно
считать одинаковой для всех точек тела.
Примерный график зависимости температуры
тела от времени при нагреве изображен
на рис. 1.а.В силу постоянства теплового
потока ось времени есть одновременно
и ось"тепла, поглощенного веществом".
На участке 1'−1 тепло подвод приводит к
монотонному росту температуры. На
участке 1−2 температура неизменна,
несмотря на то, что подвод тепла
продолжается. Затем температура тела
снова начинает повышаться (участок
2−2'). Температура, соответствующая
участку 1−2, есть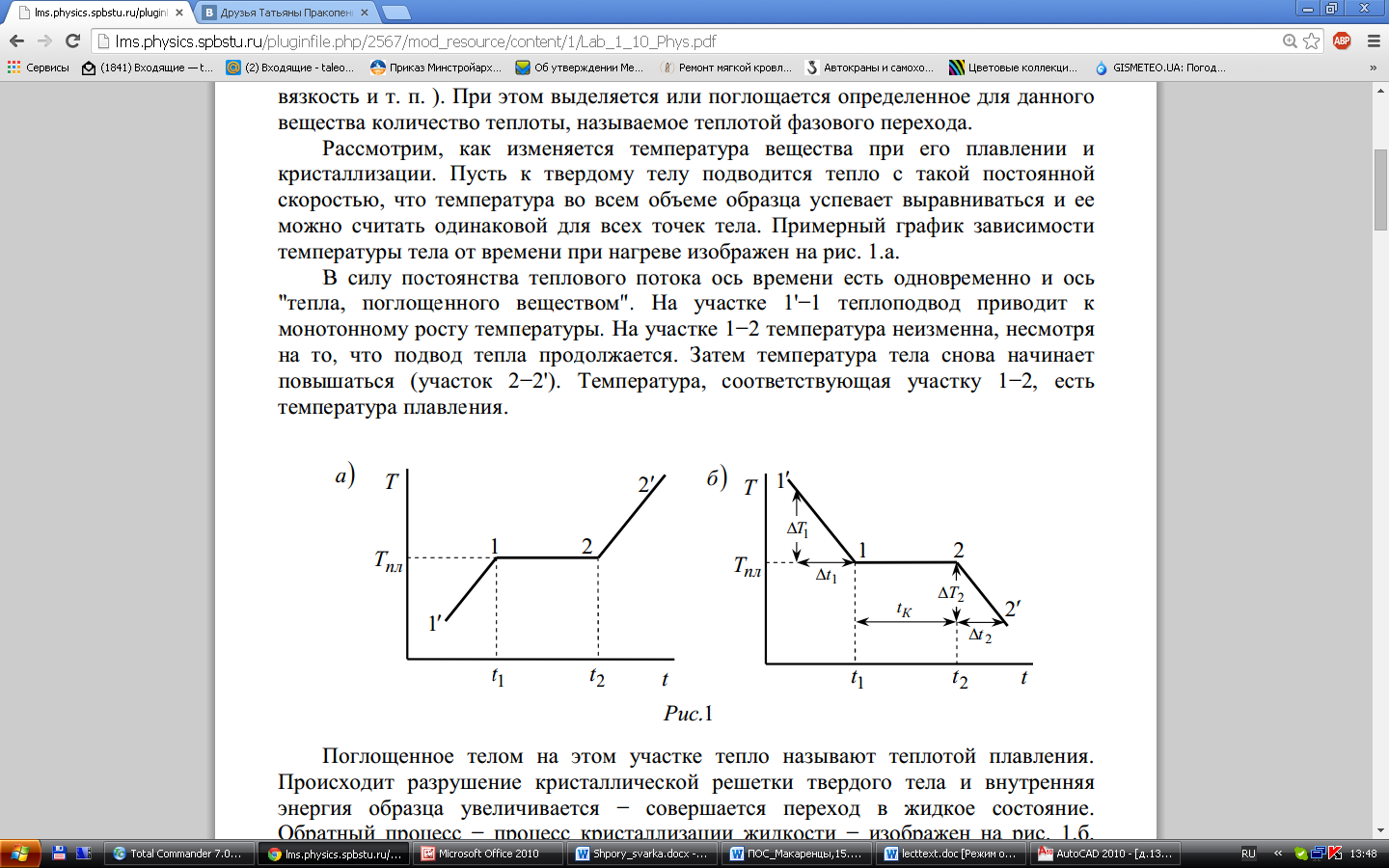
температура плавления.
Поглощенное телом на этом участке тепло называют теплотой плавления.
Происходит разрушение кристаллической решетки твердого тела и внутренняя
энергия образца увеличивается − совершается переход в жидкое состояние.
Обратный процесс − процесс кристаллизации жидкости − изображен на рис. 1.б.
Здесь тепло отводится, тепловой поток, следовательно, отрицателен (по-прежнему
полагается постоянным). Из-за теплоотвода температура жидкости на участке 1'−1
монотонно снижается. На участке 1–2 температура неизменна (температура кристаллизации). Теплоотвод на этом участке компенсируется выделяющейся теплотой кристаллизации. После завершения кристаллизации температура тела(теперь уже твердого) начинает вновь понижаться (участок 2−2').Процессы плавления и кристаллизации идут практически при одной и той же температуре, а теплоты плавления и кристаллизации одинаковы. Жидкое и твердое состояния называют двумя разными фазами вещества, а процессы плавления и кристаллизации − фазовыми переходами. Новая фазане возникает сразу во всем объеме; сначала образуются зародыши новой фазы, которые затем растут, распространяясь на весь объем. При этом обе фазы могут сосуществовать длительное время (например, лед может плавать в воде, не плавясь). Указанные особенности плавления и кристаллизации(выделение и поглощение энергии, возможность сосуществования фаз) и являются отличительными признаками фазового перехода первого рода. Диаграммы, подобные изображенным на рис.1, можно использовать для измерения температуры и теплоты плавления (кристаллизации). Для снятия диаграммы тонкостенный сосуд (тигель) с исследуемым веществом(образцом) помещают в печь и, нагревая его, измеряют температуру образца через определенные промежутки времени. Можно снимать и диаграмму остывания и кристаллизации образца. В этом случае проще обеспечить постоянство теплового потока, отводимого от тела. Тепловой поток можно вычислить по изменению внутренней энергии тела (образец + тигель) на участках 1'−1 и 2'−2.