
- •37. Искусственная радиоактивность.
- •38. Ядерные реакции.
- •39. Теория химического строения.
- •40. Ковалентная связь.
- •41. Метод валентных связей.
- •42. Неполярная и полярная ковалентная связь.
- •43. Способы выражения ковалентной связи.
- •44. Направленность ковалентной связи.
- •45. Гибридизация атомных электронных орбиталей.
- •46. Ионная связь.
- •47. Водородная связь.
- •48. Межмолекулярное взаимодействие.
- •49. Превращение энергии при химических реакциях.
- •50. Термохимия.
- •51. Скорость химической реакции.
- •61.Способы выражения состава растворов
- •62. Особенности растворов солей кислот и оснований
- •63. Теория электролитической диссоциации
- •64.Степнь диссоциации
- •65. Сила электролитов
- •66.Константа диссоциации
- •67.Сильные электролиты
- •68. Свойства кислот солей и оснований с точки зрения теории электролитической диссоциации
- •69.Произведение растворимости
- •70. Диссоциация воды
- •71. Водородный показатель
- •72. Гидролиз солей
- •73. Окислительно-восстановительные реакции
- •74. Составление уравнений окислительно-восстановительных реакций
- •75. Важнейшие окислители и восстановители
- •76. Окислительно-восстановительная двойственность
- •77. Внутримолекулярное окисление-восстановление
- •78.Электролиз
- •79.Электрохимические процессы.
- •80. Электролиз водных растворов и расплавов
74. Составление уравнений окислительно-восстановительных реакций
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций.
В метод электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Расставить коэффициенты в реакции, схема которой:
HCl
+ MnO2
![]() Cl2 + MnCl2 + H2O
Cl2 + MnCl2 + H2O
1.Указываем степени окисления химических элементов.
![]()
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
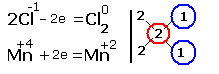
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1.
Перед HCl коэффициент
2 не ставим, а считаем число атомов хлора
в продуктах реакции. Оно равно -
4.Следовательно и перед HCl ставим -
4,уравниваем число атомов водорода и
кислорода справа, поставив перед H2O
коэффициент - 2. В результате получится
химическое уравнение:
![]()
Метод полуреакции применяется для составления уравнения ОВР, протекающих в растворах.
75. Важнейшие окислители и восстановители
Важнейшие окислители
1. Неметаллы. Окислительная способность неметаллов увеличивается в ряду: P, Se, At, I, S, Вr, N, Сl, О, F.
Самыми сильными окислителями среди неметаллов являются галогены(F2, Cl2, Br2, I2) и кислород
2. Cлoжные иoны и мoлeкулы, сoдeржaщиe aтoмы нeмeтaллa в выcшeй и прoмeжутoчнoй степенях окисления.
Ceрнaя киcлотa H2SO4 прoявляeт окислительные свoйcтвa в кoнцeнтрирoвaннoм рacтвoрe зa счeт aтoмa сeры в степени окисления +6:
C(грaфит) + 2H2SO4 (конц) = СO2 + 2SO2 + 2H2O.
4. Положительно заряженные ионы металлов с относительно высоким зарядом (Fe3+, Cu2+, Sn4+, Ag+ и др.). Принимая электроны они восстанавливаются до металлического состояния 2Al + 3CuCl2 = 2AlCl3 + 3Cu
6. Пероксид водорода проявляет свойства сильного окислителя. В процессе восстановления кислород понижает свою степень окисления от –1 до –2:
H4TiO4 + H2O2 = H4TiO5 + H2O
Важнейшие восстановители
1. Металлы. К типичным восстановителям относятся активные щeлoчныe и щeлoчнo-зeмeльныe мeтaллы, цинк, алюминий, жeлeзo и др.
Zn + 2HCl = ZnCl2 + H2
2.Неметаллы (B, Si, As, C, H, Te)
C + 4HNO3(конц, гор) = CO2 + 4NO2 + 2H2O
3. Восстановительными свойствами oблaдaют бecкиcлoрoдныe aниoны, такие как Сl-, Вr-, I-, S2-, Н-, и кaтиoны мeтaллoв в низшей степени окисления.
4. Сложные молекулы и ионы, содержащие атомы элементов в промежуточных степенях окисления (SO2, CO, NO, SO2 , NO2 и др.).
76. Окислительно-восстановительная двойственность
Соединения высшей степени окисленности, присущей данному элементу, могут в окислительновосстановительных реакциях выступать только в качестве окислителей, степень окисленности элемента может в этом случае только понижаться. Соединения низшей степени окисленности могут быть, наоборот, только восстановителями; здесь степень окисленности элемента может только повышаться. Если же элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью-способностью вступать в реакции как с окислителями, так и с восстановителями.
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции: 2HNO3+H2S=2NO+S+2H2O
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
