
- •37. Искусственная радиоактивность.
- •38. Ядерные реакции.
- •39. Теория химического строения.
- •40. Ковалентная связь.
- •41. Метод валентных связей.
- •42. Неполярная и полярная ковалентная связь.
- •43. Способы выражения ковалентной связи.
- •44. Направленность ковалентной связи.
- •45. Гибридизация атомных электронных орбиталей.
- •46. Ионная связь.
- •47. Водородная связь.
- •48. Межмолекулярное взаимодействие.
- •49. Превращение энергии при химических реакциях.
- •50. Термохимия.
- •51. Скорость химической реакции.
- •61.Способы выражения состава растворов
- •62. Особенности растворов солей кислот и оснований
- •63. Теория электролитической диссоциации
- •64.Степнь диссоциации
- •65. Сила электролитов
- •66.Константа диссоциации
- •67.Сильные электролиты
- •68. Свойства кислот солей и оснований с точки зрения теории электролитической диссоциации
- •69.Произведение растворимости
- •70. Диссоциация воды
- •71. Водородный показатель
- •72. Гидролиз солей
- •73. Окислительно-восстановительные реакции
- •74. Составление уравнений окислительно-восстановительных реакций
- •75. Важнейшие окислители и восстановители
- •76. Окислительно-восстановительная двойственность
- •77. Внутримолекулярное окисление-восстановление
- •78.Электролиз
- •79.Электрохимические процессы.
- •80. Электролиз водных растворов и расплавов
янЗакон сохр массы-Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Атомно-молекулярное учение разработал М.В. Ломоносовв 1741 г. Основные положения закона:
1) все вещества состоят из «корпускул» (молекул);
2) молекулы состоят из «элементов» (атомов);
3) частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц;
4) молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из различных атомов. Атомно-молекулярное учение окончательно утвердилось в 1860 г.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента , в отличие от сложных веществ. В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Менделеева.
Закон постоянства состава — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов
Закон кратных отношений — один из стехиометрических законов химии: если два элемента образуют друг с другом более одного соединения, то массы одного из элементов, приходящиеся на одну и ту же массу другого элемента,
относятся как целые числа, обычно небольшие.
Закон обьёмных отношен объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как целые числа.
Атомная масса элемента — есть отношение массы его атома к 1/12 части массы атома 12С
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). Молекуля́рная ма́сса масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе.
Моль – это единица количества вещества. Это такое количество вещества (или его порция), которое содержит 6,02 · 1023 частиц (молекул, атомов или других частиц)
Закон Авагадро в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул
Моль – это единица количества вещества. Это такое количество вещества (или его порция), которое содержит 6,02 · 1023 частиц (молекул, атомов или других частиц)
Эквивалент- это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях
закон эквивалентов: все вещества реагируют в эквивалентных отношениях. Валентностью называется свойство атомов данного элемента присоединять или замещать в соединении определенное число атомов другого элемента
Закон Авогадро позволяет определить число атомов, входящих в состав молекул простых газов. Путем изучения объемных отношений при реакциях, в которых участвуют водород, кислород, азот и хлор, было установлено, что молекулы этих газов двухатомны. Следовательно, определив относительную молекулярную массу любого из этих газов и разделив ее пополам, можно было сразу найти относительную атомную массу соответствующего элемента. Например, установили, что молекулярная масса хлора равна 70,90; отсюда атомная масса хлора равняется или 35,45.
Вале́нтность способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Внутр.э-это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотсодержащие и т. д.), либо по химическим свойствам, т. е. по функциям (кислотно-основным, окислительно-восстановительным и т. д.), которые эти вещества осуществляют в химических реакциях, — по их функциональным признакам.
Периодический закон Д.И. Менделеева свойствапростых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса»
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Значение периодической системы. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов- это сложные ионы (NО3-, SO2-4, РОЗ-4и т.д.).
Радиоактивность-самопроизвольное (спонтанное) превращение неустойчивого изотопа химического элемента в другой изотоп (обычно - изотоп другого элемента).
Ядерная модель атома. Э. Резерфорд предложил модель атома, по которой в центре атома расположено положительно заряженное ядро диаметром порядка 1015 м, в котором сосредоточена почти вся масса атома. Вокруг ядра, вращаются электроны. Так как атом в обычном состоянии электронейтрален, то суммарный заряд электронов равен по модулю заряду ядра.
Квантовая теория светаатомы всегда излучают или принимают лучевую энергию только порциями, прерывно, а именно определенными квантами (кванты энергии),
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов. а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода:
 (на
схеме электроны обозначены
точками).
б) Ковалентная полярная связь образуется
между атомами различных неметаллов.
Схематично образование ковалентной
полярной связи в молекуле НС1 можно
изобразить так:
(на
схеме электроны обозначены
точками).
б) Ковалентная полярная связь образуется
между атомами различных неметаллов.
Схематично образование ковалентной
полярной связи в молекуле НС1 можно
изобразить так:
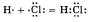
Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
энергетическое состояние электронов в атоме.
Главноеквантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное имагнитное квантовые числа, а также спин
Орбитальное квантовое число — в квантовой физике квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения
![]()
Является собственным значением оператора орбитального момента электрона, отличающегося от момента количества движенияэлектрона j лишь на оператор спина s:
![]()
Формы электронных облаков.форма электронного облака атома является следствием формы ядра атома. Источниками сил, связывающих атомы друг с другом, являются зоны перекрытия электронных облаков. Зоны перекрытия одновременно являются частью электронных облаков обоих соприкасающихся атомов. Чем больше зон перекрытия, тем крепче связь между атомами. Каждый электрон электронного облака на большей части своей траектории взаимодействует преимущественно с одним из протонов ядра, формируя часть электронного облака – электронный лепесток.
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0 Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
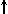 и
и 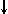 .
.СПИНОВОЕ КВАНТОВОЕ ЧИСЛО квантовое число, определяющее величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. еёсобств. (внутр.) момента кол-ва движения (момента импульса). Спиновый моментимпульса s квантуется: его квадрат определяется выражением
 ,
где s - С. к. ч. (называемое часто просто
спином). Проекция вектора sна произвольное
направлениеz также
квантуется: для частиц с
ненулевоймассой
,
где s - С. к. ч. (называемое часто просто
спином). Проекция вектора sна произвольное
направлениеz также
квантуется: для частиц с
ненулевоймассой 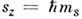 (гдеms - магнитное
спиновое число), т. е. принимает2s + 1
значений. Число s может
принимать целые, нулевые или
полуцелыезначения.
(гдеms - магнитное
спиновое число), т. е. принимает2s + 1
значений. Число s может
принимать целые, нулевые или
полуцелыезначения.Многоэлектронные атомы - В сложных атомах на данный электрон влияет не только ядро, но все остальные электроны. Каждый электрон отталкивается от всех остальных электронов в соответствии с законом Кулона, а потому все волновые функции взаимозависимы. [2]Многоэлектронные атомы могут в особых случаях только отдаленно напоминать атом водорода, имея в слое данного квантового числа наборы орбиталей, отличающихся по энергиям, но имеющие недалекие по своему значению гмакс( рис. 2 - 5), а потому и заметно возмущающих друг друга. [3]Многоэлектронными атомами называются атомы с двумя и более электронамиМногоэлектронные атомы имеют целые наборы энергии ионизации.
При́нципПа́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественныхфермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Электронная структура атомов и периодическая система элементов— классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Состоит из групп и периодов. Период – горизонтальная совокупность элементов расположенных в порядке возрастания заряда ядра. Первые 3 периода – малые и состоят и S and P элементов. Остальные 4 периода – большие. В 4 и 5 периоде появляются Д элементы. В 6-7 Ф элементы. В пределах малых периодов свойства элемента изменяются резко, а в пределах больших периодов изменяются медленно. Группой называется совокупность элементов, расположенных в таблице вертикально, в порядке возрастания заряда ядра. В период таблице находится 8 групп т.к. на внешнем электроном уровне не может быть больше 8 валентных электронов. Каждая группа состоит из главной и побочной подгрупп. Состав главных входят S and P элементы, а в состав побочных D and F элементы. Атомные радиусы в периодах с увеличением заряда ядра уменьшаются, из-за сил кулоновского притяжения. В подгруппах же наоборот.
Энергия ионизации — представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома. На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;
мера проникающей способности этого электрона;
межэлектронное отталкивание среди наружных (валентных) электронов.
Сродство к электрону — количество энергии, выделяющееся при присоединении электрона к атому, молекуле пли радикалу. Сродство к электрону выражается обычно в электрон-вольтах. Значение величины Сродства к электрону важно для понимания природы химической связи и процессов образования отрицательных ионов. Чем больше Сродство к электрону, тем легче атом присоединяет электрон. Сродство атомов металлов к электрону равно нулю, у атомов неметаллов Сродство к электрону тем больше, чем ближе стоит элемент (неметалл) к инертному газу в периодической системе Д. И. Менделеева. Поэтому в пределах периода усиливаются неметаллические свойства по мере приближения к концу периода.
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несутположительный заряд.В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева : 168O, 178O, 188O — три стабильных изотопа кислорода.
Радиоактивные элементы и их распад.
Радиоактивный распад — спонтанное изменение состава нестабильных атомных ядер путём испускания элементарных частиц или ядерных фрагментов. Существуют альфа, бета и гамма распады. Соответственно они испускают альфа, бета и гамма частицы. Распад имеющий самую сильную проникающую способность, это гамма распад (не откланяются магнитным полем). Альфа – положительно заряженные частицы. Бета – отрицательно заряженные частицы.
Распад ядер радиоактивных элементов или изотопов может происходить тремя основными путями, и соответствующие реакции ядерного распада названы тремя первыми буквами греческого алфавита. При альфа-распаде выделяется атом гелия, состоящий из двух протонов и двух нейтронов, — его принято называть альфа-частицей. Поскольку альфа-распад влечет за собой понижение числа положительно заряженных протонов в атоме на два, ядро, испустившее альфа-частицу, превращается в ядро элемента, отстоящую на две позиции ниже от нее в периодической системе Менделеева. При бета-распаде ядро испускает электрон, а элемент продвигается на одну позицию вперед по периодической таблице (при этом, по существу, нейтрон превращается в протон с излучением этого самого электрона). Наконец, гамма-распад — это распад ядер с излучением фотонов высоких энергий, которые принято называть гамма-лучами. При этом ядро теряет энергию, но химический элемент не видоизменяется. Радиоактивный элемент — химический элемент, все изотопы которого радиоактивны.
37. Искусственная радиоактивность.
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции. Все три типа излучений — a, b и g, характерные для естественной радиоактивности,— испускаются также и искусственно-радиоактивными веществами. Однако среди искусственно-радиоактивных веществ часто встречается еще иной тип распада, не свойственный естественно-радиоактивным элементам. Это — распад с испусканием позитронов — частиц, обладающих массой электрона, но несущих -положительный заряд. По абсолютной величине заряды позитрона и электрона равны. Искусственно-радиоактивные вещества могут получаться при весьма разнообразных ядерных реакциях. Примером может служить реакция захвата нейтронов серебром. Для проведения такой реакции достаточно поместить пластинку серебра поблизости от источника нейтронов, окруженного парафином.
38. Ядерные реакции.
Ядерная реакция — процесс образования новых ядер или частиц при их столкновениях. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота, она была зафиксирована по появлению вторичных ионизирующих частиц, имеющих пробег в газе больше пробега α-частиц и идентифицированных как протоны. Впоследствии с помощью камеры Вильсона были получены фотографии этого процесса.
39. Теория химического строения.
У этой теории четыре положения: 1) Атомы в молекуле соединены в определённой последовательности в соответствии с их валентностью. Эта последовательность называется химическим строением. 2) Свойства вещества зависят не только от качественного и количественного состава молекулы, но и от её химического строения. Вещества, имеющие один и тот же состав, но разное строение, называются изомерами, а само их существование изомерией. 3) Атомы и группы атомов в молекуле взаимно влияют друг на друга непосредственно или посредством других атомов. 4) Строение вещества познаваемо, возможен синтез веществ с заданным строением. Бутлеров.1861 г.
40. Ковалентная связь.
Ковалентная связь — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Бывает полярной и неполярной. Важная характеристика ковалентной связи это её полярность. Если молекула состоит из 2 атомов, которые связаны полярной связью, то такая молекула – полярная молекула. Представляет собой диполь. Диполь – электро-нейтральная система в которой центры положительного и отрицательного заряда находятся на определённом расстоянии друг от друга. Полярность молекулы, количественно оценивается дипольным моментом, которые равен произведению длины диполя на значение эффективного заряда. Эффективный заряд = 1.6 * 10-19 Кл. Способность молекул и отдельных связей полиризоватся под влиянием внешнего электрического поля называется полиризуемостью. Способность атома участвовать в образовании ограниченного числа ковалентных связей, называется насыщаемостью ковалентной связи. Направленность ковалентной связи обуславливает пространственную структуру молекул, т.е. перекрывание электронных облаков. Происходит только при определённой взаимной ориентации орбиталей обеспечивающей наибольшую электронную плотность в области перекрывания.
