
Биофизика 02
.pdf

ПЕРЕДМОВА
Посібник складено відповідно до програми курсу ”Біофізика” для студентів НФАУ. До нього включено теоретичний матеріал, приклади розв’язання типових задач і питання тестового контролю по всіх розділах курсу. Даний посібник значно полегшить студентам самопідготовку за курсом ”Біофізика”.
Метою даного курсу є розгляд ряду питань, необхідних майбутнім провізорам при вивченні фармацевтичних дисциплін на старших курсах і в подальшій професійній діяльності. Особлива увага в навчальному посібнику приділена проблемам молекулярної біофізики, транспорту речовин і математичного моделювання фармакокінетичних процесів, що важливо як для наукової, так і практичної діяльності фармацевтів.
ФізикоFматематичні знання, необхідні для засвоєння матеріалу, викладеного в даному виданні, не виходять за рамки програми курсів фізики і вищої математики для фармацевтичних вузів і фармацевтичних факультетів медичних вузів. Так як «Біофізика» викладається на другому курсі, і студенти ще не володіють необхідними знаннями по біохімії, фізіології і фізичній хімії, то відсутні відомості по цих дисциплінах коротко викладені у відповідних розділах.
Автори висловлюють подяку старшому науковому співробітнику ДНЦЛЗ, кандидату хімічних наук Леоніду Вікторовичу Іванову за цінні поради при написанні розділів 4 та 5 і доценту кафедри фізики НФАУ, кандидату фізикоFматематичних наук Аркадію Вікторовичу Клочко за ряд істотних зауважень по всіх розділах рукопису.

ВСТУП
Біофізика вивчає фізикоFхімічні процеси, що протікають у біологічних системах, використовуючи для цього фізичні і математичні методи. Об’єктом вивчення біофізики є окремі молекули (молекулярна біофізика), клітини (біофізика клітини), а також органи, тканини, системи і взаємодія організму з навколишнім середовищем.
Зв’язок між біологією і фізикою був замічений дуже давно. Досить згадати досліди Гальвані і відкриття їм “тваринної електрики”. Подібні експерименти показали, що будьFякий біологічний закон і явище можна пояснити з погляду фізичних і хімічних закономірностей. Наслідком цього стало проникнення біофізики в усі області природничих наук. Зараз уже ні біологія, ні медицина, ні фармація не є чисто описовими науками. Тому ніяке наукове дослідження або практична робота в цих областях неможливі без залучення фізичних методів і математичного апарату.
Для вивчення біологічних систем біофізика сприяла впровадженню вже існуючих фізичних методів, а також розробці нових. Прикладом останніх є рентгеноструктурний аналіз, спеціально розроблений для вивчення біологічних макромолекул.
Біофізику прийнято відносити до біологічних наук. Однак через широке використання методів вищої математики, у фармацевтичних і медичних вузах її частіше усього вивчають невідривно від курсу фізики.
4

Розділ 1. ТЕРМОДИНАМIКА БIОЛОГIЧНИХ ПРОЦЕСIВ
Однією з умов нормального функціонування окремої клітини і цілого організму є підтримка сталості їхніх параметрів (концентрацій речовин, електричних потенціалів та ін.) і, у разі потреби, зміна їх у потрібному напрямку. Це вимагає обміну речовини та енергії з навколишнім середовищем, перетворення одних видів енергії в інші, як наприклад, у випадку процесів м’язового скорочення, передачі нервового імпульсу, зорового і слухового сприйняття тощо.
Термодинаміка вивчає макроскопічні процеси обміну і перетворення енергії в системі без урахування мікроскопічної будови тіл, що складають цю систему. Закони термодинаміки справедливі як для неживої, так і живої природи. В термодинаміці виділяють два розділи: класичну (рівноважну) і термодинаміку необоротних процесів (нерівноважну). Рівноважна термодинаміка розглядає в основному закриті системи, що знаходяться в термодинамічній рівновазі або прагнуть до нього. Біологічна система через її складність не може бути описана з використанням подібних наближень. Тому термодинаміка біологічних процесів використовує методи нерівноважної термодинаміки.
Процеси, що протікають у біосистемах, як і в будьFяких інших системах, необоротні (нерівноважні), тобто при переході системи з одного стану в інший, зворотний перехід у початковий стан неможливий без додаткового притоку енергії ззовні.
У термодинаміці розрізняють три види систем: ізольовані (не обмінюються з навколишнім середовищем ні речовиною, ні енергією), закриті (обмінюються з навколишнім середовищем енергією, але не речовиною) і відкриті (обмінюються з навколишнім середовищем і енергією, і речовиною). Кожна клітина і весь живий організм у цілому
— відкриті системи і лише в окремих частинах клітини є умови для існування закритих та ізольованих систем.
Фундаментальним поняттям класичної термодинаміки є рівноважний стан системи, у якому термодинамічні параметри (об’єм, тиск, температура і т.д.) мають однакове значення у всіх точках системи і не можуть змінюватися мимовільно в часі. Рівноважний стан для живого організму неприпустимий, тому що в цьому випадку неможливе проходження ніяких направлених процесів крім випадкових відхилень від положення рівноваги. Саме тому в термодинаміці біологічних процесів основним поняттям є стаціонарний стан системи. У стаціонарному стані параметри також не змінюються з часом, але можуть відрізнятися
5

в різних частинах системи, тобто в таких системах існують і постійно підтримуються градієнти параметрів. Це можливо тільки за рахунок притоку енергії або речовини з навколишнього середовища. Таким чином, у стаціонарному стані можуть знаходитися тільки відкриті і закриті системи.
Розглянемо стаціонарний стан системи на прикладі іонного балансу клітини. Концентрація іонів калію усередині клітин теплокровних у 15–50 разів вища, чим зовні, а концентрація іонів натрію в 10–15 разів нижча. Різниця концентрацій К+ підтримується наявністю негативного потенціалу на внутрішній стороні мембрани, що перешкоджає виходові катіонів із клітини. Це, а також градієнт концентрацій, сприяє просочуванню іонів натрію усередину, незважаючи на низьку проникність для них цитоплазматичної мембрани. Підтримка різниці концентрацій Na+ вимагає витрат енергії. Іони натрію викачуються з клітини Na+,K+Fнасосами, які працюють за рахунок енергії, що виділяється при гідролізі АТФ. Енергія однієї молекули АТФ використовується для виводу з клітини 3Na+ і введення 2К+.
Варто мати на увазі, що живий організм не перебуває в незмінному вигляді і тому в цілому є не стаціонарною системою. Однак протягом невеликого проміжку часу стан деяких його ділянок приймають за стаціонарний.
§ 1. Перший закон термодинаміки для біологічних систем
Перший закон термодинаміки має вигляд:
δQ = dU ± δA ,
де Q — кількість теплоти, отримана системою; U — внутрішня енергія системи; A — робота (якщо робота здійснюється над системою, то δA >0, якщо робота здійснюється самою системою, то δA <0). Внутрішня енергія є функцією стану, тобто її зміна при переході системи з одного стану в інший визначається значеннями параметрів початкового і кінцевого станів і не залежить від того, яким способом відбувається цей перехід. Символи δ указують на те, що теплота і робота є функціями не стану, а процесу, отже, не можуть бути повними диференціалами.
З курсу фізики відомо, що елементарна робота системи, що робиться проти зовнішнього тиску р, дорівнює
δA = pdV ,
де dV — зміна об’єму. Тоді
δQ = dU + pdV .
Дане рівняння дозволяє обчислити кількість теплоти, що виділятиметься під час процесів, які протікають в ізохоричних або ізобаричних
6

умовах. При V = const
δQ = dU .
При р = const
δQ = dU + pdV = d(U + pV ) = dH,
де Н — ентальпія — функція стану, яка визначає кількість теплоти, що виділяється в ізобаричному процесі.
Це дозволяє сформулювати перший закон термодинаміки для хімічних
процесів (закон Гесса): тепловий ефект хімічної реакції не залежить від шляху реакції, а визначається лише різницею ентальпій вихідних речовин
іпродуктів реакції (при р = const) або різницею внутрішніх енергій (при V
= const). У біологічних системах процеси відбуваються при постійному тиску, отже, тепловий ефект біохімічних реакцій дорівнює зміні ентальпії в ході реакції.
Існування живого організму вимагає підтримки його в нерівноважному стані, а це неможливо без притоки енергії ззовні. Тварини як джерело енергії використовують їжу, точніше хімічну енергію, закладену в ній. Ця енергія визволяється у вигляді теплоти при окислюванні речовин, що супроводжується споживанням кисню і виділенням вуглекислого газу.
У1780 році Лавуазьє і Лаплас довели справедливість першого закону термодинаміки для біологічних об’єктів. Вони вимірювали кількість теплоти (по швидкості танення льоду) і вуглекислого газу, що виділяються морською свинкою у процесі життєдіяльності і порівнювали ці величини
з тепловим ефектом реакції спалювання спожитих продуктів до СО2. Отримані результати показали рівність енергії продуктів харчування
ітеплоти, що виділяється. Це доводить, що живі організми не можуть бути незалежним джерелом енергії, а тільки здійснюють перетворення одних видів енергії в інші.
§ 2. Другий закон термодинаміки для біологічних систем
Відповідно до другого закону термодинаміки, зміна ентропії (dS) більша або дорівнює поглиненій системою елементарній приведеній теплоті (dQ/T ):
Для ізольованої системи (δQ = 0) другий закон термодинаміки приймає вигляд:
dS ≥0 .
У оборотних (рівноважних) процесах ентропія залишається незмінною (знак “=“), у необоротних — зростає до максимального значення
7

(знак “>“). Це є критерієм еволюції класичної термодинаміки (критерій Клаузіуса): система прагне досягти кінцевого рівноважного стану з максимальною ентропією. При цьому навіть, якщо в результаті флуктуацій у системі відбудеться зменшення ентропії на деяку величину, то в ній мимовільно відбудуться такі процеси, що повернуть систему в стан із максимальною ентропією. Таким чином, другий закон термодинаміки вказує напрямок ходу процесу в системі.
Живий організм, як було відзначено вище, знаходиться протягом деякого проміжку часу в стаціонарному стані, у якому значення ентропії підтримується на постійному рівні і відмінне від мінімального, що, на перший погляд, не погоджується з другим законом термодинаміки.
Так як біологічна система є не ізольованою, а відкритою, загальна зміна ентропії (dS ) у ній може відбуватися як за рахунок виділення теплоти в результаті необоротних процесів у самій системі dQi, так і за рахунок притоку теплоти ззовні dQe:
(1.1) де deS — зміна ентропії, викликана взаємодією системи з навколишнім середовищем; diS — зміна ентропії в самій системі.
У випадку оборотних процесів diS =0, необоротних — diS >0. Якщо система ізольована, то deS = 0. У останньому випадку вираз (1.1) зводиться до вигляду:
di S ≥0, |
(1.2) |
тобто до формулювання другого закону в класичній термодинаміці. Після диференціювання виразу (1.1), одержимо:
Таким чином, швидкість зміни ентропії відкритої системи дорівнює
сумі швидкості зміни ентропії за рахунок взаємодії системи з зовнішнім середовищем і швидкості зміни ентропії, викликаної необоротними процесами усередині системи.
Необоротні процеси, що протікають усередині системи, викликають підвищення ентропії, тому завжди доданок di S/dt >0. Однак загальна ентропія системи може як зростати, так і зменшуватись за рахунок того, що член deS/dt може бути як негативним, так і позитивним. У випадку deS/dt <0 ентропія продуктів, які надходять до системи, менше ентропії продуктів, що виходять із неї, і навпаки. Можливі наступні три випадки:
1)dS/dt >0, якщо deS/dt >0 або якщо deS/dt <0, |deS/dt| <diS/dt ;
2)dS/dt <0, якщо deS/dt <0 і |deS/dt| >diS/dt ;
3)dS/dt =0, якщо deS/dt <0 і |deS/dt| =diS/dt .
8

Перший випадок (dS/dt >0) відповідає патологічному стану організму, тому що при цьому зменшується упорядкованість системи. Це спостерігається, наприклад, при онкологічних захворюваннях, коли відбувається неконтрольований неупорядкований зріст кількості клітин. Другий випадок (dS/dt <0) відповідає підвищенню рівня організації організму, третій випадок (dS/dt = 0) — встановленню стаціонарного стану в системі.
Загальний енергообмін живих організмів можна представити наступним способом. Сонячне світло, поглинене рослинними організмами, енергетично забезпечує синтез вуглеводів із Н2О і СО2 (фотосинтез). Окислювання синтезованих вуглеводів у процесі дихання супроводжується виділенням енергії, яку використовують для своєї життєдіяльності рослини і тварини. Поглинання світу викликає зниження ентропії в живому організмі, однак одночасно йде підвищення ентропії на Сонці в процесі ядерних реакцій, що по модулю перевищує зниження ентропії на Землі. У цілому, в системі Земля—Сонце ентропія підвищується. Таким чином, розвиток живих організмів відбувається за рахунок зменшення упорядкованості навколишнього середовища.
§ 3. Термодинамічні потенціали
Проведення будьFяких термодинамічних розрахунків неможливе без використання термодинамічних потенціалів. Термодинамічним потенціалом називається функція стану, зміна якого в деякому процесі, що протікає при постійних значеннях певної пари термодинамічних параметрів, дорівнює корисній роботі, що здійснюється системою.
Термодинамічними потенціалами є уже відомі внутрішня енергія U і ентальпія H, а також вільна енергія Гельмгольца F, термодинамічний потенціал Гіббса G, хімічний потенціал µ і електрохімічний потенціал 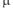 .
.
З курсу фізики відомо, що повна робота системи δA дорівнює сумі роботи проти зовнішнього тиску рdV і корисної роботи δАп (роботи, що
здійснюється проти інших зовнішніх сил): |
|
δА = δAп + рdV . |
(1.3) |
Об’єднаємо записи першого і другого законів термодинаміки для
оборотних процесів (при цьому TdS = δQ) |
|
TdS = dU + δA . |
(1.4) |
Підставивши (1.3) у (1.4), виразимо корисну роботу
–δАп = dU + рdV – TdS .
Даний вираз дозволяє знайти корисну роботу в умовах сталості тієї
9

чи іншої пари термодинамічних параметрів. Наприклад, при постійних температурі та об’ємі корисна робота здійснюється за рахунок зміни ізохорноFізотермічного потенціалу, або вільної енергії Гельмгольца F :
dF = –δАп = dU – TdS .
Корисна робота в різних випадках подана в таблиці 1.1.
Процеси, що протікають у біологічних системах, частіше усього здійснюються при постійних температурі та тиску. Тому, корисна робота в біосистемах визначається зміною термодинамічного потенціалу Гіббса1:
dG = –δАп = dU + рdV – TdS = dH – TdS . |
(1.5) |
При цьому доданок dH визначає зміну потенційної енергії системи, а доданок TdS — ту частину енергії системи, яка не може бути використана на виконання корисної роботи, отже, характеризує необоротність процесу. При TdS = 0 процес звернений.
У реальних необоротних процесах
TdS >δQ .
Використовуючи даний вираз, можна показати, що процеси завжди
|
|
|
Табл. 1.1 |
|
Термодинамічні потенціали |
|
|
|
|
|
|
Постійні |
Назва потенціалу |
|
Вигляд функції |
параметри |
|
||
|
|
|
|
|
|
|
|
V, S |
Внутрішня енергія, або ізохорноFізоентропійний |
|
dU |
потенціал |
|
||
|
|
|
|
|
|
|
|
P, S |
Ентальпія, або ізобарноFізоентропійний потен- |
|
dH = dU + pdV |
ціал |
|
||
|
|
|
|
|
|
|
|
T, V |
В і л ь н а е н е р г і я Ге л ь м г о л ь ц а , а б о |
|
dF = dU – TdS |
ізохорноFізотермічний потенціал |
|
||
|
|
|
|
|
|
|
|
T, P |
Термодинамічний потенціал Гіббса або |
|
dG = dU + рdV – TdS |
ізобарноFізотермічний потенціал |
|
||
|
|
|
|
|
|
|
|
протікають у тому напрямку, при якому вільна енергія Гельмгольца і термодинамічний потенціал Гіббса зменшуються. Так як ці величини завжди прагнуть до мінімального значення, то в стані рівноваги
F = Fmin;
G = Gmin.
1Іноді термодинамічний потенціал Гіббса називають вільною енергією Гіббса або просто вільною енергією.
10
