- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Концентрационные гальванические элементы.
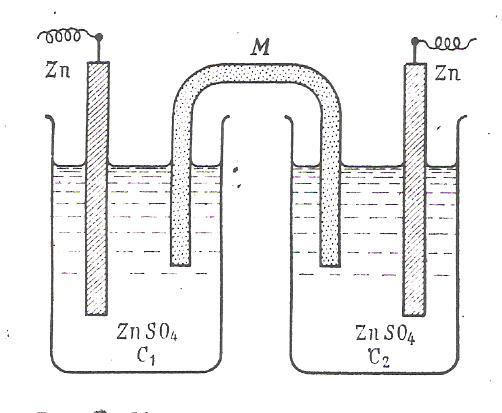
В концентрационных гальванических элементах электрическая энергия образуется не за счет химической реакции, а за счет разницы концентраций растворов, в которые опущены электроды, изготовленные из одного и того же металла. Расcмотрим цепь (рис. 6 )
Zn|ZnSO4(a1)||ZnSO4(a2)|Zn , причем а1<а2.
|
Рис. 6. Цинковая концентрационная цепь: М – агар-агаровый сифон, содержащий хлорид калия
|
Поскольку металл обоих электродов один и тот же, стандартные потенциалы их также одинаковы. Однако, из-за различия концентрации (активности) катионов металла равновесие:
Zn ↔ Zn²++ 2ē
в растворе в обоих полуэлементах неодинаково. В полуэлементе с менее концентрированным раствором (а1) равновесие несколько сдвинуто вправо
Zn→ Zn²++ 2ē
и электрод заряжается отрицательно. Электрод, погруженный в раствор большей концентрацией (а2), заряжается положительно.
В процессе работы гальванического элемента концентрация а2 постепенно уменьшается, концентрация а1 увеличивается. Элемент работает до тех пор, пока выравняются концентрации.
Для вычисления ЭДС цепи воспользуемся уравнением
E= φ2 - φ1
На основании уравнения Нернста можно записать:
RT
φ1 =
φºZn + ln
a1,
zF
RT
φ2
= φºZn + ln
a2,
zF
Подставляя значения φ1 иφ2 в уравнение для ЭДС получим:
RT a2
Е
= ln , Eº = 0
zF a1
Для разбавленных растворов используют вместо активностей концентрации растворов
RT с2
Е = ln
.
zF с1
Диффузный потенциал.
В гальванических элементах на границах соприкосновения растворов могут возникать диффузионные потенциалы (φg).
Скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами называется диффузионным потенциалом.
Диффузионный потенциал можно определить экспериментально, а так же вычислить. Сделаем это на примере рассмотренной выше концентрационной цинковой цепи.
При работе элемента электроны во внешней цепи переносятся слева направо. Следовательно, внутри элемента сульфат – ионы переходят справа налево. Ионы цинка движутся в обратном направлении. Подвижность сульфат ионов (la) больше подвижности ионов цинка (lк).
Соответственно работы переноса одного грамм – иона равны.
a2 a2
W(SO4²¯)
= RT ln ; W(Zn²+) = - RT ln .
a1 a1
Через границу проходят неравные количества ионов, а количества, пропорциональные числам переноса ионов и суммарная работа тогда равна:
a2
W= RT (t
(-) –t (+)) ln
a1
la
t
(-) = - число переноса
сульфат- ионов
la + lk
lk
t
(-) = - число переноса ионов
цинка
la + lk-
Доля количества электричества, переносимого ионами данного знака по отношению к электричеству, переносимому всеми ионами, называется числом переноса данных ионов.
Подставим значения t(-) иt(+) в уравнение для суммарной работы
la – lk a2
W= RT
ln
la +lk a1
Зная, что W=zFφg, запишем
la – lk a2
zFφд
= RT ln
la +lk a1
RT la – lk a2
Откуда
φд
= ln
zF la +lk a1
ЭДС концентрационной цинковой цепи с учетом диффузионного потенциала будет равна:
Е=Ек + φд
2la RT a2
Е
= ln
la+lk zF a1
При lk> la ЭДС концентрационной цепи была бы равна
Е=Ек - φд
При точных вычислениях ЭДС гальванических элементов обязательно должна вводиться поправка на величину диффузионного потенциала. Однако, на практике чаще всего устраняют влияние диффузионного потенциала, включая между растворами электролита насыщенный раствор хлорида калия.