
- •Практическое занятие № 6
- •Основы молекулярно – кинетической теории идеального газа. Законы идеального газа.
- •Основные формулы Идеальные газы подчиняются уравнению состояния Менделеева - Клапейрона
- •1.2. Вопросы для повторения
- •Что надо уметь.
- •Примеры решения задач.
- •Анализ и решение.
- •Анализ и решение.
- •Поэтому дм3.
- •1.5. Задачи для самостоятельного решения
- •Литература
- •Что надо знать.
- •Средняя квадратичная скорость
- •Анализ и решение. Из основного уравнения молекулярно – кинетической теории газов
- •Анализ и решение.
- •Анализ и решение.
- •Анализ и решение.
- •Задачи для самостоятельного решения
- •Литература.
- •3.2. Вопросы для повторения.
- •Что надо знать.
- •Примеры решения задач.
- •3.5. Задачи для самостоятельного решения
- •Литература.
- •Практическое занятие № 9
- •4. Второй закон термодинамики. Энтропия.
- •4.1. Основные формулы
- •4.2. Вопросы для повторения.
- •Что надо знать.
- •Примеры решения
- •4.5. Задачи для самостоятельного решения
- •Литература.
- •5.2. Вопросы для повторения
- •5.3. Что надо знать.
- •5.4. Примеры решения задач.
- •5.5. Задачи для самостоятельного решения
- •Литература.
Что надо знать.
Задачи посвящены применению первого начала термодинамики к процессам, происходящем в идеальном газе. При этом предпологается, что эти процессы являются квазистатическими (все промежуточные состояния равновесны). Это позволяет записывать уравнение первого начала сразу в интегральной форме. Использование дифференциальной формы записи первого начала термодинамики целесообразно только в тех случаях, когда, например, с помощью этого закона и уравнения состояния нужно найти уравнение процесса или теплоемкость газа.
Примеры решения задач.
Первый закон (или начало) термодинамики является выражением одного из
основных законов природы – закона сохранения и превращения энергии.
Задачи,
основанные на применении I
- начала термодинамики, согласно которому
существует только два способа изменения
внутренней энергии термодинамической
системы: либо подвод энергии, либо
совершение работы системой Q
=
![]() U
+ A.
При этом необходимо учитывать, что
внутреняя энергия – функция состояния,
а работа и теплота – функции процесса.
U
+ A.
При этом необходимо учитывать, что
внутреняя энергия – функция состояния,
а работа и теплота – функции процесса.
Применение
I
- начала термодинамики к различным
процессам позволяет рассчитывать
величины Q,
![]() U,
A,
используя соответствующие дополнительные
соотношения. Решая задачи для изобарного
процесса, при вычислении Q,
удобно пользоваться понятием изобарной
теплоемкости.
U,
A,
используя соответствующие дополнительные
соотношения. Решая задачи для изобарного
процесса, при вычислении Q,
удобно пользоваться понятием изобарной
теплоемкости.
3.4.1.
Количество
= 2 кмоль углекислого газа нагревается
при постоянном давлении на
![]() Т
= 50К. Найти изменение
Т
= 50К. Найти изменение
![]() w
внутренней энергии газа, работу А
расширения газа и количество теплоты
Q
сообщенное газу.
w
внутренней энергии газа, работу А
расширения газа и количество теплоты
Q
сообщенное газу.
Анализ и решение
Первое
начало термодинамики при изобарическом
процессе записывается в виде
![]()
Молярные
теплоемкости при постоянном объеме и
постоянном давлении соответственно
равны
![]() ,
,
![]()
![]() R
= 8,32 Дж/моль*К
R
= 8,32 Дж/моль*К
![]()
![]() -
число молей (количество вещества)
-
число молей (количество вещества)
![]()
![]()
![]()
3.4.2.
В цилиндре с подвижным поршнем заключен
азот
![]() .
Азоту дают возможность расширяться
вначале адиабатически от объема V1=1л
до объема V2=3л,
затем изобарически от объема до объема
V3=5л,
потом изотермически от объема V3
до объема
V4=7л.
Начальная температура газа Т1
= 2900К,
начальное давление Р1
= 6,5 ат. Определить совершенную газом в
каждом из этих процессов работу, изменение
его внутренней энергии и количество
подведенного к газу тепла. Найти конечное
давление газа Р4
и температуру Т4.
Удельная теплоемкость азота
.
Азоту дают возможность расширяться
вначале адиабатически от объема V1=1л
до объема V2=3л,
затем изобарически от объема до объема
V3=5л,
потом изотермически от объема V3
до объема
V4=7л.
Начальная температура газа Т1
= 2900К,
начальное давление Р1
= 6,5 ат. Определить совершенную газом в
каждом из этих процессов работу, изменение
его внутренней энергии и количество
подведенного к газу тепла. Найти конечное
давление газа Р4
и температуру Т4.
Удельная теплоемкость азота
![]() коэффициент Пуассона
коэффициент Пуассона
![]()
![]()
Анализ и решение.
Процесс адиабатического расширения
Работу А1, совершаемую газом, найдем по формуле
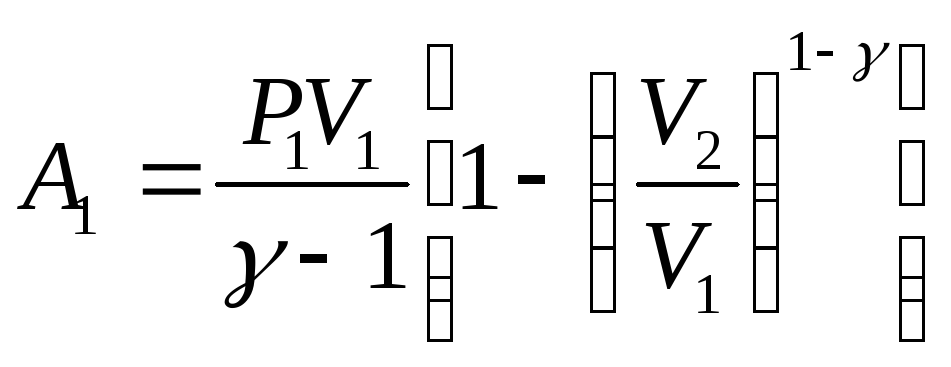 (1)
(1)
Эта работа совершается за счет уменьшения внутренней энергии газа в рассматриваемом процессе
![]()
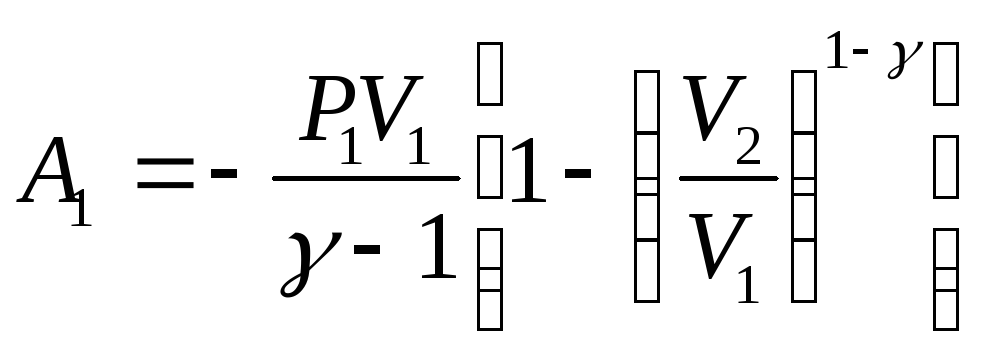 (2)
(2)
Тепло в адиабатическом процессе не подводится и не отводится, т.е. Q1 = 0
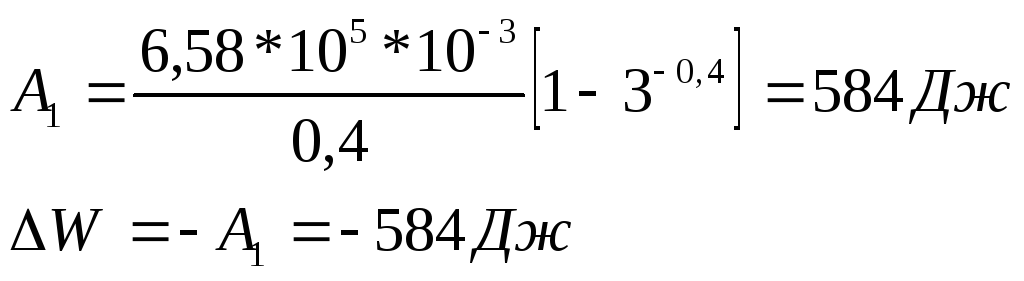
Процесс изобарического расширения (Р2 = Р3). Давление Р2 и температуру Т2
можно выразить через начальные параметры Р1, Т1 и объемы V1 и V2.
Для
адиабатического процесса
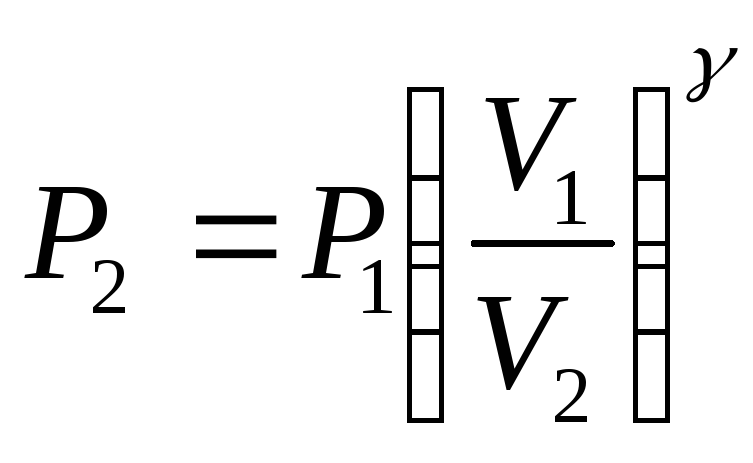
![]()
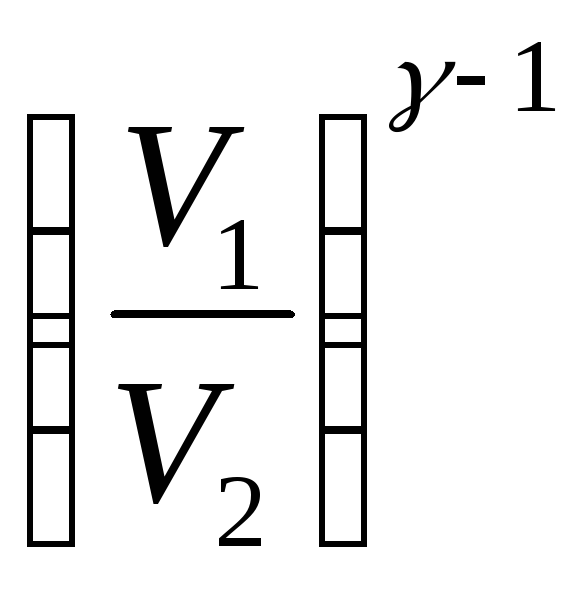
![]()
![]()
Работа А2 совершаемая газом в рассматриваемом процессе, равна
А2 = Р2(V3 – V2) = 1,42*105(5-3)*10-3 = 284 Дж
Изменение
внутренней энергии газа
![]() равно
равно
![]() =
=

где Т2 – температура газа в конце адиабатического расширения, Т3 – температура газа в конце изобарического расширения, а m – масса газа в цилиндре.
Массу
m
найдем из уравнения Менделеева –
Клапейрона записанного для начального
состояния газа:
![]()
oткуда
![]() ;
;
![]()
![]()
Для
азота
![]() R
= 8,32 Дж/моль*К.
R
= 8,32 Дж/моль*К.
![]()
Количество тепла Q2, подведенного к газу в изобарическом процессе равно
Q2
= mCp(T3
–
T2)
=
![]() т.е.
т.е.
Q2 = 1,4*707 = 991 Дж.
Процесс изотермического расширения.
Изменение
внутренней энергии
![]() равно
нулю
равно
нулю
Работа А3, совершаемая газом в этом процессе, равна
А3
=
![]()
![]()
Подведенное к газу тепло Q3 по первому закону термодинамики равно А3
![]()
Температура Т4 = Т3 = 3120 К.
Конечное
давление Р4
по закону Бойля – Мариотта равно
![]()
