
QuantMech_Chem_p3_85
.pdf
Разложим характер приводимого представления по характерам неприводимых представлений (см. стр. 68 данного пособия).
|
|
|
|
|
χA := |
1 |
|
|
|
|
|
|
|
1 |
|
|
|
χ := |
4 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
χB := |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
−1 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 := 21 ∑ χj χAj |
|
|
m1 = 2 |
m2 := 21 ∑ χj χBj |
|
m2 = 2 |
||||||||||||||||||||||||||
|
|
|
|
j = 0 |
|
|
|
|
|
|
|
|
|
|
|
j = 0 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
Определим проекторы и подействуем ими на пробные функции φ. |
|
|
||||||||||||||||||||||||||||||
PA |
:= |
1 |
|
|
χA |
E + χA |
C2 |
|
|
PB := |
|
1 |
χB |
|
|
E + χB |
C2 |
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
2 |
|
|
0 |
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
0 |
|
|
|
|
1 |
|
|
|||||||
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
||
|
|
|
|
|
|
|
φ1 |
+ |
|
|
φ4 |
|
|
|
|
|
|
|
|
|
|
φ1 |
− |
|
φ4 |
|
||||||
|
|
|
|
|
2 |
|
2 |
|
|
|
2 |
2 |
||||||||||||||||||||
|
φ1 |
|
|
|
|
|
|
|
|
|
|
|
|
φ1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|||||
|
φ2 |
|
|
|
|
φ2 |
+ |
|
|
φ3 |
|
|
φ2 |
|
|
|
|
|
φ2 |
− |
|
φ3 |
||||||||||
|
|
2 |
|
2 |
|
|
2 |
2 |
||||||||||||||||||||||||
PA |
→ |
1 |
|
|
|
|
1 |
|
|
|
|
PB |
|
→ |
−1 |
|
|
|
1 |
|
|
|
||||||||||
|
φ3 |
|
|
|
φ |
2 |
+ |
|
φ |
3 |
|
|
|
φ3 |
|
|
|
φ |
2 |
+ |
φ |
3 |
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|||||||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||||||||
|
φ4 |
|
|
|
1 |
φ1 |
+ |
|
1 |
φ4 |
|
|
|
φ4 |
|
|
|
−1 |
φ1 |
+ |
1 |
φ4 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
2 |
|
2 |
|
|
|
2 |
|
2 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Отсюда ясно, что χ = 2χA + 2χB и для конструирования базисных функций потребуется выбрать по две взаимо ортогональных функций для каждого представления. В предположении ортонормированности функций φi находим четыре нормированные орбитали симметрии ψ , преобразующиеся по неприводимым представлениям группы С2 .
ψA1 |
= 1 (φ1 + φ4) |
ψA2 |
= 1 (φ2 + φ3) |
|
2 |
|
2 |
ψB1 |
= 1 (φ1 − φ4) |
ψB2 |
= 1 (φ2 − φ3) |
|
2 |
|
2 |
Используя тот факт, что <φj |Н| φj > = α |
и <φj |Н| φk > = β для соседних |
||
81

атомов и нулю для остальных , легко показать, что при использовании найденных функций ψ гамильтониан в приближении Хюккеля для молекулы бутадиона принимает блочно-диагональный вид.
|
α |
β |
0 |
0 |
|
|
( →ψ,ψ) |
|
β α + β 0 |
0 |
|
||
|
|
|||||
H |
= |
0 |
0 |
α |
β |
|
|
|
|
|
|
|
|
|
0 |
0 |
β |
α − β |
||
При этом вековое уравнение распадается на два квадратных уравнения, корни которого легко находятся аналитически. Учет симметрии молекулы позволяет "правильно" выбрать орбитали симметрии. Получающиеся при этом коэффициенты и волновые функции выражаются через орбиты симметрии, но легко могут быть преобразованы в исходные
орбитали. |
|
1 |
|
5 |
|
|
|
|
1 |
|
5 |
|
|
|
|
|
|
|
|||||||||
E1 |
= α + β |
|
+ |
|
|
E2 |
= α + β |
− |
|
+ |
|
|
|
2 |
2 |
2 |
2 |
||||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
1 |
|
5 |
|
|
|
|
1 |
|
5 |
|
|
E3 |
= α + β |
|
− |
|
|
E4 |
= α + β |
− |
|
− |
|
|
|
2 |
2 |
2 |
2 |
||||||||||
|
|
|
|
|
|
|
|
|
Упражнения
1.Используя найденные орбиты симметрии для молекулы бутадиона вычислить матричные элементы гамильтониана и найти уровни энергии и коэффициенты при орбиталях симметрии. Как они соотносятся с найденными ранее собственными векторами?
2.Рассчитайте π - электронные энергии и коэффициенты при атомных орбиталях следующих молекул: а) аллила; б) циклопропенила; в) циклобутадиена; г) триметиленметана; д) пентадиена; е) 3-метиленпентадиена. Вычислите также матрицу плотности, порядки связей, заряды на атомах,
индексы свободной валентности и суммарную энергию π - электронов молекул. Оцените энергию делокализации.
3. Учитывая симметрию группы С2v , определите хюккелевские МО фульвена и на основе этого вычислите электронные заряды и дипольный момент. Сравнить полученное значение дипольного момента с экспериментальным, равным 1.2 D.
4. Для молекул: а) метиленциклопропена; б) бициклогексатриена; в) тривинилметила; г) ацепентилена; д) перинафтенила; е) бензила; ж) антрацена и з) пропалена установить группу симметрии и найти симметризованные орбитали и уровни энергии π- МО ([16,17]).
82

5. Вычислите энергии π- МО и полную π- электронную энергию прямоугольной структуры циклобутадиена С4Н4 с альтернирующей длиной связей (см.[8,9]). Результаты сравнить с расчетами квадратной структуры. Отношения резонансных интегралов β2/β1 = 0.532 и β0/β1 = 0.842.
6. Учитывая симметрию молекулы бензола, найдите симметризованные орбитали, выражения для уровней энергии π- МО, полную π-элек- тронную энергию и энергию делокализации (см.[8,9,16,17]).
7. Рассчитайте π - электронные энергии и коэффициенты при атомных орбиталях хюккелевского бензола (см. рис. 3 и [8]). Вычислите матрицу плотности, порядки связей, заряды на атомах и суммарную энергию π - электронов молекулы. Найденные энергии можно сравнить с известными результатами для циклических полиенов:
|
|
2 π |
j |
|
j = 0 .. N − 1 |
Ej = α + 2 β cos |
N |
|
N = 6 |
Рис. 4. Хюккелевский бензол Рис. 5. Мебиусовский бензол
8. Предположим, что при соединении атомов в замкнутую цепочку в результате действия внешних факторов происходит поворот одного из атомов по отношению к соседям на 1800, так, что соответствующий резонансный интеграл меняет знак. Рассчитайте π - электронные энергии и коэффициенты при атомных орбиталях такого мебиусов-
ского бензола (см. рис. 4 и [8). Вычислите матрицу, |
порядки связей, |
||||
заряды на атомах и суммарную энергию |
π - электронов молекулы. |
||||
Найденные энергии можно сравнить с формулой |
|
|
|||
|
(2 j + 1) π |
|
|||
j = 0 .. N − 1 |
Ej = α − 2 β cos |
|
|
|
N = 6 |
|
N |
||||
9. Учитывая симметрию группы D2 молекулы нафталина, найдите симметризованные орбитали, выражения для уровней энергии π- МО, полную π-электронную энергию и энергию делокализации (см.[16,17]).
10. Используя результаты решения задачи 9 и выбирая слэтеровские атомные орбитали с длиной связи а =1.4 и z = 0.1A построить контурные и поверхностные графики молекулярных орбиталей и плотности заряда высшей занятой (ВЗМО) и низшей свободной (НСМО) орбиталей.
83
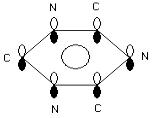
11. Вычислите π - электронные энергии и коэффициенты при атомных орбиталях молекулы симм-триазина ( рис. 5), состоящей из 3-х атомов
углерода и 3-х атомов азота. Вычислите матрицу плотности, порядки связей, заряды на атомах, индексы свободной валентности. Для описания кулоновских и резонансных интегралов можно принять следующие предположения ([8,9]):
|
αC = α , |
αN = α + 0.5 β , |
Рис. 6. Молекула симм-триазина |
βCN = βNN = βCC = β . |
|
12. Для молекулы пиридина, образующейся в результате замещения атомом азота одного из атомов углерода в молекуле бензола, вычислите π - электронные энергии и коэффициенты при атомных орбиталях. Вычислите матрицу плотности, порядки связей, заряды на атомах и индексы свободной валентности. Для кулоновских и резонансных интегралов можно принять следующие предположения ([16]):
|
αN = α + β , |
βCN = βNN = βCC = β, |
|
|
а) αС = α , |
б) αС1 = αC5 = α + 0.1 β. |
|
13. |
Получить МО молекулы пиридина, используя ее группу симметрии. |
||
Сопоставить с аналогичными результатами для бензола. |
|
||
|
|
Содержание |
|
1. |
Наблюдаемые и их характеристики |
3 |
|
2. |
Коммутаторы эрмитовых операторов |
10 |
|
3. |
Квантовый гармонический осциллятор |
13 |
|
4. |
Жесткий ротатор |
|
19 |
5. |
Волновые функции атома водорода |
25 |
|
6. |
Гибридизация атомных орбиталей |
33 |
|
7. |
Орбитальные и спиновые моменты |
38 |
|
8. |
Сложение моментов |
|
43 |
9. |
Вариационный расчет основного состояния гелия |
51 |
|
10. Стационарная теория возмущений |
57 |
||
11. Элементы теории групп и представлений групп |
63 |
||
12. Метод молекулярных орбиталей Хюккеля |
74 |
||
|
Литература |
|
84 |
84
Литература
1.Давыдов А.С. Квантовая механика. -М.: Наука, 1973, -703с
2.Мессиа А. Квантовая механика. т.1-2, -М.: Наука, 1978
3.Соколов А.А., Тернов И.М., Жуковский В.Ч. Квантовая механика. -М.: Наука, 1979, -528с.
4.Галицкий В.М., Карнаков Б.М., Коган В.И. Задачи по квантовой механике. -М.: Наука, 1992, -880с.
5.Флюгге З. Задачи по квантовой механике. т.1-2, М.: МИР, 1974.
6.Балашов В.В., Долинов В.К. Курс квантовой механики. -М.: Изд-во МГУ,1982, -280с.
7.Степанов Н.Ф. Квантовая механика и квантовая химия. М.: МИР, 2001, -519с.
8.Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул. Ростов-на-Дону, "Феникс", 1997, -560с.
9.Симкин Б.Я., Клецкий М.Е., Глуховцев М.Н. Задачи по теории строения молекул. Ростов-на-Дону, "Феникс", 1997, -272с.
10.Соловьев М.Е., Соловьев М.М. Компьютерная химия. М.:
СОЛОН-Пресс, 2005, -536с.
11.Грибов Л.С., Муштакова С.П. Квантовая химия. М.: Гардарики, 1999, -390с.
12.Зар Р. Теория углового момента. О пространственных эффектах в физике и химии. М.: МИР, 1993, -351с.
13.Теоретический практикум по ядерной и атомной физике, под редакцией В.В.Балашова. -М.: Энергоатомиздат, 1984.
14.Фларри Р. Группы симметрии. Теория и химические приложения.
М.: МИР, 1983, -400с.
15.Банкер Ф., Йенсен П. Симметрия молекул и спектроскопия. М.: МИР, Научный мир, 2004, -763с.
16.Хагаси К., Баба Х., Рембаум А. Квантовая органическая химия. М.:
МИР, 1967, -380с.
17.Стрейтвизер Э. Теория молекулярных орбит для химиковоргаников. М.: МИР, 1965, -435с.
