- •Теоретический курс
- •Раздел 1. Металловедение.
- •1.1. Общая характеристика металлов.
- •1.1.1. История познания металлов человеком
- •1.1.2. Кристаллическое строение
- •1.1.3. Типы кристаллических решеток
- •1.1.4. Анизотропия свойств кристаллов
- •1.1.5. Полиморфизм в металлах
- •1.1.6. Строение реальных кристаллов
- •Вопросы для самопроверки
- •2.2. Кристаллизация металлов
- •2.2.1. Теоретические основы
- •1.2.2. Механизм процесса кристаллизации
- •1.2.3. Основные явления кристаллизации слитков. Влияние формы кристаллов на служебные характеристики металла
- •Вопросы для самопроверки
- •1.3. Основы теории сплавов.
- •1.3.1. Внутреннее строение и свойства механических смесей, твердых растворов и химических соединений
- •1.3.2. Диаграммы состояния сплавов. Их типы и построение
- •Вопросы для самопроверки
- •1.4. Железоуглеродистые сплавы.
- •1.4.1. Железо
- •1.4.2. Углерод
- •1.4.3. Структурные составляющие системы железо-углерод
- •1.4.4. Диаграмма состояния железо – цементит (метастабильное равновесие)
- •Вопросы для самопроверки
- •1.5. Термическая обработка стали
- •1.5.1. Основы технологии термической обработки
- •1.5.2. Основные параметры процессов термической обработки
- •1.5.3. Основные виды термической обработки
- •1.5.4. Основные превращения в сталях в процессах термообработки
- •1.5.5. Химико-термическая обработка стали. Общая характеристика процессов
- •1.5.6. Термомеханическая обработка (тмо)
- •Вопросы для самопроверки
- •1.6. Физические основы пластичности и прочности металлов
- •1.6.1. Виды деформации
- •1.6.2. Механические свойства металлов
- •1.6.3. Влияние дефектов кристаллической решетки на прочность металла
- •1.6.4. Методы исследования строения, структуры и свойств металлов
- •Вопросы для самопроверки
- •1.7. Влияние температуры на структуру и свойства металлов
- •1.7.1. Диффузия ядер в металлах
- •1.7.2. Влияние повышения температуры на механические свойства
- •1.7.3. Возврат и рекристаллизация деформированного металла при нагреве
- •1.7.4. Сфероидизация и графитизация цементита в сталях
- •Вопросы для самопроверки
- •1.8. Углеродистые и легированные стали
- •1.8.1. Условия эксплуатации и требования к сплавам
- •1.8.2. Структура и основные свойства сталей
- •1.8.3. Принципы классификации и маркировки сталей
- •1.8.4. Конструкционные стали
- •1.8.5. Инструментальные стали
- •1.8.6. Легированные стали в энергетике
- •Вопросы для самопроверки
- •1.9. Чугуны
- •1.9.1. Классификация чугунов
- •1.9.2. Серые чугуны
- •1.9.3. Высокопрочные чугуны
- •1.9.4. Ковкие чугуны
- •1.9.5. Специальные чугуны
- •1.9.6. Маркировка чугунов
- •Вопросы для самопроверки
- •1.10. Сплавы на основе железа с различными металлами
- •Вопросы для самопроверки:
Вопросы для самопроверки
Дайте определение металлов по Ломоносову, Майеру и современное.
На какие две группы подразделяют металлы по окраске? Перечислите металлы входящие в них.
Приведите классификацию цветных металлов по некоторым их физико-механическим параметрам.
Что такое кристаллическое строение вещества?
Какие кристаллические решетки характерны для металлов?
Что называется периодом и координационным числом кристаллической решетки?
Сколько ядерных остовов приходится на элементарную ячейку гранецентрированной, объемноцентрированной кубической и гексагональной плотноупакованной решетки?
Напишите кристаллографическое обозначение плоскостей куба и индексы их направления
Что такое полиморфное превращение, какие условия необходимы для его протекания и как оно осуществляется?
Какие Вы знаете дефекты кристаллической решетки?
Что такое дислокации? Чем отличаются ее разновидности друг от друга и как они влияют на свойства металла?
Какие Вы знаете поверхностные несовершенства в поликристалле?
2.2. Кристаллизация металлов
2.2.1. Теоретические основы
По агрегатному состоянию вещества бывают твердые, жидкие и газообразные. Для одного и того же вещества каждое из данных состояний можно назвать фазой.
Фаза – химически или физически однородная часть какой-то системы, имеющая одинаковые структурные характеристики и свойства и отделенная от других поверхностью раздела, при переходе через которую свойства и состав изменяются скачкообразно.
Системы могут быть одно или многофазными, частным случаем являются двухфазные. Большинство веществ могут находиться во всех данных состояниях. Поэтому для широкого числа соединений возможен переход из одной фазы в другую. Такие трансформации называются фазовыми изменениями или превращениями. Они обуславливаются различием свободной энергии каждого состояния.
Согласно основному соотношению термодинамики G=H–TS, объединяющему в себе первый и второй ее законы, каждая система стремится к минимальному значению термодинамического потенциала (G), где (H) – энтальпия системы, Т – абсолютная температура состояния,S– энтропия.
При производстве металла наблюдается переход из жидкого в твердое кристаллическое состояние, называемый кристаллизацией. Жидкая фаза характеризуется беспорядочным (хаотичным) движением структурных единиц системы в своем объеме. Она обладает низкой свободной энергией или термодинамическим потенциалом. Твердое тело имеет упорядоченное расположение ядер в структуре, практически спокойное состояние. Термодинамический потенциал такой системы имеет более высокие значения, а кинетическая энергия ее самая маленькая.
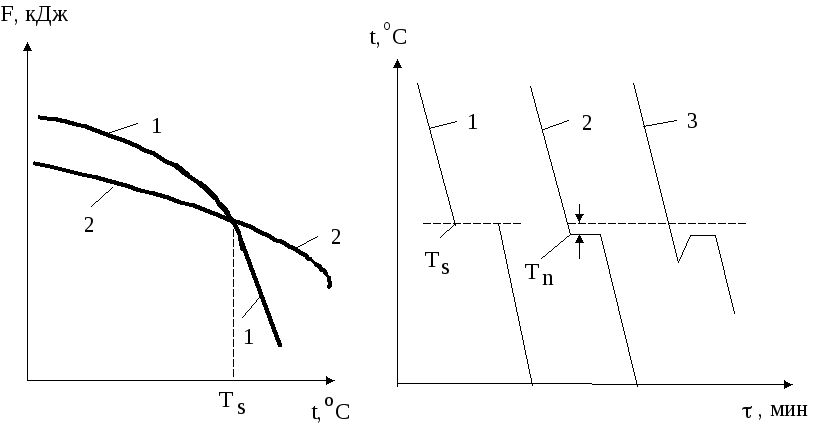
Кристаллизация металла обусловлена его стремлением иметь более устойчивое состояние, характеризуемое уменьшением энтропийного фактора в доле свободной энергии. Изменение свободных энергий жидкого и твердого состояний в зависимости от температуры модифицируется по сложному и различному для данных фаз закону (рис. 1.12). Выше точки пересечения кривых жидкой и твердой фаз более устойчив металл в жидком состоянии, имеющий меньший запас свободной энергии, ниже - более стойкой является твердая фаза. В самой данной точке величины Gжидкого и твердого состояний равны. Температура, соответствующая таковому состоянию, называется равновесной (теоретической) температурой плавления или кристаллизации. При ней обе фазы могут существовать одновременно и притом бесконечно долго. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением хотя бы одной из составляющих свободной энергии. Процесс кристаллизации может начаться только тогда, когда металл остынет до температуры ниже равновесной, т. е. произойдет его переохлаждение. Это вызвано тем, что образование и рост кристаллов сопровождается выделением избыточного количества свободной энергии. Разность между данными температурами называется степенью переохлаждения (Т). Она зависит от природы металла. Степень переохлаждения увеличивается с повышением чистоты металла и с ростом скорости остывания. Обычно при кристаллизации в производственных условиях ее значения колеблются от 10 до 30С; при больших же скоростях охлаждения она может достигать сотен градусов (рис. 1.12).
|
| |
|
Рис. 1.12 - Зависимость изменения свободной энергии фазовых состояний от температуры: 1- жидкость, 2 – твердое тело |
Рис. 1.13 - Кинетические кривые процесса охлаждения для: 1 – идеального, 2 и 3 – реального металлов |
Процесс перехода металла из жидкого состояния в кристаллическое описывается кинетическими кривыми в координатах температура – время (рис. 1.13).
При очень медленном остывании металла его степень переохлаждения мала и процесс кристаллизации протекает при температуре близкой к равновесной. Далее при достижении точки равновесия на графике отмечается горизонтальная площадка - плато (остановка в понижении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации. С увеличением скорости охлаждения степень переохлаждения возрастает, и процесс кристаллизации протекает при температурах ниже равновесной.