
- •Теоретический курс
- •Раздел 1. Металловедение.
- •1.1. Общая характеристика металлов.
- •1.1.1. История познания металлов человеком
- •1.1.2. Кристаллическое строение
- •1.1.3. Типы кристаллических решеток
- •1.1.4. Анизотропия свойств кристаллов
- •1.1.5. Полиморфизм в металлах
- •1.1.6. Строение реальных кристаллов
- •Вопросы для самопроверки
- •2.2. Кристаллизация металлов
- •2.2.1. Теоретические основы
- •1.2.2. Механизм процесса кристаллизации
- •1.2.3. Основные явления кристаллизации слитков. Влияние формы кристаллов на служебные характеристики металла
- •Вопросы для самопроверки
- •1.3. Основы теории сплавов.
- •1.3.1. Внутреннее строение и свойства механических смесей, твердых растворов и химических соединений
- •1.3.2. Диаграммы состояния сплавов. Их типы и построение
- •Вопросы для самопроверки
- •1.4. Железоуглеродистые сплавы.
- •1.4.1. Железо
- •1.4.2. Углерод
- •1.4.3. Структурные составляющие системы железо-углерод
- •1.4.4. Диаграмма состояния железо – цементит (метастабильное равновесие)
- •Вопросы для самопроверки
- •1.5. Термическая обработка стали
- •1.5.1. Основы технологии термической обработки
- •1.5.2. Основные параметры процессов термической обработки
- •1.5.3. Основные виды термической обработки
- •1.5.4. Основные превращения в сталях в процессах термообработки
- •1.5.5. Химико-термическая обработка стали. Общая характеристика процессов
- •1.5.6. Термомеханическая обработка (тмо)
- •Вопросы для самопроверки
- •1.6. Физические основы пластичности и прочности металлов
- •1.6.1. Виды деформации
- •1.6.2. Механические свойства металлов
- •1.6.3. Влияние дефектов кристаллической решетки на прочность металла
- •1.6.4. Методы исследования строения, структуры и свойств металлов
- •Вопросы для самопроверки
- •1.7. Влияние температуры на структуру и свойства металлов
- •1.7.1. Диффузия ядер в металлах
- •1.7.2. Влияние повышения температуры на механические свойства
- •1.7.3. Возврат и рекристаллизация деформированного металла при нагреве
- •1.7.4. Сфероидизация и графитизация цементита в сталях
- •Вопросы для самопроверки
- •1.8. Углеродистые и легированные стали
- •1.8.1. Условия эксплуатации и требования к сплавам
- •1.8.2. Структура и основные свойства сталей
- •1.8.3. Принципы классификации и маркировки сталей
- •1.8.4. Конструкционные стали
- •1.8.5. Инструментальные стали
- •1.8.6. Легированные стали в энергетике
- •Вопросы для самопроверки
- •1.9. Чугуны
- •1.9.1. Классификация чугунов
- •1.9.2. Серые чугуны
- •1.9.3. Высокопрочные чугуны
- •1.9.4. Ковкие чугуны
- •1.9.5. Специальные чугуны
- •1.9.6. Маркировка чугунов
- •Вопросы для самопроверки
- •1.10. Сплавы на основе железа с различными металлами
- •Вопросы для самопроверки:
Вопросы для самопроверки
Что такое механическая смесь? Когда при затвердевании сплавов в их структуре образуются механические смеси?
Что такое твердый раствор? Какие виды твердых растворов Вы знаете?
Чем отличается твердый раствор замещения от твердых растворов внедрения и вычитания?
Какие условия необходимы для неограниченной растворимости металлов?
Что такое эвтектика и когда она образуется? Опишите ее процесс кристаллизации.
Дайте определение и математическое выражение правила фаз Гиббса. Какие параметры системы оно связывает между собой? Для чего оно применяется?
Определите число фаз, их структуру и количество при разных температурах и составах сплавов между линиями ликвидус и солидус в двухкомпонентной системе с полной взаимной растворимостью в жидком и твердом состояниях. Что такое конода?
Нарисуйте схему структуры твердого раствора?
Как получить пересыщенный твердый раствор в системе сплавов с ограниченной растворимостью? Как называется такой технологический процесс?
Что такое диаграмма состояния или плавкости сплава? Что она характеризует?
Опишите сущность термического метода построения диаграмм плавкости сплавов. Какие виды диаграмм Вы знаете.
Что такое линии ликвидус и солидус? Как с их помощью можно определить структуру образующегося сплава?
Что такое правило отрезков или рычага? Как оно позволяет определить состав сплава и соотношение фаз в нем по диаграмме состояния?
В чем заключается правило Н. А. Курнакова? Что такое диаграмма состав - свойство? Каково ее практическое значение?
1.4. Железоуглеродистые сплавы.
1.4.1. Железо
В промышленности чистое железо практически не используется, а наиболее широко применяются его сплавы. Основными из них являются системы железа с углеродом называемые сталями и чугунами.
Диаграмма состояний сплавов в системе железо-углерод дает первостепенные представления и понятия о строении и свойствах их составляющих.
Однако прежде, чем начать рассмотрение самой диаграммы, следует ознакомиться со свойствами и структурой чистых компонентов системы и продуктами их различного взаимодействия.
Железо – химический элемент IVпериодаVIIIгруппы периодической системы элементов Д. И. Менделеева. Химический знакFe, атомный номер 26, радиус 0,127 нм, масса 55,85, металл.
Железо является одним из наиболее распространенных элементов в природе, уступая лишь кислороду, кремнию и алюминию. Общая его концентрация в земной коре в пересчете на свободный элемент составляет 5,1 %. В свободном виде оно находится в падающих на землю метеоритах. Распространены в природе различные соединения железа. Оно входит в состав большинства горных пород и минералов, из которых состоят месторождения железных руд. Основными из них являются следующие железняки: магнитный или магнетит - Fe3O4, красный или гематит -Fe2O3, бурый или гетит и лимонит -Fe2O3и шпатовый или сидеритFeСO3. В природе в больших количествах часто встречается железный или серный колчедан (пирит) -FeS2, который служит сырьем для производства серной кислоты.
В зависимости от температуры окружающей среды железо может существовать в двух аллотропных или полиморфных модификациях (рис. 1.29.
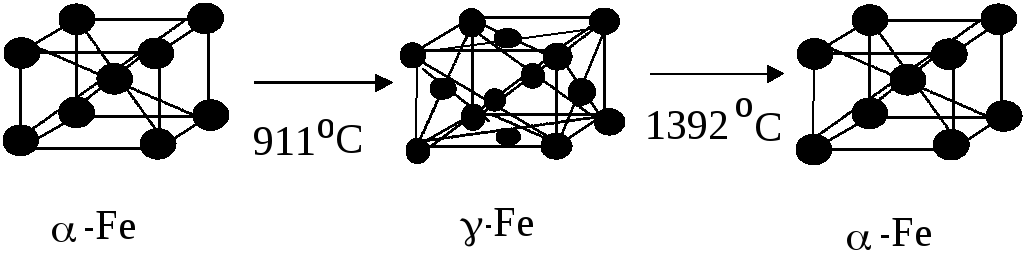
Рис. 1.29 - Полиморфные модификации железа и температуры их превращений
До 768 Сметалл имеет объемно-центрированную кубическую решетку (К8) с периодом 0,286 нм и ферромагнитными свойствами, его обозначают-Fe. При 768Соно переходит в-Fe. У него исчезают ферромагнитные свойства, и железо становится парамагнитным, но кристаллическая структура его существенно не меняется. Критическую точку, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри. При 911Спроисходит полиморфное превращение с трансформацией решетки в гранецентрированную кубическую (К12) с периодомd= 0,356 нм. Сам металл остается парамагнитным. Это-Fe. При видоизменении наблюдается сжатие. Объемный эффект сжатия составляет примерно 1,0 %. В точке 1392Ссовершается новый аллотропный переход, при котором образуется-Feс объемно-центрированной кубической решеткой. Это строение железо сохраняет до температуры плавления. Данная модификация - парамагнитна.
Понятие бета-железа исчезло из научного словаря, когда было доказано, что фаза, для описания которой оно предназначалось, не отражает никакого кристаллографического перехода. Фазы альфа и дельта также кристаллографически идентичны и имеют разные обозначения потому, что считались в прошлом двумя разными формами.
Железо состоит из четырех стабильных
изотопов с массовыми числами 54, 56, 57 и
58. Также применяются радиоактивные
изотопы
![]() Feи
Feи![]() Fe.
Fe.
Железо - металл серебристо-белого цвета. На воздухе оно подвергается коррозии, покрываясь ржавчиной, представляющей собой смесь различных оксидов железа. Технически чистое железо содержит до 0,10 - 0,15 % примесей. Наиболее чистый металл состоит на 99,9917 % из железа. Свойства металла зависят от степени его чистоты. Температура плавления железа 1539 5 °С, плотность –7,68 - 7,85 г/см3. Металл обладает невысокой твердостью и прочностью НВ80,в25 кгс/мм2;0,2= 12 кгс/мм2и хорошей пластичностью;= 50 %;= 80 %. Для поликристаллического железа, содержащего 99,8 - 99,9 %Fе, максимальная магнитная проницаемостьmax= (6,2812,5)·10-3Г/м и коэрцитивная сила Нс = 39,879,6 А/м; для чистого металла с 99,99 %Fеmax= 35,2·10-3Г/м и НC 1,99 А/м. Коэффициент линейного расширения железа составляет 11,710-6°C-1, удельное электросопротивление равно 10104Ом·м и теплопроводность 83,6 Вт/(м·К).
По своим химическим свойствам элемент является достаточно активным металлом. В образующихся химических соединениях он имеет степени окисления +2 и +3. При обычных температурах металл устойчив против воздействия сухого кислорода и воды, не содержащей данный газ. Железо при нагревании взаимодействует с такими неметаллами как кислород, галогены, сера, углерод и другие, образуя химические соединения по названию неметаллического элемента. Предварительно нагретый металл, внесенный в кислород, сгорает в нем, разбрасывая расплавленные капли окалины (искры) – Fe2O3. Разогретый порошок железа, помещенный в атмосферу хлора, горит с формированием его хлорида. При нагревании железо энергично реагирует с серой, образуя хрупкий сульфид. При очень высоких температурах оно взаимодействует с водой, вытесняя из нее водород. Поэтому во влажном воздухе и в воде, содержащей растворенный кислород, металл ржавеет. Разрушение железа, начавшееся на его поверхности, распространяется вглубь, так как корка из различных его оксидов получается рыхлой и не предохраняет металл от дальнейшего соприкосновения с агрессивной средой. В морской воде данный процесс протекает значительно интенсивнее, чем в обычной. Железо хорошо растворяется практически во всех минеральных кислотах различной концентрации с образованием разнообразных солей. Исключение составляют лишь сильно концентрированные серная и азотная кислоты, которые пассивируют его, что заключается в формировании на поверхности металла плотной тонкой корочки из его соединений, нерастворимых в данных кислотах. Это позволяет хранить и перевозить их в железной таре. Свойство железа вытеснять некоторые металлы из водных растворов их солей используют в металлургии для получения чистых металлов, например меди.
Расплавленное железо является хорошим растворителем многих металлов. Неограниченно растворяются в нем алюминий, медь, марганец, никель, кобальт, кремний, титан, цирконий и частично хром, ванадий, молибден, олово, платина, а также такие неметаллы, как углерод, сера, фосфор, мышьяк, селен, водород, азот и кислород. Не растворяются только свинец, серебро и висмут.
При затвердевании железа растворимость водорода, азота, кислорода и некоторых металлов резко падает и скачкообразно изменяется при переходе его из одной модификации в другую. В твердом металле неограниченно растворяются марганец, никель и кобальт. Предельная растворимость титана в железе составляет 60 %, ниобия 12 %, кремния около 19 %, вольфрама 33 %, молибдена 34 % и алюминия 35 %.
Железо значительно худший проводник электрического тока и тепла по сравнению с металлами подгруппы меди и алюминием. На основании этого его используют при разработке нагревостойких сплавов и систем с высоким сопротивлением. Последние употребляют при изготовлении изделий, предназначенных для работы только в постоянных магнитных полях. Технически чистое, электролитическое и карбонильное железоявляются высокоиндукционными металлическими магнитомягкими материалами.
Технически чистое железо применяют как шихтовый материал для производства почти всех ферромагнитных сплавов.
Электролитическое железо получают в результате электролиза солей железа(II) сульфата FeSO4 или хлорида FeCl2. Осажденный на катоде металл имеет значительный недостаток. Он содержит большое количество водорода, поэтому не обладает высокими магнитными свойствами. Для улучшения данных параметров материал подвергают серии переплавок в вакууме и многократных отжигов. Таким способом добиваются значений коэрцитивной силы Нс и максимальной магнитной проницаемости mах равными соответственно 30 А/м и 15000. Однако эти операции делают материал очень дорогим, поэтому его используют крайне редко. Из него изготавливают сердечники реле и электромагнитов, магнитных экранов, полюсов электрических машин и др.
Карбонильное железо получают в результате разложения его пентакарбонила Fe(CO)5. При различных условиях производят порошкообразный или губчатый металл. В результате термической обработки в водороде оно приобретает высокие магнитные свойства. Применяют карбонильное железо в качестве ферромагнитной фазы магнитодиэлектриков.
Как ферромагнитный материал железо является основным и наиболее дешевым компонентом в производстве магнитов. Металл применяют также в электровакуумных приборах как материал для анодов, экранов и других элементов, работающих при 500 °С.
