
- •Лекция №4 Термодинамический и статистический методы анализа систем и процессов Вступление
- •1. Макроскопические системы
- •2. Уравнение состояния. Нулевое начало термодинамики
- •3. Первое начало термодинамики
- •Газовые процессы:
- •4. Второе начало термодинамики.
- •Выводы Карно:
- •5. Энтропия и её статистический смысл Обратимые и необратимые процессы
- •Энтропия
- •Альтернативные формулировки второго начала термодинамики
Лекция №4 Термодинамический и статистический методы анализа систем и процессов Вступление
На прошлой лекции изучался закон сохранения механической энергии. Он гласит:
Кинетическая энергия Wкин – характеризует количество двигательной активности, присутствующей в системе
Потенциальная энергия Wпот – характеризует способность системы приобретать двигательную активность
Их сумма Wкин+Wпот=Wмех – полная механическая энергия системы
Если в системе нет неконсервативных сил, её полная механическая энергия сохраняется.
Другими словами, если в замкнутой системе присутствуют неконсервативные силы, её энергия не сохраняется. Куда же она девается? Мы знаем, что при трении поверхностей друг о друга (действие неконсервативной силы трения) поверхности нагреваются. Значит, пропадающая из системы механическая энергия переходит в другую форму – в тепловую энергию. Закономерности взаимного превращения механической и тепловой энергии и являются темой сегодняшней лекции.
1. Макроскопические системы
Мы уже выяснили, что все материальные объекты состоят из атомов и молекул. Тепловая энергия – не что иное как кинетическая энергия их механического движения.
Макроскопические системы – состоят из большого числа частиц.
Объект исследования:
Идеальный газ – взаимодействием между его молекулами можно пренебречь.
Закон Авогадро: равные объёмы любых газов в одинаковых условиях содержат одинаковое число молекул.
1 Моль – такое количество молекул, что его масса в граммах равна массе его молекулы в у.е. Это число – число Авогадро: Na=6,022∙1023 моль-1
Молярная масса μ – масса одного моля: μ(H2)=2 г; μ(O2)=32 г; μ(N2)=28 г; μ(воздух)=29 г.
Количество
вещества ν
– число
молей.
![]() .
.
Концентрация
– число молекул в единице объёма:
![]() .
.
Закон Авогадро: при нормальных условиях (t=0°С; p=1 атм=1∙105Па) один моль любого газа занимает одинаковый объём Vm = 22,4 л.
Вычислим концентрацию молекул в воздухе:

Вычислим среднее расстояние между молекулами газа:
![]()
Из-за огромного количества частиц поведение макросистем нельзя описывать методами механики, поэтому используют другие методы:
2. Уравнение состояния. Нулевое начало термодинамики
Способы описания макроскопических систем
Статистическая физика – использует микропараметры: масса молекул, их средняя скорость и т.п.
Термодинамика – использует макропараметры, характеризующие систему в целом:
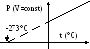 Объём
V;
Объём
V;Давление p: p=F/S; [p]=1 Н/м2=1 Па;
Температура T. Объяснить необходимость введения абсолютной температуры (см. рисунок справа)
T(K)=T(°C)+273.
Связь абсолютной температуры и энергии движения молекул
Физический смысл: абсолютная температура – мера интенсивности хаотического движения молекул газа.
Средняя кинетическая
энергия молекул газа:
![]() ,
гдеi
– число степеней свободы молекулы. Для
одноатомного газа: i=3;
для двухатомного: i=5.
Объяснить в связи с этим смысл абсолютного
нуля (кинетическая энергия не может
быть отрицательной) и процесса
теплопередачи.
,
гдеi
– число степеней свободы молекулы. Для
одноатомного газа: i=3;
для двухатомного: i=5.
Объяснить в связи с этим смысл абсолютного
нуля (кинетическая энергия не может
быть отрицательной) и процесса
теплопередачи.
Нулевое начало термодинамики
В состоянии термодинамического равновесия температура всех частей системы одинакова
Уравнение
состояния
– связь между давлением, объёмом и
абсолютной температурой. Уравнение
состояния идеального газа – уравнение
Менделеева-Клапейрона:
![]() ,
где
,
где![]() .
.
![]()
![]() ,
где
,
где
![]() – постоянная Больцмана. Показывает
увеличение энергии одной степени свободы
при увеличении температуры на 1 К.
– постоянная Больцмана. Показывает
увеличение энергии одной степени свободы
при увеличении температуры на 1 К.
Демонстрация «Закон Менделеева-Клапейрона» (Молекулярная физика №3)
Демонстрация «Атмосферное давление» (Молекулярная физика №1)
Теперь, когда мы описали все используемые в термодинамике величины, можно переходить к описанию превращений энергии.
