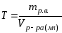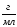- •НЕорганическая химия
- •Методические указания и задания к выполнению контрольной работы для студентов заочного обучения
- •Введение
- •Содержание разделов неорганической химии
- •1 Эквивалент. Закон эквивалентов. Моль-эквивалент Молярная масса эквивалента
- •Контрольные задания
- •2 Химическая кинетика и равновесие
- •3 Энергетика химических реакций
- •Контрольные задания
- •4 Растворы. Способы выражения содержания растворенного вещества в растворе
- •5 Электролитическая диссоциация.
- •6 Гидролиз солей
- •Контрольные задания
- •7 Строение атома. Периодическая система химических элементов
- •Контрольные задания
- •8 Химическая связь. Строение молекул.
- •Контрольные задания
- •9 Комплексные соединения
- •Контрольные задания
- •10 Окислительно – восстановительные реакции
- •Контрольные задания
- •11 Химия элементов
- •11. 1 Химия s- элементов
- •11.2 Химия р- элементов
- •11.3 Химия d-элементов
- •12 Библиография
4 Растворы. Способы выражения содержания растворенного вещества в растворе
Содержание растворенного вещества (р.в.) в растворе (р-р) можно выразить либо безразмерными единицами – долями или процентами, либо еличиинами размерными – концентрациями. В таблице 9 приведены некоторые способы выражения состава растворов:
Таблица 9 Способы выражения концентраций растворов
|
Способы выражения содержания р.в. в р-ре |
Обозначения и единицы измерения |
Математические выражения |
Размерности
| |
|
р.в. |
р-ра | |||
|
Массовая доля, ω |
m – масса (г, кг …) |
m = 100 единиц массы (г, кг …) |
|
%
-
|
|
Молярная концентрация или молярность, См |
nМ – число молей |
V=1л |
М – молярная масса, г/моль |
|
|
Эквивалентная концентрация или нормальность, Сн, N |
nЭ -число моль-эквивалентов |
V = 1л |
МЭ – молярная масса эквивалента; г/моль-экв. |
|
|
Титр, Т |
m- масса, г |
V=1 мл |
|
|
Решение задач на переход от одного способа выражения состава раствора к другому основано на использовании математических соотношений между различными единицами измерения компонентов растворов:
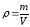
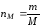
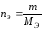
Пример 1
СМ→ ω; СН→ ω
1) Найти массу 1 л раствора (1 л = 1000 мл)
mр-ра = ρ ·V= ρ · 1000
2) Определить массу растворенного вещества в 1 л раствора
mр.в = СМ· М ·Vр-ра;mр.в = СН· МЭ·Vр-ра;Vр-ра= 1 л
3) Вычислить массовую долю растворенного вещества
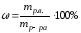
Пример 2.
ω → СМ; ω → СН
1) Найти массу 1 л раствора (см. пример 1)
2) Определить массу растворенного вещества в 1 л раствора
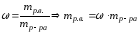
3) Вычислить число молей (моль-экв) растворенного вещества в 1 л раствора, т.е. См(СН):
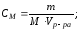
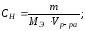 Vр-ра
= 1 л
Vр-ра
= 1 л
Пример 3
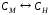
1 моль-экв
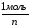

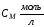 СН = СМ·n
СН = СМ·n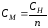
n– число реакционноспособных химических связей в веществе.
Для реакций, протекающих в растворах, состав которых выражен эквивалентной концентрацией, закон эквивалентов можно записать так:
СН,1·V1= СН,2·V2илиN1·V1=N2·V2
V– объем раствора, мл или л.
Эквивалентная концентрация растворов связана с его титром соотношением:

5 Электролитическая диссоциация.
Реакции электролитов как реакции ионов.
Электролиты– вещества, водные растворы и расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания, соли.
Электролитическая диссоциация– процесс распада электролита на ионы под воздействием молекул растворителя.
Примеры:
HCl↔H++Cl-
H3PO4↔H++H2PO-4↔ 2H++HPO42-↔3H++PO43-
KOH↔K++OH-
Mg(OH)2 ↔MgOH++OH-↔Mg2++ 2OH-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42-
Ca(HCO3)2 ↔ Ca2+ + 2HCO3-
AlOHCl2 ↔ AlOH2+ + 2Cl-
Поскольку вещества электронейтральны, общее число положительных зарядов катионов равно общему числу отрицательных зарядов анионов.
По степени электролитической диссоциации (α) различают электролиты: сильные (α > 30%), средние (2% < α < 30%), слабые (α < 2-3%).
Сильные электролиты:
многие минеральные кислоты: HCl,HBr,HI,HNO3,H2SO4,HClO4,HClO3,HMnO4;
основания щелочных и щелочноземельных металлов;
почти все растворимые соли (исключения: HgCl2,CdCl2,CdI2,Fe(CNS)3и некоторые другие);
Слабые электролиты:
некоторые минеральные кислоты: H2CO3,H2S,H2SO3,HNO2,HClO;
органические кислоты;
Н2О
NH4OH, основания большинства металлов (кроме щелочных и щелочноземельных).
Ортофосфорная кислота Н3РО4– электролит средней силы.
По теории электролитической диссоциации все реакции электролитов в водных растворах являются реакциями между ионами. Такие реакции представляют в виде ионных уравнений. При составлении ионных уравнений реакций каждое вещество записывается в той форме, которая для данного равновесного состояния в растворе является преобладающей; поэтому в виде ионов изображают только сильные растворимые электролиты, все остальные вещества (малодиссоциированные, малорастворимые, газообразные, а также неэлектролиты) записываются в молекулярном виде. Знак ↓ при формуле вещества показывает, что это вещество удаляется из сферы реакции в виде осадка, знак ↑ - в виде газа.
Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Составление уравнений реакций электролитов рекомендуется выполнять в определенной последовательности:
Составить молекулярное уравнение.
Определить природу исходных и образующихся веществ.
Переписать уравнение, изобразив каждое вещество в соответствующей форме (в виде ионов – сильные электролиты, в виде молекул – все остальные вещества).
Сравнить состав реагирующих и образующихся частиц, выявить одинаковые, следовательно, не принимающие участия в реакции, ионы.
Исключив одинаковые ионы, написать сокращенное ионно-молекулярное уравнение.
Сделать вывод о возможности необратимого протекания реакции. Необратимо протекают реакции в направлении наибольшего связывания ионовс образованием осадков, газов, слабых электролитов и комплексных ионов.
Если связывания ионов нет, то с точки зрения теории электролитической диссоциации реакция не происходит, но при выпаривании раствора будет получаться смесь из исходных веществ и продуктов их обмена.
Пример 1
СаСО3+ 2СН3СООН
Са(СН3СОО)2+ Н2О
+ СО2↑
малорастворимый слабый растворимый слаб. неэлектролит
электролит электролит сильный электролит электролит
СаСО3+ 2СН3СООН
Са2++ 2СН3СОО-+ Н2О + СО2↑
Реакция
протекает в прямом направлении, т.к. Н2О
более слабый электролит, чем СН3СООН
(Кдисс.Н О= 1,80 · 10-16< Кдисс. СН
О= 1,80 · 10-16< Кдисс. СН СООН= 1,85 · 10-5), а СО2уходит из
сферы реакции в виде газа.
СООН= 1,85 · 10-5), а СО2уходит из
сферы реакции в виде газа.
Пример 2
Са(NO3)2 + 2NH4Cl ↔ CaCl2 + 2NH4NO3
Растворимый растворимый растворимый растворимый
сильный сильный сильный сильный
. электролит электролит электролит электролит
Са2++ 2NO3-+ 2NH4++ 2Cl-↔ Са2++ 2Cl-+ 2NH4++ 2NO3-
Реакция не происходит, т.к. нет связывания ионов.
Для количественной оценки поведения электролитов в водных растворах в зависимости от их природы используются характеристики: степень диссоциации α, константа диссоциации Кдисс..
В водных растворах слабых электролитов устанавливается равновесие, для которого константа, называемая константой диссоциации, будет равна:
КtAn↔Kt++An-
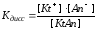
Из этого выражения следует, что Кдисс. будет иметь тем меньшее значение, чем меньше ионов в растворе, т.е. чем слабее электролит.
Константа диссоциации зависит от природы электролита, от природы растворителя, от температуры и не зависит от концентрации, поэтому является более общей характеристикой, чем степень диссоциации. Константа и степень диссоциации связаны между собой законом разбавления Оствальда:
KtAn↔Kt++An-
1 моль 1 моль 1 моль
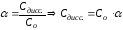
Со– молярная концентрация электролита в исходном состоянии;
Сдисс.– молярная концентрация диссоциированной части электролита.
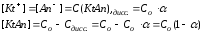
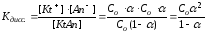
если α << 1, то
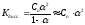 и
и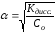
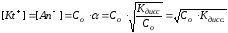
Нерастворимые и малорастворимые электролиты характеризуют произведением растворимости (ПР).
AgCl↔Ag++Cl-
Осадок р-р р-р
В соответствии с законом
действия масс, скорости прямой (υ) и
обратной (υ) реакций, равны:

υ = kυ=k· [Ag+]·[Cl-]



В состоянии равновесия:
υ = υ k=k· [Ag+]·[Cl-]



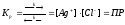
В общем виде для равновесия:
AmBn ↔ mAn+ + nBm-
ПР = [An+]m · [Bm-]n
При смешивании растворов электролитов осадок образуется, если произведение концентраций ионов превысит величину ПР.

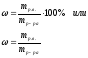
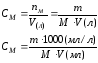
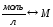
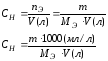
 н
н