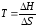- •НЕорганическая химия
- •Методические указания и задания к выполнению контрольной работы для студентов заочного обучения
- •Введение
- •Содержание разделов неорганической химии
- •1 Эквивалент. Закон эквивалентов. Моль-эквивалент Молярная масса эквивалента
- •Контрольные задания
- •2 Химическая кинетика и равновесие
- •3 Энергетика химических реакций
- •Контрольные задания
- •4 Растворы. Способы выражения содержания растворенного вещества в растворе
- •5 Электролитическая диссоциация.
- •6 Гидролиз солей
- •Контрольные задания
- •7 Строение атома. Периодическая система химических элементов
- •Контрольные задания
- •8 Химическая связь. Строение молекул.
- •Контрольные задания
- •9 Комплексные соединения
- •Контрольные задания
- •10 Окислительно – восстановительные реакции
- •Контрольные задания
- •11 Химия элементов
- •11. 1 Химия s- элементов
- •11.2 Химия р- элементов
- •11.3 Химия d-элементов
- •12 Библиография
3 Энергетика химических реакций
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии, чаще – в форме теплоты. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, идущие с выделением теплоты, называютэкзотермическими, с поглощением теплоты –эндотермическими.
При любом процессе соблюдается закон сохранения энергии. Теплота Q, поглощенная системой, идет на изменение внутренней энергии ΔUи на совершение работы:
Q= ΔU+ А
Внутренняя энергия системы U– это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия являетсяфункцией состояния, т.е. ее изменение определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс.
Теплота и работа не являются функциями состояния, они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А – это работа против внешнего давления, приближенно А = рΔV, где ΔV - изменение объема. Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (р = const,T=const) теплота (Qp) равна:
Qp = ΔU + A = ΔU + pΔV = (U2 – U1) + p(V2 – V1) =
= (U2 + pV2) – (U1 + pV1) = H2 – H1 = ΔH
Величину Н = U +pVназываютэнтальпией. Таким образом, теплота реакции в изобарно-изотермическом процессе стала равна изменению энтальпии (если единственным видом работы является работа расширения) и приобрела свойство функции состояния
Qp=ΔH
Теплота реакции в изохорно-изотермическом процессе (V=const,
T=const,ΔV= 0) равна изменению внутренней энергии системы:
QV=ΔU
Теплоты химических процессов, протекающих при р, Т = constиV, Т =const, называюттепловыми эффектами. При экзотермических реакциях энергия из системы выделяется, энтальпия уменьшается (Н2< Н1) иΔН < 0, а при эндотермических – энергия поглощается, энтальпия увеличивается,ΔН > 0.
Термохимические расчеты основаны на законе Гесса (1840 г):
тепловой эффект реакции зависит только от природы и физического
состояния исходных веществ и конечных продуктов, но не зависит
от пути перехода.
Часто в таких расчетах применяют следствие из закона Гесса: тепловой эффект реакции (ΔНх.р.) равен сумме теплот образованияΔНобрпродуктов реакции минус сумма теплот образования исходных веществ с учетом коэффициентов перед формулами веществ в уравнении реакции:
ΔНх.р= Σ(ni·ΔНi0)прод. - Σ(ni·ΔНi0)исх.
Тепловой эффект реакции не является единственным фактором, определяющим направление реакции. Самопроизвольно могут протекать и экзотермические и эндотермические реакции, а также – обратимые. Процесс называется самопроизвольным, если он осуществляется без каких-либо воздействий извне, когда система предоставлена самой себе. Тепловое движение частиц системы (молекул, атомов, ионов) вызывает стремление их к беспорядочному движению, к разбрасыванию на возможно больший объем, к переходу веществ из более упорядоченного состояния к менее упорядоченному; разупорядоченное состояние вещества более вероятно, чем упорядоченное.
Свойство вещества, отражающее специфические черты его теплового движения, называется энтропией (S).
В отличие от энтальпии абсолютную величину энтропии можно определить:
S=k·lnW, где
k– постоянная Больцмана–внутренняя энергия, реализуется в виде работы против внешнего давления 1 молекулой при изменении температуры на 1 градус.
W– вероятность, представляет собой число способов, позволяющих различным образом расположить данное число частиц в пространстве ( например, в кристаллической решетке, при Т = 0 (t0С = -273) для всех веществ существует только одна возможность расстановки частиц, т.е.W= 1 иS= 0. С увеличением температуры увеличивается движение частиц, увеличиваетсяW, увеличиваетсяS. Можно считать, что мера беспорядка примерно равна Т·ΔS. Энтропия является функцией состояния, т.е.
ΔS0х.р.= Σ(ni·Si0)прод. - Σ(ni·Si0)исх.
На направление химической реакции действуют две противоположные по сути тенденции: с одной стороны, частицы системы стремятся к объединению, образуя химические связи и, следовательно, к уменьшению внутренней энергии; с другой стороны – к достижению наиболее вероятного, разупорядоченного состояния, т.е. к увеличению энтропии. Общую движущую силу процесса отражает изменение изобарно-изотермического потенциала (энергии Гиббса G) ΔG:
ΔG= ΔН - Т · ΔS
Из выражения следует, что энергия Гиббса зависит от природы вещества, его количества, температуры и является функцией состояния, поэтому для этой энергетической характеристики процесса также справедливы и закон Гесса и следствие из него:
ΔG0х.р.= Σ(ni· ΔG0обр i)прод. – Σ(ni· ΔG0обр i)исх.
Убыль энергии Гиббса является мерой химического сродства. Самопроизвольно протекают процессы, идущие в сторону уменьшения любого потенциала, в частности, изобарно-изотермического:
G2<G1(G2–G1) < 0, т.е. ΔG< 0.
В состоянии равновесия Gне меняется, т.е.
G2=G1и ΔG= 0; ΔН – Т · ΔS= 0 и ΔН = Т · ΔS.
Температура, при которой наступает химическое равновесие, равна: