
- •НЕорганическая химия
- •Методические указания и задания к выполнению контрольной работы для студентов заочного обучения
- •Введение
- •Содержание разделов неорганической химии
- •1 Эквивалент. Закон эквивалентов. Моль-эквивалент Молярная масса эквивалента
- •Контрольные задания
- •2 Химическая кинетика и равновесие
- •3 Энергетика химических реакций
- •Контрольные задания
- •4 Растворы. Способы выражения содержания растворенного вещества в растворе
- •5 Электролитическая диссоциация.
- •6 Гидролиз солей
- •Контрольные задания
- •7 Строение атома. Периодическая система химических элементов
- •Контрольные задания
- •8 Химическая связь. Строение молекул.
- •Контрольные задания
- •9 Комплексные соединения
- •Контрольные задания
- •10 Окислительно – восстановительные реакции
- •Контрольные задания
- •11 Химия элементов
- •11. 1 Химия s- элементов
- •11.2 Химия р- элементов
- •11.3 Химия d-элементов
- •12 Библиография
1 Эквивалент. Закон эквивалентов. Моль-эквивалент Молярная масса эквивалента
Эквивалент - одно из стехиометрических понятий химии, указывает на равноценность количественных отношенийисходных и образующихся веществ в химической реакции. Такая равноценность обуславливается равенством числа разрывающихся химических связей в исходных веществах и образующихся - в продуктах реакции.
Пример:
Fe(OH)3+ 3HCl→FeCl3+ 3H2O
1 моль 3 моль 1 моль 3 моль
В графической форме:

1Fe(OH)3, 1HCl, 1FeCl3, 1HOН содержат различное число реакционно-способных химических связей и в этом смысле указанные количества этих веществ не равноценны, не эквивалентны.
Реакция произойдет, если на 3 разрывающиеся химические связи в Fe(OH)3будет приходиться 3 связи вHCl, что соответствует 3HCl. Как показывает приведенное выше уравнение, равноценными (другими словами, эквивалентными) по числу связей будут 1Fe(OH)3, 3HCl, 1FeCl3, 3HOН. Эквивалентными будут и такие доли молекул веществ, которые соответствуют возможности образования одной химической связи. Для 1 моля сложного вещества эта доля определит 1 моль-экв.

Масса одного моль – эквивалента сложного вещества, называемая молярной массой эквивалента, равна:

Число реакционноспособных химических связей в зависимости от состава и строения вещества можно выразить более конкретно:
|
Типы соединений |
nх. св. |
|
Кислоты |
nH+ |
|
Основания |
nOH- |
|
Соли |
nkt · Zkt = nAn · ZAn |
|
Оксиды |
nэлем.·Zэлем. =nO · ZO |
В рассматриваемой реакции:


Значения масс
эквивалентов сложных веществ можно
выразить через массы эквивалентов,
элементов или ионов его составляющих.
Заменив в выражении
 молярную массу на численно равную
относительную молекулярную (Мr),
молярную массу эквивалента – на
эквивалентную (Э), получим:
молярную массу на численно равную
относительную молекулярную (Мr),
молярную массу эквивалента – на
эквивалентную (Э), получим:

Эквивалентность реагирующих и образующихся веществ отражает закон эквивалентов, которому можно придать различные математические выражения:
nЭ,1 =nЭ,2=nэ,3= …
nЭ– число моль-эквивалентов

m– масса;V– объем;VЭ– объем одного моль-эквивалента газообразного вещества
2)

3)

Объем 1 моль - эквивалента газов имеет различные значения:
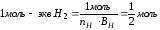
1 моль Н222,4 л х = 11,2 л
1 моль-экв→ ½ моль
х л

1 моль О222,4л х =
5,6 л
1 моль-экв → ¼ моль х л

Контрольные задания
1-20. Определите, чему равен 1 моль-экв исходных веществ, как доля от 1 моля
уравнения реакций приведены в таблице 2.
Таблица 2 Уравнения реакций
|
№ задания |
Уравнения реакций |
|
1 |
Fe(OH)3+HCl→Fe(OH)2Cl+H2O |
|
2 |
Fe(OH)3+ 2HCl→FeOHCl2+ 2H2O |
|
3 |
2Fe(OH)3+ 3H2SO4→Fe2(SO4)3 + 6H2O |
|
4 |
CuOHNO3 + H2S → CuS + HNO3 + H2O |
|
5 |
Na2HPO4 + AlCl3 → AlPO4 + 2NaCl + HCl |
|
6 |
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2 |
|
7 |
Al(OH)2Cl + KOH → Al(OH)3 + KCl |
|
8 |
H3PO4 + 3NaOH → Na3PO4 + 3H2O |
|
9 |
H3PO4 + 2NaOH → Na2HPO4 + 2H2O |
|
10 |
H3PO4 + NaOH → NaH2PO4 + H2O |
|
11 |
Fe(OH)2CH3COO + 3HNO3 → Fe(NO3)3 + CH3COOH + 2H2O |
|
12 |
KH2PO4 + KOH → K2HPO4 + H2O |
|
13 |
KH2PO4 + 2KOH → K3PO4 + 2H2O |
|
14 |
Bi(OH)2NO3 + KOH → Bi(OH)3 + KNO3 |
|
15 |
Fe(OH)2Cl + 2HCl → FeCl3 + 2H2O |
|
16 |
K2HPO4 + KOH → K3PO4 + H2O |
|
17 |
Na2HPO4 + CaCl2 → CaHPO4 + 2NaCl |
|
18 |
K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2 |
|
19 |
2FeSO4 + 2KOH → (FeOH)2SO4 + K2SO4 |
|
20 |
FeSO4 + 2KOH → Fe(OH)2 + K2SO4 |
21. На нейтрализацию 7,330 г фосфорноватистой кислоты Н3РО2пошло 4,444 гNaOH. Вычислите эквивалентную массу кислоты, ее основность (nН+) и напишите уравнение реакции нейтрализации.
22. При восстановлении 6,50 г оксида образовалось 4,45 г металла. Вычислите молярные массы эквивалентов металла и его оксида.
23. При нейтрализации 9,8 г ортофосфорной кислоты израсходовано 8 г NaOH. Вычислите эквивалентную массу и основность (nН+) кислоты в этой реакции. На основании расчета напишите уравнение реакции.
24. В какой массе NaOHсодержится столько же моль – эквивалентов, что и в
140 г КОН?
25. При взаимодействии 2,5 г карбоната металла с азотной кислотой образовалось 4,1 г нитрата этого же металла. Вычислите эквивалентную массу металла.
26. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла.
27. Некоторый элемент образует кислородное соединение, содержащее 31,58 % кислорода. Вычислите эквивалентную и атомную массу этого элемента, если в данном оксиде он трехвалентен. Составьте формулу оксида.
28. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите массу эквивалента металла; чему равна его атомная масса?
29. Какой объем (н.у.) занимает 1 моль – эквивалент водорода? Сколько литров водорода (н.у.) выделилось при растворении в кислоте 0,45 г металла, молярная масса эквивалента которого равна 20 г/моль-экв?
30. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
31. Является ли эквивалент элемента постоянной величиной? Чему равны эквивалентные массы хрома в его оксидах, содержащих 68,42 % и 52,00 % хрома. Определите валентность хрома в каждом из этих оксидов и составьте их формулы.
32. Трехвалентный элемент образует оксид, содержащий 31,58 % кислорода. Вычислите эквивалентную и атомную массу этого элемента. Составьте формулу оксида.
33. При окислении 8,37 г двухвалентного металла образовалось 10,77 г оксида. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
34. При взаимодействии 1,62 г трехвалентного металла с кислотой выделяется 2,015 л водорода (н.у.).Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
35. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла.
36. При окислении 1,674 г двухвалентного металла образовалось 2,154 г оксида. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
37. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите эквивалентную массу металла и объем выделившегося водорода (н.у.)
