
ТПУ май 2012
.pdf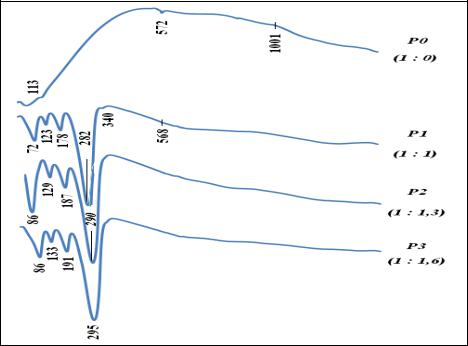
Присутствие на кривой ДТА эндотермического эффекта при температуре 572°С обусловлено полиморфизмом кварцевой составляющей, присутствующей, как было установлено, в данной породе в значительном количестве (бо-
лее 50%).
Де ривато-
графические исследования при фторировании пирофиллита показали, что присутствие гидродифторида аммония в составе шихты влияет на поведение пирофиллита при нагревании, меняя температурный интервал процесса дегидратации минерала.
В частности, на кривых ДТА смесей породы и гидродифторида аммония присутствуют интенсивные эндотермические эффекты, отражающие реакции взаимодействия составляющих пирофиллитовой породы с гидродифторидом аммония. Первый эндотермический эффект при температурах 72 - 86°С связан с взаимодействием гидродифторида аммония с физически связанной водой и выделением аммиака. Два последующих эндотермических эффекта с минимумами при температурах 123 - 133°С и 178 - 191°С связаны с плавлением и испарением избыточного или непрореагировавшего ГДФА.
Эндотермический эффект при температурах 282 - 295°С обусловлен сублимацией образовавшегося при взаимодействии гидродифторида аммония с оксидом кремния гексафторосиликата аммония.
Подробное изучение процессов фторирования пирофиллита позволит расширить список природных материалов, пригодных для получения муллита.
НАНОМАТЕРИАЛЫ С НЕМЕТАЛЛИЧЕСКОЙ МАТРИЦЕЙ Кривоногов В.С., студент
Национальный исследовательский Томский политехнический университет
Композиционные материалы с неметаллической матрицей нашли широкое применение. В качестве неметаллических матриц используют полимерные, углеродные и керамические материалы. Из полимерных матриц наибольшее распространение получили эпоксидная, фенолоформальдегидная и полиимидная. Угольные матрицы коксованные или пироуглеродные получают из синтетических полимеров, подвергнутых пиролизу. Матрица связывает композицию, придавая ей форму. Упрочнителями служат волокна: стеклянные, углеродные, борные, органические, на основе нитевидных кристаллов (оксидов, карбидов, боридов, нитридов и др.), а также металлические (проволоки), обладающие высокой прочностью и жесткостью.[1]
101

Общие сведения, состав и классификация
Рис.1. Схемы армирования композиционных материалов Свойства композиционных материалов зависят от состава компонентов, их сочетания, ко-
личественного соотношения и прочности связи между ними. Армирующие материалы могут быть в виде волокон, жгутов, нитей, лент, многослойных тканей.
Содержание упрочнителя в ориентированных материалах составляет 60–80 об.%, в неориентированных (с дискретными волокнами и нитевидными кристаллами) – 20–30 об.%. Чем выше прочность и модуль упругости волокон, тем выше прочность и жесткость композиционного материала. Свойства матрицы определяют прочность композиции при сдвиге и сжатии и сопротивление усталостному разрушению.[2]
По виду упрочнителя композиционные материалы классифицируют на стекловолокниты, карбоволокниты с углеродными волокнами, бороволокниты и органоволокниты.
В слоистых материалах волокна, нити, ленты, пропитанные связующим, укладываются параллельно друг другу в плоскости укладки. Плоскостные слои собираются в пластины. Свойства получаются анизотропными. Для работы материала в изделии важно учитывать направление действующих нагрузок. Можно создавать материалы как с изотропными, так и с анизотропными свойствами. Можно укладывать волокна под разными углами, варьируя свойства композиционных материалов. От порядка укладки слоев по толщине пакета зависят изгибные и крутильные жесткости материала.[3]
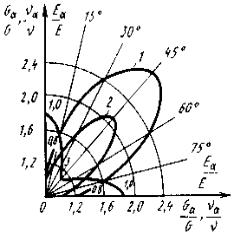
Рис.2. Зависимость между напряжением и деформацией при растяжении эпоксидного углепластика с различной схемой укладки упрочнителя: 1 – продольная; 2 – под углом 45є; 3 – взаимно перпендикулярная; 4 – поперечная
102
Применяется укладка упрочнителей из трех, четырех и более нитей (рис.1). Наибольшее применение имеет структура из трех взаимно перпендикулярных нитей. Упрочнители могут располагаться в осевом, радиальном и окружном направлениях.[4]
Трехмерные материалы могут быть любой толщины в виде блоков, цилиндров. Объемные ткани увеличивают прочность на отрыв и сопротивление сдвигу по сравнению со слоистыми. Система из четырех нитей строится путем расположения упрочнителя по диагоналям куба. Структура из четырех нитей равновесна, имеет повышенную жесткость при сдвиге в главных плоскостях. Однако создание четырехнаправленных материалов сложнее, чем трех-направленных. Зависимость механических свойств композиционных материалов от схемы армирования приведена на рис.2.
Карбоволокниты Карбоволокниты (углепласты) представляют собой композиции, состоящие из полимерного
связующего (матрицы) и упрочнителей в виде углеродных волокон (карбоволокон).
Высокая энергия связи С–С углеродных волокон позволяет им сохранять прочность при очень высоких температурах (в нейтральной и восстановительной средах до 2200°С), а также при низких температурах. От окисления поверхности волокна предохраняют защитными покрытиями (пиролитическими). В отличие от стеклянных волокон карбоволокна плохо смачиваются связующим (низкая поверхностная энергия), поэтому их подвергают травлению. При этом увеличивается степень активирования углеродных волокон по содержанию карбоксильной группы на их поверхности. Межслойная прочность при сдвиге углепластиков увеличивается в 1,6–2,5 раза. Применяется вискеризация нитевидных кристаллов TiO2, AlN и Si3N4, что дает увеличение межслойной жесткости в 2 раза и прочности в 2,8 раза. Применяются пространственно армированные структу-
ры.[4]
Связующими служат синтетические полимеры (полимерные карбоволокниты); синтетические полимеры, подвергнутые пиролизу (коксованные карбоволокниты); пиролитический углерод (пироуглеродные карбоволокниты).
Рис.3. Значения модулей упругости (1), сдвига (2) и коэффициентов Пуассона (3) под углом к главному направлению композиционного материала, образованного системой трех нитей
Эпоксифенольные карбоволокниты КМУ-1л, упрочненный углеродной лентой, и КМУ-ly на жгуте, вискеризованном нитевидными кристаллами, могут длительно работать при температуре до
200°С.
Карбоволокниты КМУ-3 и КМУ-Зл получают на эпоксиани-линоформальдегидном связующем, их можно эксплуатировать при температуре до 100°С, они наиболее технологичны. Карбоволокниты КМУ-2 и КМУ-2л на основе полиимидного связующего можно применять при температуре до 300°С.
Карбоволокниты отличаются высоким статическим и динамическим сопротивлением усталости (рис.3), сохраняют это свойство при нормальной и очень низкой температуре (высокая теплопроводность волокна предотвращает саморазогрев материала за счет внутреннего трения). Они водо- и химически стойкие. После воздействия на воздухе рентгеновского излучения σИЗГ и Е почти не изменяются.[5]
103
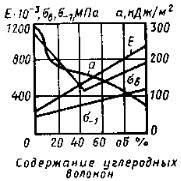
Рис.4. Зависимость модуля упругости Е, предела прочности σВ, ударной вязкости а и сопротивления усталости σ-1 карбостекловолокнита от содержания углеродных волокон (общее содержание наполнителя в композиции 62 об.%)
Теплопроводность углепластиков в 1,5–2 раза выше, чем теплопроводность стеклопластиков. Они имеют следующие электрические свойства: ρV=0,0024ч0,0034 Ом∙см (вдоль волокон); е=10 и tgδ=0,01 (при частоте тока 1010 Гц).
Карбостекловолокниты содержат наряду с угольными стеклянные волокна, что удешевляет материал. Зависимость механических свойств модифицированного карбоволокнита от содержания углеродных волокон показана на рис.4.
Список литературы:
1.Гуляев А.П. «Металловедение», М.: 1968.
2.Дальский А.М. «Технология конструкционных материалов», М.: 1985.
3.Куманин И.Б. «Литейное производство», М.: 1971.
4.Лахтин Ю.М. «Материаловедение», М.: 1990.
5.Семенов «Ковка и объемная штамповка», М.: 1972.
ПРИМЕНЕНИЕ ИМПУЛЬСНОГО ТОКА ПРИ ЭЛЕКТРОЛИЗНОМ ПОЛУЧЕНИИ МЕТАЛЛИЧЕСКОГО ТИТАНА В РАСПЛАВЕ LIF-NAF-KF
Кривошеев А.С, Ворошилов Ф.А.
Национальный исследовательский Томский политехнический университет
Одним из способов получения металлического титана является электролиз трифторида титана в расплаве фторидов щелочных металлов. Проведенные нами ранее исследования показали возможность реализации данного способа в промышленном масштабе [1]. Однако при проведении электролиза со стабилизированным значением потенциала или тока не удается добиться выхода металла в катодный осадок выше 30%. Остальная масса приходится на электролит. При введении TiF3 в расплав фторидов щелочных металлов, из-за высокой способности титана к комплексообра-
зованию, происходит образование сложных соединений типа K3TiF6, KNa2TiF6, Li3TiF6. По-
скольку титан находится в расплаве в анионной форме, то процесс восстановления затруднен. Поэтому механизм восстановления металлического титана состоит из двух этапов: первоначальное восстановление ионов щелочных металлов на катоде, например калия, а затем активный калий восстанавливает, в свою очередь, титан. Литературный поиск показал, что применение импульсного тока может привести к увеличению доли металлического титана в осадке [2]. Минимальное время импульса определяется скоростью восстановления калия на катоде. Длительность паузы снижает количество электричества пропущенного в единицу времени, снижая тем самым общий выход по времени. Необходимо подобрать оптимальное соотношение между длительностью импульса и паузы.
Для проведения опытов экспериментальная установка была дополнена импульсным источником питания, формирующим импульсы прямоугольной формы [3]. Длительность импульса и паузы можно было задавать в широких пределах. Двухлучевой запоминающий осциллограф служил для записи формы потенциала и тока, протекающих через ячейку. Все опыты проводили при одинаковых начальных параметрах: температура 650°С, напряжение 3,0 В, содержание титана в расплаве 5% масс. Длительность опыта составляла 1 час. Каждые 10 минут снимались показания на осциллографе. Был проведен ряд экспериментов, в ходе которых изменяли время импульса от 5 до 25 мс, время паузы от 5 до 100 мс. Отмечено, что форма сигнала тока меняется в ходе проведения процесса электролиза в зависимости от скважности импульсов. При длительности импульса
104
менее 5 мсек и скважности 1 катодный осадок практически не формируется из-за малой скорости образования калия на катоде. Увеличение длительности импульса до 25 мсек, а скважности до 4 приводит к формированию плотного катодного осадка, состоящего из мелких кристаллов. Катодную грушу измельчали и растворяли в воде. Для гарантированной отмывки от LiF, содержащегося в катодном осадке, использовали большие объемы воды при постоянном нагреве. Нерастворенный осадок, предположительно металлический титан, растворяли плавиковой кислотой и осаждали аммиаком в виде гидроокиси. Осадок прокаливали при температуре 650°С для перевода гидроокиси в диоксид титана. Полученный результат пересчитывали на металл. Наилучший результат, достигнутый нами на сегодняшний момент, составил более 70% титана в катодном осадке. Это доказывает, что импульсный электролиз более эффективный процесс, чем электролиз на постоянном токе. При меньших затратах энергии увеличивается выход по току и катодный осадок содержит гораздо меньше электролита. Цель дальнейших исследований – подбор параметров, позволяющих добиться максимального выхода титана.
Список литературы:
1. Ворошилов Ф.А., Дьяченко А.Н. Исследование процесса электролиза (NH4)3TiF6 в расплаве LiF-NaF-KF // Современные проблемы науки и образования. 2011. Вып. 11.
2.Никифорова Е.Ю., Килимник А.Б. Закономерности электрохимического поведения металлов при наложении переменного тока // Вестник ТГТУ. 2009. Т. 15. Вып. 3.
3.Костин Н.А. Импульсный электролиз. Киев: Наукова Думка, 1989. 169 с.
РАСЧЕТ В MATHCAD ПО ГОСТ Р 52857.2-2007 КОНИЧЕСКИХ ОБЕЧАЕК, НАГРУЖЕННЫХ ДАВЛЕНИЕМ
Копылов А.С.
Национальный исследовательский Томский политехнический университет
Для облегчения рутинной работы при проектировании сосудов и аппаратов нами по ГОСТ Р 52857.2-2007 [1] разработан алгоритм и программа расчета конических обечаек сосудов и аппаратов, работающих под избыточным внутренним давлением или под наружным давлением. Для обечайки с известными геометрическими размерами программа определяет исполнительную толщину стенки, удовлетворяющую условиям прочности и устойчивости, проверяет необходимые условия и выдает пользователю результаты расчета, по которым он может сделать вывод о приемлемости выбранной конструкции или изменить ее размеры и повторить расчет.
Программа составлена в среде MathCAD, позволяющей производить вычисления на распространенных персональных компьютерах и выдавать отчет в соответствии с требованиями норм и методов расчета на ЭВМ [2]. Это позволяет сделать выводы о прочности, устойчивости, необходимых толщинах элементов конструкции и других параметрах, оценка которых предусмотрена используемым стандартом, и, в случае необходимости, провести полную проверку выполненного расчета.
Для удобства работы предусмотрена возможность скрывать отдельные части программы не участвующие в расчете. При составлении программы использовались различные методы и приемы решения:
автоматический выбор различных коэффициентов из баз данных;
расчет значений методом интерполяции;
КОМБИНИРОВАННЫЕ МЕТОДЫ РАСЧЕТА.
Список литературы:
1.ГОСТ Р 52857.2-2007 Сосуды и аппараты. Нормы и методы расчета на прочность. Расчет цилиндрических и конических обечаек, выпуклых и плоских днищ и крышек.
2.Рачков В.И., Зусмановская С.И., Вольфсон Б.С. Новый сборник российских национальных стандартов по расчету на прочность сосудов и аппаратов // журнал "химическое и нефтегазовое машиностроение". 2008. Вып. 7.
105
АДСОРБЦИЯ ОКИСИ УГЛЕРОДА И ГАЗОВ ВОЗДУШНОЙ СМЕСИ НА ПОВЕРХНОСТИ ДИСПЕРСНЫХ МАТЕРИАЛОВ НА ОСНОВЕ СЛОЖНЫХ ОКСИДОВ МЕТАЛЛОВ И НИКЕЛЯ
Кудрявцева В.С., Селянин А.С., Савостиков Д.В. Национальный исследовательский Томский политехнический университет
Для снижения содержания окиси углерода в отработанных газах двигателей внутреннего сгорания и промышленных выбросов используются катализаторы окисления на основе платины и палладия. Основным недостатком таких устройств является их высокая стоимость.
С целью поиска альтернативных материалов нами были проведены исследования адсорбции газов воздушной смеси на поверхности дисперсных материалов на основе сложных оксидов ме-
таллов: CoO:NiO:MnO2:CeO2, CuO:CoO:Cr2O3:NiO:MnO2, CuO:Cr2O3:CoO, CuO:Cr2O3, и никеля
методами термодесорбционной спектрометрии и синхронным термическим анализом. Анализ поверхности дисперсных материалов был проведен методом ИКспектроскопии.
Предварительно обезгаженные образцы находились на воздухе в течении 4 часов при тем-
пературе t=20 =75%.
Методом термодесорбционной спектрометрии на масс-спектрометре МХ-7203 был определен состав газов, адсорбированных на поверхности металлов и сложных оксидов металлов, который оказался идентичным как для металлов, так и для сложных оксидов металлов. Основными компонентами являются H2, O2, N2, H2O, CO, CO2 и NO2. В результате анализа для всех образцов
замечена ярко выраженная селективность по отношению к оксиду углерода, который составил от 4-20% объема у сложных оксидов металлов до 73% объема у никеля. Согласно методике [1] проведен расчет основных кинетических параметров процессов десорбции газов с поверхности образцов. Результаты расчетов приведены в таблице 1.
В отличие от оксидов металлов, выделение окиси углерода с поверхности никеля происходит в две стадии с большими энергиями активации десорбции, а для углекислого газа обнаружена слабая форма адсорбции. Кроме того, у образцов оксидов отмечено большое газонасыщение молекулярным кислородом.
Изучение поверхности никеля проводилось методом ИК-спектроскопии на ИК-Фурье спек-
трометре Nicolet 5700.
Таблица 1. Кинетические параметры десорбции газов с поверхности образцов никеля,
CuO:CoO:Cr2O3:NiO:MnO2 – 1, CuO:Cr2O3 – 2, CuO:Cr2O3:CoO – 3, CoO:NiO:MnO2:CeO2 – 4.
образец |
Газ,% объема |
Энергия актива- |
Фактор частоты, |
Порядок реакции |
||
ции, Дж/моль |
с-1 |
|||||
|
|
|
|
|||
никель |
CO (15%) |
67564 |
1,84·108 |
первый |
||
87492 |
1,35·1012 |
второй |
||||
|
|
|
||||
|
CO2 |
(73%) |
28752 |
3,1·105 |
первый |
|
1 |
CO (4%) |
30223 |
3,18·105 |
первый |
||
|
CO2 |
(5%) |
61784 |
2,25·108 |
второй |
|
2 |
CO (10%) |
26074 |
1,06·105 |
второй |
||
|
CO2 |
(67%) |
57878 |
9,08·107 |
второй |
|
3 |
CO (5%) |
29882 |
5,12·105 |
первый |
||
|
CO2 |
(21%) |
38855 |
9,41·106 |
первый |
|
4 |
CO (4%) |
39895 |
5,93·105 |
первый |
||
|
CO2(10%) |
53789 |
7,21·108 |
первый |
||
В ходе анализа полученных данных обнаружены спектры поглощения, соответствующие валентным колебаниям молекул окиси углерода на поверхности никеля. Резкие полосы спектра с
частотами 1692 см-1, 1651 см-1, 1553 см-1 соответствуют образованию мостика между двумя ато-
мами никеля группой СО, а линии с частотами 1483 см-1, 1435 см-1 и 1331 см-1 свидетельствует о наличии мостиковой группы между Ni и СО через атом кислорода. Широкая полоса в спектре, с
характерными частотами 2372 см-1, 2354 см-1, 2297 см-1 свидетельствует о наличии свободных атомов СО2 на поверхности никеля [2].
В ходе проведения синхронного термического анализа был выявлено, что изменение массы образца в результате адсорбции газов воздушной смеси на поверхности никеля сопровождается выделением тепла, которое составило 7,1 Дж/г.
106
Полученные результаты исследований позволяют с достаточной уверенностью утверждать о наличии селективной адсорбции СО поверхностью образцов, с последующим окислением до СО2 и разрывом химической связи между атомами поверхности и углекислым газом.
Список литературы:
1.Aart A. van Gorkum // J. Appl. Phys. May 1980. Vol. 51. No. 5. p. 2594 –2601.
2.Накамото К. ИК спектры и спектры КР неорганических и координационных соединений.
М.: Мир. 1991. 536 с.
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ МЕДИ ПОД ДЕЙСТВИЕМ ПЕРЕМЕННОГО ТОКА ПРОМЫШЛЕННОЙ ЧАСТОТЫ В РАСТВОРЕ ЭЛЕКТРОЛИТА KCL
Лежнина М.И. , студент
Рассмотрено влияние состава и концентрации электролита на скорость электрохимического окисления металлической меди под действием переменного тока промышленной частоты.
Электрохимический синтез оксидов металлов на переменном токе позволяет получать оксиды металлов с условным диаметром первичных частиц в нанометровом диапазоне. Высокая дисперсность, развитая поверхность, наличие преобладающего объема мезопор и низкое содержание примесей в продуктах электрохимического синтеза положительно отличают их от оксидов металлов, приготовленных другими методами [1, 4].
Основное преимущество данного способа – возможность получения очень чистых гидроксидов и оксидов, а регулирование электрических параметров процесса электролиза позволяет формировать порошки с заданной дисперсностью, что еще более повышает его практическую ценность. Установлено, что наибольшее влияние на скорость процесса образования фазовых оксидов металлов оказывают следующие факторы: состав и концентрация электролита, температура электролиза и плотность переменного тока является технологическим параметром, наиболее интенсифицирующим процесс электролиза [2-4]. В большинстве случаев удельная площадь поверхности оксидов металлов растет с увеличением плотности переменного тока.
Одной из определяющих тенденций развития существующих промышленных методов получения неорганических веществ путем электролиза является интенсификация электрохимических процессов за счет увеличения плотности тока, несмотря на повышение расхода электрической энергии. Экономическая эффективность в этом случае достигается за счет повышения производительности электролизеров, снижения капитальных затрат и существенного улучшения качества продукции [4].
При использовании постоянного тока основным затруднением для повышения плотности тока является возникновение пассивного состояния анодов и, как следствие, торможение процесса и получение некачественных продуктов. Применительно к оксидам металлов это выражается в уменьшении их активной поверхности, сокращении пористости. Наиболее действенные методы, позволяющие снять пассивацию, предполагают применение нестационарных режимов проведения электролиза. Одним из таких приемов является использование переменного тока, который позволяет дополнительно упростить аппаратурное обеспечение процесса и снизить энергетические затраты на его проведение. Таким образом, значительный интерес для решения важнейшей задачи обеспечения страны нанопорошками представляют электрохимические процессы с разрушением металлических электродов под действием переменного тока с образованием гидратированных и негидратированных оксидов, которые можно выделить в качестве самостоятельной фазы [4].
Изучение электрохимического окисления металлов с использованием переменного тока приобретает актуальность не только для синтеза чистых оксидов металлов, но и в связи с получением экспериментальных данных по коррозионной стойкости металлов под действием токов промышленной частоты. Закономерности процессов, протекающих с использованием переменного тока, сложны и требуют дальнейшего изучения [4].
Электрохимический синтез имеет ряд преимуществ перед известными технологиями. Вопервых, он позволяет получить нанопорошки высокой чистоты. Эффект очистки непосредственно связан с механизмом образования фазовых оксидов металлов и свойственен электрохимическим процессам, протекающим под действием переменного тока Рафинирование происходит за счет высвобождения ионов примесей из решетки металла или оксида при циклическом действии поляризующего напряжения, что невозможно осуществить в процессах получения нанодисперсных оксидов металлов другими методами. Во-вторых, обеспечивает экологически чистое и практически безотходное производство [5,6].
В данной работе проводились исследования скорости разрушения меди при электролизе переменным током промышленной частоты в растворе KCl. Эксперименты проводились при посто-
107
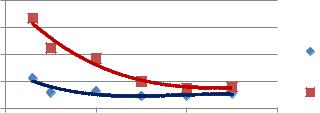
янной температуре (90оС) и плотности тока 1 и 2 А/см2, концентрация раствора электролита изменялась от 3 до 25%. Скорость разрушения меди определялась по убыли массы электродов весовым методом [5]. По результатам экспериментов были получены следующие значения, представленные в табл.1.
Табл.1. Влияние природы и концентрации электролита на скорость разрушения меди при плотности тока 1 А/см2 и температуре 90 0С
Концентрация |
электро- |
3% |
5% |
10% |
15% |
20% |
25% |
|||
лита( KCl), % масс. |
||||||||||
|
|
|
|
|
|
|||||
|
Скорость |
|
разру- |
|
|
|
|
|
|
|
шения |
меди |
в |
KCl, |
0,0226 |
0,0119 |
0,0129 |
0,009 |
0,0093 |
0,0109 |
|
г/см2∙ч при плотности |
||||||||||
тока 1 А/см2 |
|
|
|
|
|
|
|
|
||
|
Скорость |
|
разру- |
|
|
|
|
|
|
|
шения |
меди |
в |
KCl, |
0,067 |
0,0045 |
0,0037 |
0,02 |
0,015 |
0,016 |
|
г/см2∙ч при плотности |
||||||||||
тока 2 А/см2 |
|
|
|
|
|
|
|
|
||
По данным таблицы 1 была построена зависимость скорости разрушения меди от концен- |
||||
трации электролита при постоянной температуре и плотности тока представленная на рис.1 |
||||
|
График зависимости скорости разрушения электрода от |
|||
ч |
|
концетрации электролита |
||
* |
|
|
|
|
2 |
|
|
|
|
Скоростьразрушения электрода, г/ см |
0,08 |
|
|
|
0,06 |
|
|
|
|
0,04 |
|
|
при плотности тока 1 |
|
0,02 |
|
|
А/см2 |
|
|
|
при плотности тока 2 |
||
|
|
|
||
0 |
|
|
А/см2 |
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
|
|
Концентрация электролита, % масс |
|
|
.Рис.1. Зависимость скорости разрушения меди от концентрации электролита при постоянной тем- |
||||
пературе (900С) и плотности тока (1 и 2 А/см2) |
|
|
||
Из рис. 1 видно, что с ростом концентрации KCl в интервале 3–25% масс. скорость окисления меди уменьшается. Максимальная скорость окисления наблюдается в 3 %-ном растворе KCl, и составляет 0,0226 и 0,067 г/см2∙ч соответственно. Исходя из полученных результатов, можно сделать вывод о том, что при увеличении плотности тока скорость разрушения электрода также растет. Также скорость разрушения электрода зависит от химической природы образующихся на поверхности электрода оксидов и растет с увеличением плотности тока при исследуемом температурном режиме [4].Таким образом, чтобы увеличить выход продукта, необходимо увеличить плотность тока до оптимального уровня.
Список литературы:
1.Коновалов Д.В., Коробочкин В.В., Ханова Е.А. Электрохимический синтез оксида цинка на переменном токе // Известия ТПУ. – Томск, 2003. – Т. 306. – № 5. – С. 67–71.
2.Коробочкин В.В., Косинцев В.И., Быстрицкий Л.Д., Ковалевский Е.П. Получение геля гидроксида алюминия электролизом на переменном токе // Неорганические материалы. – 2002. – Т. 38. – № 9. – С. 1087–1090.
3.Коробочкин В.В., Усольцева Н.В., Горлушко Д.А., Балмашнов М.А. Закономерности синтеза нанодисперсных оксидов меди электролизом на переменном токе в растворе щелочи //Известия ТПУ. – 2010 – Т. 317. – № 3. – С. 13-16.
4.Коробочкин В.В. Процессы получения нанодисперсных оксидов с использованием электрохимического окисления металлов при действии переменного тока. Томский политехнический университет. Томск 2004. - 273л.
5.Ускоренные методы коррозионных испытаний. / Розенфельд И.Л., Жиганова К.А. – М.: Металлургия, 1966. – 347 с.
108

6. Е.Ю. Никифорова, А.Б. Килимник. Закономерности электрохимического поведения металлов при наложении переменного тока// Вестник ТГТУ, 2009. –614с.
CИНТЕЗ И СВОЙСТВА СИЛИКОФОСФАТНЫХ ТОНКОПЛЕНОЧНЫХ МАТЕРИАЛОВ Лютова Е.С., Каминская Т.А.
Национальный исследовательский Томский государственный университет
В течение последних десятилетий интенсивное развитие получили методы синтеза разнооб- и- тию золь-гель технологии, относится к композициям на основе SiO2, состав которых постоянно
расширяется. Особое место занимают сложные оксиды, применяемые в виде высокодисперсных порошков, биокерамик, пленок и покрытий, мембранных материалов, стекол. К преимуществам золь-гель технологий относится возможность получения материалов заданного состава, морфологии, размера, а также существенно снизить время и температуру синтеза. Цель настоящей работы
– золь - гель синтез пленкообразующих растворов системы SiO2-P2O5-СаO, на основе тетроэтоксисилана, этилового спирта, фосфорной кислоты, хлорида кальция, а также исследовать процессы, протекающие в пленкообразующих растворах, изучить процессы формирования наноструктурных систем и исследовать структуры, фазовый состав, физико-химические и целевые свойства полученных тонкопленочных и дисперсных систем в зависимости от условий получения.
Для получения пленок использовали пленкообразующие растворы (ПОР), которые готовили на основе 96 % этилового спирта, тетроэтоксисилана, ортофосфорной кислоты, хлорида кальция, определенного состава. Пленки получали на подложках из кремния методом центрифугирования и вытягивания со скоростью вращения центрифуги 3000 об/мин и со скоростью вытягивания 5 мм/с. Формирование пленок проводили в два этапа на воздухе в сушильном шкафе при температуре 60°С и в муфельной печи при температуре 600°С. Для изучения пленкообразующей способности растворов измеряли их вязкость с помощью стеклянного вискозиметра (ВПЖ-2, с диаметром капилляра 0,99 мм). Термический анализ исходных веществ и порошков высушенных гидролизованных ПОР проведен на на NETSCH STA 499C. Фазовый состав синтезированных пленок устанавливали на дифрактометре ДРОН-3М при использовании характеристического излучения медного анода CuK ( = 1,5418 нм). Толщину и показатель преломления полученных пленок исследовали на лазерном эллипсометре ЛЭФ-3М ( = 632,8 нм), измерения проводили в 5 точках по всей поверхности пленок для каждого образца, расчеты оптических параметров проводили по модели однородного непоглощающего слоя на изотропной подложке.
Как показали исследования, вязкость растворов увеличивается с течением времени во всех системах за счет процессов гидролиза и поликонденсации. При возрастании концентрации CaO от
10 до 50 %, а P2O5 от 10 до 30 % ηсут изменяется в диапазоне 3,3÷3,9·10-3 Па·с. Увеличение в системе содержания фосфорной кислоты приводит к взаимодействию с силанолами через образова-
ние шестичленных активных комплексов. Начальное значение pH в составах изменяется в интервале 2÷3,5. Повышение кислотности среды на первом этапе приводит к ускорению процессов гидролиза и поликонденсации и как следствие к повышению вязкости ПОР. С другой стороны вязкость растворов увеличивается и за счет введения в систему соли кальция, которая стабилизирует силикатный гель и формирует трехмерную структуру.
Данные термического анализа показывают, что процесс получения тонкопленочных и дисперсных материалов происходит в три стадии. Сначала происходит удаление физически связанной и химически связанной воды. Вторая стадия обусловлена сгоранием спирта и продуктов термоокислительной деструкции этоксигрупп, а третья стадия связана с полиморфными превращениями
SiO2.
Толщина полученных пленок находится в пределах от 84 до 89 нм, показатель преломления от 1,41 до 1,45. Пленки по результатам электронного микроскопа сплошные с единичными включениями частиц различной формы. Результаты атомно-силовой микроскопии показали, что при высоком содержании SiO2 в пленке образуется однородное пленочное покрытие. Уменьшение содержания кремния до 50 % в системе приводит к образованию покрытий с достаточно равномерно расположенными кристалловидными образованиями диаметром до 10…11 мкм и высотой не более 2 мкм на расстоянии от 1 до 30 мкм. По результатам рентгенофазового анализа были определены продукты кристаллизации в тридимидной форме, с возможным переходом в кристаллоболит, волластонит СаSiO3, ортосиликат кальция Са2SiO4, Са2Р2O7. С изменением содержания определенных компонентов меняется состав продуктов кристаллизации.
Список литературы:
1. Шабанова Н.А., Попов В.В., Саркисов П.Д. Химия и технология нанодисперсных оксидов. – М.: ИКЦ «Академия», 2006. 309 с.
109

ОБРАЗОВАНИЕ КАРБОНАТА КАЛЬЦИЯ В АММИАЧНОЙ СРЕДЕ Маланова Н.В., Нгуен Х.М.
Национальный исследовательский Томский политехнический университет
Особенностью водопотребления в Томской области является приоритетное использование для питьевого водоснабжения подземных вод, которые характеризуются большим значением жесткости, чем воды рек.
Для извлечения из воды солей жесткости существуют различные способы, основанные на образовании малорастворимых соединений [1]. Основным, практически нерастворимым, продуктом является карбонат кальция, который может существовать в следующих кристаллографических модификациях: кальцита, арагонита и ватерита. Известно [2], что кристаллы арагонита обладают более низкими значениями свободной поверхностной энергии в сравнении с кальцитом. Поэтому у кристаллов арагонита ниже адгезия к поверхности осаждения и ниже когезия кристаллов друг к другу, что облегчает задачу очистки оборудования от отложений СаСО3 [2]. Модификация СаСО3
зависит от различных факторов, прежде всего от температуры воды, давления, величины пересыщения, а также ионной силы раствора данной воды. Другими словами, образуется кристалл такой модификации, которому соответствует минимум свободной энергии Гиббса при данных условиях
[3].
В настоящей работе рассмотрено влияние водного аммиака на формирование карбоната кальция.
Исследование процесса осаждения карбоната кальция проводилось с использованием модельного раствора, образованного при сливании двух растворов. Первый раствор содержал осад-
кообразующий катион кальция, а второй – анион НСО3-.Также были проведены эксперименты с
использованием водопроводной воды г. Томска [4]. В качестве реагента-осадителя использовали аммиак водный с массовой долей 25%. Образующийся осадок СаСО3 отфильтровывали и сушили
при комнатной температуре.
Рентгенографический анализ (РФА) твердой фазы, суспензированной в объеме воды, показывает, что применение водного аммиака приводит к образованию различных кристаллических фаз СаСО3. Данные РФА приведены в таблице (образец 1 – получен из модельного раствора тем-
пературой 40 °С, образец 2 – получен из водопроводной воды температурой 15 °С, образец 3 – получен из водопроводной воды 40 °С).
Таблица. Результаты рентгенофазового анализа образцов СаСО3
|
|
|
Арагонит, % мас. |
Кальцит, % мас. |
Ватерит, % мас. |
|||||||
|
Образец 1 |
|
|
53,77 |
|
|
20,65 |
|
|
25,58 |
|
|
|
Образец 2 |
|
|
46,81 |
|
|
53,19 |
|
|
0 |
|
|
|
Образец 3 |
|
|
41,48 |
|
|
58,52 |
|
|
0 |
|
|
Анализируя данные рентгенографических исследований, можно сделать вывод о том, что
введение в водные растворы аммиачной воды для извлечения катионов Са2+, способствует формированию арагонитовой модификации СаСО3.
Результаты РФА подтверждаются данными дифференциально-термического анализа (ДТА). На ДСК-кривой фиксируются пики в интервале температур 320…360 °С, что свидетельствует о полиморфном превращении арагонита в кальцит.
Таким образом, установлено, что кристаллизация карбоната кальция в присутствии водного аммиака приводит к образованию арагонита. Можно предположить, что это обусловлено способностью молекул аммиака образовывать водородные связи.
Список литературы:
1.Кульский Л.А., Строкач П.П. Технология очистки природных вод. Киев: Вища школа,
1981. 812 с.
2.Присяжнюк В.А. Физико-химические основные предотвращения кристаллизации солей на теплообменных поверхностях // Сантехника, отопление, кондиционирование. 2003. №10. C. 2630.
3.Верма А., Кришна П. Полиморфизм и политипизм в кристаллах. М.: Мир, 1969. 275 c.
4.Куликова М.В. Устранение временной жесткости воды аммиачным способом в аппаратах интенсивного перемешивания: Автореферат. Дис. канд. техн. наук. Томск: Томский политехнический университет, 2011г. 19 с.
110
