
ТПУ май 2012
.pdfТермический анализ продукта проводили на приборе SDT Q600 при скорости нагрева 10 град/мин в воздухе. Согласно полученным данным нанослоистый порошок WS2 начинает окисляться при 400 °С, при 600 °С потеря массы образца составляет 1,6%.
Измерение коэффициента трения проводили на высокотемпературном трибометре CSEM ТНТ-S-АХ0000 по методике «шар на диске». Нормальная нагрузка составляла 5 Н, длительность теста – 30 мин. По данным теста нанослоистый дисульфид вольфрама продемонстрировал средний коэффициент трения равный 0,05 при комнатной температуре, при 400 °С коэффициент трения незначительно увеличивается до µ = 0,06.
Работа выполнена в рамках Федеральной целевой программы «Научные и научнопедагогические кадры инновационной России в 2009-2013 гг.» (ГК №П1042 от 31.05.2010г.)
Список литературы:
1.Сентюрихина Л. Н., Опарина Е. М. Твердые дисульфидмолибденовые смазки. М.: Хи-
мия, 1966. 152 с.
2.K. Elmer. Preparation routes based on magnetron sputtering for tungsten disulfide (WS2) films for thin-film solar cells // Physica status solidi (b). 2008. 245. № 9. P.1745–1760.
3.Shibin Sun, Zengda Zou, Guanghui Min. Synthesis of tungsten disulfide nanotubes from different precursor // Materials Chemistry and Physics. 2009. № 114. P. 884–888.
4.Jifen Wu, Xun Fu. A low-temperature solvothermal method to prepare hollow spherical WS2 nanoparticles modified by TOA // Materials Letters. 2007. 61. P.4332–4335.
5.S.M. Ghoreishi, S.S. Meshkat, A.A. Dadkhah. IF-WS2 nanoparticles size design and synthesis via chemical reduction // Materials Research Bulletin. 2010. 45. P.584–588.
СИНТЕЗ ВОЛЛАСТОНИТА В ТЕПЛОИЗОЛЯЦИОННЫХ МАТЕРИАЛАХ Карионова Н.П.
Национальный исследовательский Томский политехнический университет
Для улучшения прочностных характеристик керамических теплоизоляционных материалов на основе диатомита, было решено синтезировать в них новую кристаллическую фразу, упрочняющего действия (волластонит). При этом предполагается, что неизометричный габитус частиц волластонита будет обеспечивать армирование керамического материала, увеличивая прочность изделий. Для синтеза волластонита в керамические массы вводилось от 10 до 50 % мела Инзенского месторождения.
В качестве пластификатора был выбран раствор ССБ в количестве 10 % (сверх 100 %). В качестве пороформирующих компонентов использовались вспученный вермикулит в количестве 10 мас. %, и диатомитовая порода Инзенского месторождения – от 50 до 90 мас. %. Для придания большей пластичности керамическим массам использовалась глина Кайлинского месторождения в количестве 10 мас. % (сверх 100 %). Также вводились опилки (5 мас. % сверх 100) для улучшения формовочных свойств керамических масс и уменьшения объемной массы изделий.
Известковая, диатомитовая, глинистая породы просеивались через сито 063. Смеси предварительно перемешивались в сухом состоянии, затем увлажнялись до формовочной влажности, которая находилась в пределах 30 – 43 %. Из пластичных масс формовали образцы в виде кубиков размером 25×25×25 мм и плиточек – 50×50×10 мм. Сформованные образцы высушивали до постоянной массы на воздухе, после чего определялись основные свойства полуфабриката.
Высушенные образцы обжигались в муфельной печи при температурах 1000, 1100 и 1150 °С, со скоростью нагрева 100 град/час.
Для изучения процессов фазообразования и минералогического состава полученных керамических материалов был проведен РФА. Содержание β-кварца в материалах уменьшается с увеличением доли известкового компонента, а также температуры обжига. При этом предполагается, что β-кварц расходуется на синтез волластонита, частично может растворяться в расплаве, а также может полиморфно перейти в метакрисобалит.
При температурах выше 1000 °С из аморфной части диатомитовой породы начинается кристаллизоваться β-кристобалит, который вступает в реакцию с оксидом кальция, частично растворяется в расплаве.
Интенсивность пиков волластонита прямолинейно возрастает с увеличением содержания известкового компонента в керамических массах.
При введении глинистого компонента увеличивается общая интенсивность рефлексов β- кварца, и уменьшается – β-волластонита.
Уменьшение интенсивности рефлексов β-волластонита при температуре обжига 1150 °С, в сравнении с интенсивностью при температуре обжига 1100 °С, связано с полиморфным переходом β-волластонита в α-форму.
91

Анализ свойств полученных изделий, обожженных при температуре 1000 и 1100 °С, показал, что при введении мела (до 20 %) происходит уплотнение структуры, дальнейшее увеличение содержания добавки мела приводит к разуплотнению структуры керамических материалов, в ходе диссоциации карбонатов. Это наблюдается в уменьшении объемной массы и предела прочности на сжатие, увеличении водопоглащения образцов.
При температуре обжига 1150 °С увеличение объемной массы и рост прочности изделий происходит линейно, вплоть до содержания добавки мела – 40 %. Это происходит за счет увеличения количества образующегося расплава, вследствие образования легкоплавких соединений с оксидом кальция.
Увеличение добавки мела свыше 40 % приводит к резкому падению механической прочности, уменьшению объемной массы и увеличению водопоглащения. Это вызвано образованием более тугоплавких соединений с оксидом кальция, и как следствие уменьшением количества образующегося расплава.
При введении глинистого компонента в керамические массы увеличивается объемная масса и механическая прочность изделий, а также уменьшается водопоглащение. Дополнительное использование опилок в исследуемых массах приводит к снижению объемной массы и увеличению водопоглащения изделий.
Таким образом, в исследуемых керамических материалах был синтезирован волластонит, однако он не оказал существенного влияния на прочностные свойства полученных образцов. Так как синтетический волластонит обладает низким коэффициентом теплопроводности, коэффициентом термического расширения (6,6∙106 К-1), является химически стойким к алюминиевым расплавам, его присутствие в качестве кристаллической фазы улучшает эксплуатационные свойства изделий.
ТЕХНОЛОГИЯ ОБЖИГМАГНИТНОГО ОБОГАЩЕНИЯ ЖЕЛЕЗОМАРГАНЦЕВОЙ РУДЫ ЖАЙРЕМСКОГО МЕСТОРОЖДЕНИЯ
Каткеева Г.Л., Шайке Ж.А. , Мухтар А.А. , Нурумгалиев А.Х., Макашев А.С. Химико-металлургический институт им. Ж. Абишева, г. Караганда
Объектом исследования являлась проба железомарганцевой руды месторождения Жайрем. В ходе исследования выполнены минералогический, рентгенофазовый, химический, грану-
лометрический анализы руды.
По данным химического анализа руда имеет следующий состав, %: Fe-18,82, Mn22,46, SiO2 – 24,58.
С целью выделения относительно богатого по сравнению с исходной рудой железомарганцевого продукта для последующего обжигмагнитного обогащения, предложена схема включающей измельчение руды до крупности 0,0 - 1,0 мм, сухую магнитную сепарацию на лабораторном анализаторе 138 Т в магнитном поле напряженностью 4800э с выделением в магнитную фракцию железомарганцевого продукта и немагнитной фракции. Результаты, которой подробно представлены в таблице 1.
Таблица 1. Результаты магнитного обогащения исходной руды (сухая магнитная сепарация)
Наименование |
Наимено- |
Выход, |
Содержание, |
Извлечение, |
|
|
|
|
||
продукта |
вание |
фрак- |
% |
% |
% |
|
|
|
|
|
|
ции |
|
|
|
Fe |
Mn |
SiO2 |
Fe |
Mn |
SiO2 |
|
Магнитная |
|
|
|
|
|
|
|
|
|
|
фракция |
76,93 |
19,10 |
27,53 |
15,85 |
83,75 |
87,52 |
57,66 |
||
|
(Fe- |
Mn |
||||||||
Исход-ная |
|
|
|
|
|
|
|
|
||
продукт) |
|
|
|
|
|
|
|
|
||
руда (0-1,0 |
|
|
|
|
|
|
|
|
||
Немагнит- |
|
|
|
|
|
|
|
|
||
мм) |
|
|
|
|
|
|
|
|
||
ная |
фрак- |
|
|
|
|
|
|
|
|
|
|
23,07 |
12,37 |
13,11 |
38,79 |
16,25 |
12,48 |
42,44 |
|||
|
ция |
(хво- |
||||||||
|
|
|
|
|
|
|
|
|
||
|
сты) |
|
|
|
|
|
|
|
|
|
Итого: |
|
|
|
100 |
- |
- |
- |
100 |
100 |
100 |
Полученные при различных температурах огарки измельчали на стержневой мельницы до класса крупности 0,1-0,0 мм и анализировались на содержание основных компонентов (табл. 2).
92
Таблица 2. Химический анализ огарков
|
№ пп |
Температура |
Потеря массы |
|
Содержание, % |
|
|
|
|
обжига, °С |
веса,% |
|
|
|
|
|
|
|
|
Fe |
|
Mn |
SiO2 |
|
700 |
9,50 |
21,41 |
|
27,90 |
19,42 |
|
|
750 |
10,15 |
22,47 |
|
26,97 |
20,09 |
|
|
800 |
10,15 |
17,11 |
|
26,62 |
19,18 |
|
|
850 |
13,30 |
23,08 |
|
29,76 |
20,60 |
|
Далее они были направлены на мокрую магнитную сепарацию для разделения железе от марганца, т.е. магнитная фракция (Fe – продукт) и немагнитная фракция (Mn-продукт). Результаты представлены в таблице 3.
Таблица 3. Результаты обжигмагнитного обогащения FeMn продукта (мокрая магнитная сепарация)
Условия |
Наименова-ние |
Выход, % |
Содер- |
Извлечение, % |
|
|
|
|
|||
опыта |
фракции |
|
жание, |
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
Mn |
|
SiO2 |
|
Fe |
Mn |
SiO2 |
ММС при |
магнитная |
2,61 |
50,41 |
|
13,51 |
|
5,98 |
|
6,16 |
1,27 |
0,80 |
2500 э, |
фракция (Fe – |
|
|
|
|
|
|
|
|
|
|
τ =60мин., |
продукт) |
|
|
|
|
|
|
|
|
|
|
t=700ºC. |
Немагнитная |
97,39 |
20,65 |
|
27,96 |
|
20,37 |
|
93,84 |
98,73 |
9,20 |
|
фракция (Mn- |
|
|
|
|
|
|
|
|
|
|
|
продукт) |
|
|
|
|
|
|
|
|
|
|
|
Итого |
100 |
|
|
|
|
|
|
100 |
100 |
100 |
ММС при |
магнитная |
15,49 |
55,21 |
|
7,46 |
|
7,44 |
|
39,71 |
4,40 |
5,71 |
2500 э, |
фракция |
|
|
|
|
|
|
|
|
|
|
τ= 60мин., |
Немагнитная |
84,51 |
15,36 |
|
29,82 |
|
22,47 |
|
60,29 |
95,60 |
94,29 |
t=750ºC. |
фракция |
|
|
|
|
|
|
|
|
|
|
|
Итого |
100 |
|
|
|
|
|
|
100 |
100 |
100 |
ММС при |
магнитная |
16,33 |
51,30 |
|
10,25 |
|
9,64 |
|
37,34 |
6,46 |
7,88 |
2500 э, |
фракция |
|
|
|
|
|
|
|
|
|
|
τ =60мин., |
Немагнитная |
83,67 |
16,80 |
|
28,89 |
|
21,95 |
|
62,66 |
93,54 |
92,12 |
t=800ºC. |
фракция |
|
|
|
|
|
|
|
|
|
|
|
Итого |
100 |
|
- |
|
- |
|
- |
100 |
100 |
100 |
ММС при |
магнитная |
30,40 |
54,61 |
|
5,59 |
|
12,29 |
|
82,92 |
6,53 |
17,85 |
2500 э, |
фракция |
|
|
|
|
|
|
|
|
|
|
τ =60мин., |
Немагнитная |
69,60 |
4,92 |
|
34,95 |
|
24,73 |
|
17,08 |
93,47 |
82,15 |
t=850ºC. |
фракция |
|
|
|
|
|
|
|
|
|
|
|
Итого |
100 |
|
|
|
|
|
|
100 |
100 |
100 |
Из данной таблицы видно, что наиболее оптимальные результаты получились при температуре 850ºC, где извлечение железа в магнитную фракцию составило – 82,92%, а извлечение марганца в марганцевый концентрат составило – 93,47%. В полученном марганцевом концентрате отношение железа к марганцу составляет 1:7, что считается наиболее благоприятны.
ОСОБЕННОСТИ ИСПОЛЬЗОВАНИЯ КАРБОНАТНОЙ МАРГАНЦЕВОЙ РУДЫ УСИНСКОГО МЕСТОРОЖДЕНИЯ В МЕТАЛЛУРГИИ
Кауцман Т.А., Чинь Ч.В.
Нациоанльный исследовательский Томский политехнический университет
В настоящее время в России ощущается острый дефицит марганцевых руд. Современная потребность промышленности составляет 1,3 млн. тонн марганцевых концентратов. Разведанные запасы марганцевых руд в России составляют 148 млн. тонн, которые сосредоточены в 13 месторождениях Северо-Уральского марганцево-рудного бассейна и Западной Сибири.
Объектом исследования в данной работе является карбонатная марганцевая руда Усинского месторождения. Усинское месторождение – крупнейший, детально разведанный промышленный объект. Рудные тела залегают в крутопадающем западном крыле Усинской синклинальной струк-
93

туры, сложенной известняками, доломитами, глинистыми и углистыми сланцами раннекембрийского возраста.
Специфической особенностью марганцевых руд является многообразие минеральных форм марганца, а также крайне неравномерная вкрапленность рудных минералов размером от долей миллиметров до нескольких сантиметров. Главные рудные минералы – карбонаты марганца: родохрозит, манганокальцит и марганцовистый кальцит. В качестве второстепенных присутствуют силикаты марганца: тефроит, пироксмангит, бементит, фриделит, оксиды – пиролюзит, тодорокит, вернадит, а также пирротин, кварц, тальк, стильпномелан, хлорит.
По данным химического анализа, проведенного по стандартной методике, выявлено, что исследуемая руда характеризуется низким содержанием марганца, что определяет необходимость ее обогащения с целью получения концентратов металлургических сортов. Кроме того, в составе руды отмечается повышенное содержание вредных примесей – в первую очередь фосфора и кремнезема, что усложняет схему их обогащения.
Для обогащения руду подвергали измельчению на щековой дробилке ДЩ-6, а затем в шаровой мельнице до прохождения руды через сито 1 мм. Затем измельченную руду подвергали обработке на лабораторном магнитном сепараторе. Обогащенная марганцевая руда имеет следующие физико-химические характеристики: удельная поверхность – 512 см²/г, удельный вес – 2,39 г/см³, насыпная масса – 1410 кг/м³. Полученные данные показывают, что карбонатная руда после обогащения представляет собой тонкодисперсный концентрат, использование которого затруднено в металлургическом переделе без предварительной подготовки, так как мелкофракционные материалы обладают низкой газопроницаемостью. Для более эффективного использования тонкодисперсного сырья применяют процессы гранулирования.
Вданной работе гранулирование обогащённых карбонатных марганцевых руд осуществляли методом окатывания на лабораторном тарельчатом грануляторе, с диаметром тарели -500 мм, угол наклона тарели – 45±2°, скорость вращения тарели - 40±5 об/мин, время гранулирования – 15 мин. Гранулирование вели с получением гранул с размером от +5 мм до -18 мм [1].
Вкачестве связующего для гранулирования концентрата использовали воду, торфогель с содержанием сухого вещества 18,5% и 10%-й водный раствор ПВС.
Результаты опытов по гранулированию представлены в табл .1. Для определения прочности отбирались гранулы размером 10 ±2 мм.
Таблица 1. Химический состав марганцевой руды Усинского месторождения
Содержание компонентов в руде, мас. %
MnСО3 |
Fe |
P |
S |
SiO2 |
Al2O3 |
CaO |
MgO |
п.п.п. |
19,30 |
5,96 |
0,18 |
1,09 |
10,33 |
1,67 |
14,90 |
3,17 |
43,40 |
Как видно из таблицы, наиболее прочные гранулы получаются на торфогеле. Учитывая перспективность применения данного связующего, целесообразно продолжение работ по исследованию процесса гранулирования на торфогеле.
Таким образом, нами были проведены предварительные исследования карбонатной марганцевой руды Усинского месторождения, которые показали, что возможно значительно улучшить товарные свойства руды путём обогащения с увеличением содержания марганца более чем в 2 раза и получением из концентрата прочных окатышей пригодных для использования в металлургической промышленности.
Список литературы:
1. Классен, Петр Владимирович. Гранулирование / П. В. Классен, И. Г. Гришаев, И. П. Шо-
мин. — М. : Химия, 1991. — 238 с.
ВЛИЯНИЕ ДОБАВКИ АГАР-АГАРА НА ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОБРАЗЦОВ ГИДРОКСИАПАТИТА
Кийко Е.А.
Нациоанльный исследовательский Томский государственный университет
В последние годы значительное внимание уделяется созданию пористых керамических материалов медицинского назначения. Наиболее перспективным среди них является гидроксиапатит (ГА) – Са10(РО4)6(ОН)2. Синтетический ГА характеризуется хорошей биологической совмести-
мостью и биоактивностью. В последнее время усилия многих исследователей направлены на разработку методов синтеза пористого ГА, который получают, в основном, с применением на разных стадиях синтеза так называемых выгорающих добавок.
94

В данной работе представлены два способа синтеза ГА с добавкой агар-агара при соотношении компонентов от 1:0,1 до 1:0,3 (по массе):
1)выгорающую добавку вводили в начале синтеза ГА (синтез 1);
2)выгорающую добавку смешивали с ГА, полученным жидкофазным методом [1], и прокаливали при температуре 900 °С в течение 3 часов (синтез 2).
Синтез исходных образцов гидроксиапатита проведен по классическому методу осаждения из водных растворов в соответствии со следующим уравнением реакции:
10Ca(NO3)2 + 6(NH4)2HPO4 + 8NH4OH →
→ Ca10(PO4)6(OH)2 + 20NH4NO3 + 6Н2О |
(1). |
Выделенные порошки ГА, в том числе и включающие агар-агар, представляют собой белые мелкокристаллические вещества, плохо растворимые в воде. Методом трилонометрического титрования иона кальция найдена растворимость полученных образцов ГА в воде (рН 7) при комнатной температуре и установлена зависимость растворимости от содержания агар-агара в них (рис. 1).
Рис. 1. Зависимость растворимости ГА от содержания выгорающей добавки: а – синтез 1; б
– синтез 2.
Полученные результаты показывают, что введение 10-20 % агар-агара в процессе синтеза ГА (синтез 1) приводит к понижению его растворимости по сравнению с растворимостью ГА без добавки на 2-3 порядка. Увеличение содержания выгорающей добавки до 30 %, наоборот, повышает растворимость образцов ГА в обоих способах синтеза: на 7 порядков в синтезе 1 и на 2 порядка в синтезе 2.
Определены параметры пористой структуры и удельной поверхности порошков ГА, полученных в синтезе 1, с помощью автоматического газо-адсорбционного анализатора TriStar II 3020 (табл. 1). Исследуемые образцы подвергались дегазации в вакууме при 200 °С в течение 2 часов.
Таблица 1. Значения параметров пористой структуры и удельной поверхности образцов ГА (синтез 1)
Образец |
Sуд |
Суммарный объ- |
Средний раз- |
|
(ВЕТ), м2/г |
ем пор, см3/г |
мер пор, нм |
||
|
||||
ГА + 10 % агар-агара |
49 |
0,4 |
30 |
|
ГА + 20 % агар-агара |
32 |
0,2 |
31 |
|
ГА + 30 % агар-агара |
7 |
0,05 |
31 |
Увеличение содержания агар-агара приводит к уменьшению удельной поверхности; размер пор в выделенных образцах составляет 30-31 нм (мезопоры).
Выводы:
95
1.Проведен синтез и выделены образцы ГА с выгорающей добавкой агар-агара от 10 до
30 % (мас.).
2.Определена растворимость в воде при комнатной температуре порошков ГА с выгоревшей добавкой и проведено сравнение ее с растворимостью ГА без добавки: образцы с содержанием агар-агара 10-20 % имеют наименьшую растворимость (рПР~41-43). Увеличение содержания агар-агара до 30 % приводит к увеличению растворимости ГА.
3.Определены удельная поверхность и параметры пористой структуры выделенных образцов ГА с выгоревшей добавкой: наблюдается корреляция между величиной удельной поверхности образцов, общим объемом их пор и растворимостью.
Список литературы:
1.Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2005.
204 с.
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ КРЕМНИЯ МАГНИЙ ТЕРМИЧЕСКИМ ВОССТАНОВЛЕНИЕМ ДИОКСИДА КРЕМНИЯ
Киселёв А.Д.
Национальный исследовательский Томский политехнический университет
Самой дорогостоящей стадией в существующих способах производства кремния является очистка кремнийсодержащего соединения от примесей. Считается, что максимальной степени очистки вещества можно добиться сублимацией-десублимацией, либо ректификацией его летучего соединения. В случае получения кремния высокой чистоты используют силаны, хлорсиланы. Сам процесс получения силана (хлорсилана) кремния является высокозатратным, в результате передела в газовую фазу попадают летучие соединения неметаллов, являющихся основными мешающими примесями в кремнии, используемом для солнечной энергетики [1].
Предлагается удалить примеси бора, фосфора, мышьяка и др. неметаллов до стадии получения кремния. Получение кремния проводить методом металлотермии с использованием в качестве восстановителя магний. Если для синтеза использовать сырье с суммарным содержанием примесей неметаллов менее 10 ppm, то и конечный продукт можно получить соответствующей чистоты.
Удобным соединением кремния для очистки от примесей является гексафторосиликат аммония, который можно получить фторированием оксида кремния в расплаве фторида или гидродифторида аммония [2]. Аммиачным осаждением из гексафторосиликата аммония можно получить диоксид кремния, который и применить для синтеза кремния.
Ранее проведёнными научными изысканиями доказана перспективность этого метода при условии использования в качестве сырья высокочистого продукта. Даются указания на возможные трудности, методы устранения их также известны и изучены [3].
SiO2 + 2Mg = Si + 2MgO
Реакция начинается при 550 oC, далее происходит саморазогрев шихты до 1000 oC. Образовавшийся кремний подвергается отмывке соляной кислотой от примеси оксида магния. Качество получаемого кремния напрямую зависит от качества исходных веществ. Примеси железа, алюминия, кальция, марганца вымываются соляной кислотой. Примеси неметаллов переходят в кремний. Получаемый кремний имеет аморфную структуру.
Предлагается организовать получение кремния, используя в качестве восстановителя парообразный магний. Метод отличается от ранее предложенного в использовании в качестве восстановителя паров магния. Переход металлического магния в газовую фазу достигается нагревом навески магния свыше его температуры кипения.
В общем виде технологическую последовательность производства кремния методом магнийтермии возможно представить следующей схемой.
Технология состоит из трёх отделений:
1)отделение производства высокочистого оксида кремния;
2)отделение магнийтермии;
3)отделение регенерации магния.
Проведённые первичные лабораторные исследования показали возможность осуществления, всех стадий показанных на схеме.
Врезультате магнийтермии получается механическая смесь кремния и оксида магния. Разделение этой смеси трудностей не представляет. Выделение кремния возможно осуществить методом вымывания оксида магния из смеси раствором соляной кислоты.
Врезультате проведенных исследований была разработана технология получения кремния с низким содержанием примесей неметаллов методом магнийтермического восстановления диокси-
96
да кремния. Применение исходного сырья необходимой чистоты с суммарным содержанием примесей неметаллов менее 1 ppm, позволяет получить и кремний чистотой 5N. После необходимой обязательной доработки и апробации на полупромышленном участке данная технология может быть применена для получения кремния, пригодного для солнечной энергетики.
Список литературы:
1.Фалькевич Э.С., Пульнер Э.О., Червонный И.Ф. и др. Технология полупроводникового кремния. – М.: Металлургия, 1992. 408 с.
2.Мельниченко Е.И., Крысенко Г.Ф., Эпов Д.Г. Термические свойства (NH4)2SiF6 // Журнал неорганической химии. 2004. Т. 49. № 12. С. 190–194.
3.Способ восстановления кремния: пат. 2036143 Рос. Федерация. № 5029853/26; заявл. 27.02.92; опубл. 27.05.95, Бюл. № 14. 3 с.
ОПРЕДЕЛЕНИЕ СОРБЦИОННОЙ ЕМКОСТИ ХИТОЗАНСОДЕРЖАЩИХ СОРБЕНТОВ С ПОМОЩЬЮ РЕНТГЕНОФЛУОРЕСЦЕНТНОГО МЕТОДА АНАЛИЗА
Ковальская Я.Б., Агеева Л.Д., Зеличенко Е.А., Рогулина А.С., Гурова О.А.
В настоящее время мир ионитов велик и многообразен, а ионообменный процесс быстро и всесторонне входит в различные сферы человеческой деятельности. Все большее значение приобретают процессы ионного обмена в связи с внедрением в промышленную практику замкнутых технологических схем и комплексного использования сырья [1].
Одним из перспективных методов создания новых ионообменных материалов и технологий их изготовления может стать способ получения ионитов из биологических полимеров, например, из хитина и хитозана. Эти материалы представляют особый интерес из-за более низкой стоимости по сравнению с ионообменными смолами. Еще одним достоинством является то, что для их производства используется природное воспроизводимое сырье. Производительность ионообменных материалов может быть любой и определяться целесообразностью и необходимостью объемов производства [2].
Хитозан – природный биополимер, который получают из хитина путём удаления ацила. Известно, что хитозан обладает отличными сорбционными и электропроводящими свойствами, а также что способность хитозана и его производных связывать ионы тяжелых металлов и радионуклидов в десятки раз превосходит сорбционную способность ионообменных смол. В связи с этим актуальным представляется исследование характеристик новых ионообменных материалов, модифицированных хитозаном для повышения их сорбционной емкости по отношению к извлекаемым компонентам, способных к сорбционному концентрированию микросодержаний золота и радиоактивных элементов.
Для растворения хитозана была использована уксусная кислота. Исследования проводились в растворах с концентрациями хитозана до 1,5%. Покрытия, полученные на композиционном волокне и на металлической сетке, высушивались на воздухе при 40 °С.
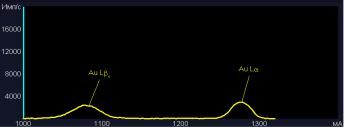
Образцы модифицированных материалов были помещены в стандартный раствор золота. После высушивания образцов рентгенофлуоресцентный анализ показал присутствие золота в составе покрытий. На рисунке 1а и 1б представлены пики золота после сорбции в идентичных условиях активированным углем и модифицированным волокном соответственно.
а) активированный уголь
97
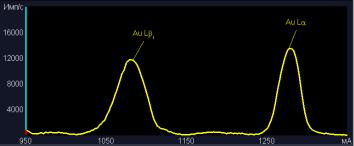
б) модифицированное волокно Рисунок 1. Результаты рентгенофлуоресцентного анализа после сорбции золота в идентич-
ных условиях для угля БАУ и волокна, модифицированного хитозаном
Из полученных результатов следует, что композиционное волокно с хитозановым покрытием обладает лучшими сорбционными свойствами, чем активированный уголь. В результате исследований также установлено, что в процессе десорбции из материала в раствор переходит до 95% золота. Ожидается, что при использовании двухступенчатой схемы десорбции показатель будет близок к 100%.
Таким образом, результаты проведенных исследований позволяют предложить полученные материалы в качестве сорбентов и проводить усовершенствование методики определения золота, а в дальнейшем и других тяжелых металлов и радионуклидов методом рентгенофлуоресцентного анализа с достаточно низким пределом обнаружения.
Список литературы:
1.Иониты в химической технологии. Под ред. Б. П. Никольского и П. Г. Романкова. Л.
Химия, 1982. 416 с.
2.Dictionary of Renewable Resources. Ed. By H. Zoebelein 2-nd ed. Einheim, Wiley-VCH, 2001. 408 p.
КОМПЛЕКСНЫЕ УДОБРЕНИЯ ИЗ МИНЕРАЛЬНОГО СЫРЬЯ И ОТХОДОВ ФОСФОРНОЙ ПРОМЫШЛЕННОСТИ
Кожабекова Н.Н., Жунусова Л. К., Акылбаева Н.А.
Институт химических наук им. А.Б. Бектурова, 050010, Алматы, ул.Ш.Уалиханова, 106, e-mail: kojabekova@mail.ru
В последние годы агрохимики отдают предпочтение комплексным удобрениям, в состав которых входят фосфор, калий и азот. В Средней Азии основным сырьем для получения фосфорных удобрений являются фосфориты Каратау. В качестве калийсодержащего сырья могут использоваться глаукониты и отходы фосфорного производства – котрельное «молоко» (КМ) с содержанием соответственно 3,0% К2О и 12,1% К2О [1, 2].
Исследование процесса разложениия глауконита Уалихановского месторождения (Казахстан) фосфорной кислотой показало, что его структура практически не разрушается, но при этом калий переходит в жидкую фазу [1]. В связи с этим глауконит можно применять для получения фосфорных калийсодержащих удобрений путем его совместной переработки с фосфоритом кислотным методом. Смесь из рядовой руды Каратау и глауконита, взятых в определенных соотношениях 1:0,77 и 1:0,1, разлагали экстракционной фосфорной кислотой (20% по Р2О5) из расчета на получение удобрений типа обогащенного (37,5% Р2О5общ) и двойного (45% Р2О5общ.) суперфосфата. Установлено, что аммонизация кислой пульпы снижает содержание усвояемой Р2О5 в воде по сравнению с удобрениями, полученными без аммонизации. По-видимому, дополнительное образование фосфатов аммония в процессе аммонизации кислой пульпы способствует ретроградации образовавшихся дигидрофосфатов кальция и магния до малорастворимых гидрофосфатов. Полученные удобрения содержат 3-6% К2О и характеризуются высоким содержанием усвояемых форм Р2О5 в воде (К усв. = 81,3-91,8 отн. %) и в 2% лимонной кислоте (Кусв.= 84,0-88,9 отн. %).
Котрельное «молоко» характеризуется высоким содержанием не только калия, но и Р2О5 (38,2%). Проведенные исследования показали, что при его разложении в смеси серной и фосфорной кислот остаточное содержание элементного фосфора (Р4) не превышает 0,13% [2]. Поскольку процесс экстракции ЭФК проводится в условиях нагрева при 92оС, а получения аммофоса - при 115 °С, то можно ожидать, что в аммофосе, полученном из экстракционной фосфорной кислоты путем частичной замены оборотного раствора (13% Н3РО4) на котрельное «молоко» на стадии ее экстракции, будет полностью отсутствовать Р4. Процесс получения экстракционной фос-
98
форной кислоты осуществляли в термостатируемом реакторе, куда загружали смесь оборотного раствора (13% Р2О5) с котрельным «молоком», и одновременно дозировали расчетное количество серной кислоты (93%), смесь нагревали до 920С и вводили фосфорит. Процесс экстракции проводили в течение 3,5 часа при перемешивании. Процесс осуществляли при соотношениях (мас. час.) «фосфорит:серная кислота: оборотный раствор:котрельное «молоко» равных - 100:61,6:24,3:0,13; 100:61,6:23,2:0,26; 100:61,6:21,7:0,38, что обеспечивало замену оборотной кислоты на 5, 10 и 15% котрельного «молока» соответственно. После окончания процесса полученную пульпу отфильтровывали. Анализ экстракционной фосфорной кислоты показал, что по содержанию Р2О5 (23,0- 23,8%) и SO3 (2,11-2,40%) она не уступает экстракционной фосфорной кислоте, получаемой из фосфорита Каратау по традиционной технологии. Коэффициент разложения сырья во всех вариантах соответствует регламентным требованиям (85,83 - 88,10 отн. %). Экстракционную фосфорную кислоту аммонизировали до рН 3,0-3,5, а пульпу сушили при 100-115 °С до постоянного веса. В полученных удобрениях отсутствует элементный фосфор, вся Р2О5 (48,6-49,1%) в аммофосе находится в усвояемой форме, а сумма питательных веществ кроме Р2О5 и N (9,7-10,2%) включает и калий (2,7-3,6%). Из полученных данных следует, что замена оборотного раствора (13% Н3РО4) на КМ позволяет получать аммофос с высокой суммой питательных компонентов (60,4-63,2%.), представленных фосфором, азотом и калием.
Таким образом, показана возможность совместной переработки смесей фосфорита с глауконитом и фосфорита с котрельным «молоком» на эффективные фосфор-, калий-, азотсодержащие удобрения кислотным методом их разложения.
Список литературы:
1.Султанбаева Г.Ш., Чернякова Р.М., Кусаинова М.Ж., Джусипбеков У.Ж. // Химический журнал Казахстана. 2010. № 4. С. 47-52.
2.Джунусова Л.К., Джунусбекова Г.Б., Чернякова Р.М., Джусипбеков У.Ж. // Химический журнал Казахстана. 2010. №1. С.30-36.
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ТИТАНОВОГО ПОРОШКА Коровянский А.В.
Северский технологический институт-Национальный исследовательский ядерный университет «МИФИ» kantonv@mail.ru
Среди химических элементов титан занимает девятое место по распространенности в земное коре 0,61 % (по массе) [1]. Известно более 100 минералов, содержащих титан. Благодаря своим уникальным свойствам титан имеет очень широкий потенциальный диапазон применения. Однако из-за высокой стоимости его потребление сильно ограничено. На данный момент основными потребителями являются аэрокосмическая, судостроительная и оборонная промышленности. Технология производства металлического титана чрезвычайно сложна и только менее 5 % всего добываемого в мире титанового сырья используют для выплавки металла. Такая высокая цена заложена в основном применяемом методе получения титана (процесс Кроля), который является сложным и нуждается в периодической остановке процесса восстановления.
Одним из путей снижения цены на изделия из титана является порошковая металлургия. Большая экономия достигается за счет уменьшения потерь и отходов.
Нами была предложена технологическая схема получения высокочистых порошков титана электролитическим разложением тетрафторида титана. Предложенный способ состоит из трех основных этапов. Первый этап предполагает получение тетрафторида титана пригодного для электролиза из титансодержащего сырья прямым фторированием элементным фтором. Полученный газообразный тетрафторид титана отделяется от нелетучих примесей и затем конденсируется. Вторым этапом является непосредственное получение металлического титана. В электролизере готовится расплав электролита. В качестве электролита была выбран флинакнизкоплавкая (tпл = 472°C) эвтектическая смесь фторидов щелочных металлов (0,5 М LiF - 0,39 М KF - 0,11 М NaF). После расплавления электролита электролизер герметизируется, и заполняется инертным газом. Полученный TiF4 сублимируется и порциями подается в расплав в газообразном состоянии. При растворении TiF4 во фторидной эвтектике образуется комплексная соль:
TiF4(г)+KF(LiF, NaF)(ж) = K2(Li, Na)2TiF6(ж)
При подаче на электроды постоянного тока в электролизере протекают процессы: на катоде: Ti4++ 4е → Ti°
на аноде: 4F- - 4е → 2F2 °.
Таким образом, на катоде происходит выделение порошка титана (катодный осадок), а на аноде - элементного фтора (F2). Катодный осадок (порошок титана в смеси с электролитом) срезается ножами с катода электролизера и собирается в приемной емкости, являющейся
99
принадлежностью электролизера. Образующийся на анодах элементный фтор (F2) собирается под крышкой электролизера, а затем после очистки направляется на поглощение, регенерацию и затем возвращается в цикл. Выведенный из электролизера электролит восполняется новыми порциями. Для этого из бункера загрузочного устройства электролизера после каждого среза и вывода катодного осадка шнеком подается порошок электролита. На завершающем этапе полученный катодный осадок (порошок титана с электролитом) извлекается из приемной емкости электролизера и отправляется на отмывку и затаривание конечной продукции. Полученный товарный порошок титана может направляться на нужды порошковой металлургии или применяться для синтеза важнейших соединений титана (оксиды, карбиды, бориды, нитриды, гидриды и т.д.).
Предложенная нами схема получения порошков металлического титана имеет ряд преимуществ: исключает сброс фтора и химически вредных веществ в окружающую среду; обладает замкнутостью и непрерывностью технологических процессов; процесс протекает при умеренных температурных режимах; отсутствуют взрывоопасные процессы; возможность автоматизации процессов; возможность использования различного исходного титансодержащего сырья; низкая себестоимость конечной продукции, экологическая безопасность. Применение электролитического способа получения титана позволяет снизить его стоимость за счет исключения из технологической схемы применения металла-восстановителя и стадию его регенерации. Гибкая технологическая схема дает возможность применения различного титансодержащего сырья и быстрое переключение с одного вида сырья на другое. Кроме того получение непосредственно порошка является более экономически выгодным, чем получение губки.
Работа выполнена в рамках ФЦП «Научные и научно-педагогические кадры инновационной России».
Список литературы:
1. Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов. М: Металлургия. 1991.
215 с.
ИССЛЕДОВАНИЕ ПРОЦЕССА ФТОРИРОВАНИЯ ПИРОФИЛЛИТА ПРИ СИНТЕЗЕ МУЛЛИТА МЕТОДОМ ТЕРМИЧЕСКОГО АНАЛИЗА
Кравченко В.В.
Национальный исследовательский Томский политехнический университет
За последние годы производство огнеупоров претерпело значительные изменения, что позволило значительно увеличить их ассортимент и повысить качество. Среди множества видов керамических материалов особое место занимают алюмосиликатные керамические материалы – муллитовые и муллитокорундовые.
Высокотемпературный обжиг каолинита - один из основных способов получения муллита. Однако в условиях ограниченности запасов высококачественных глин возникает необходимость освоения нового ранее не используемого алюмосиликатного сырья.
С этой целью изучалась возможность использования пирофиллитовых пород для получения алюмосиликатных керамических материалов по фторидной технологии.
При таком способе синтеза процесс образования муллита можно представить в следующем
виде:
3(Al2O3·4SiO2·H2O)+30NH4F·HF→3Al2O3·2SiO2+ +10(NH4)2SiF6 +23H2O+10NH3↑
Для подробного изучения процессов, протекающих при синтезе муллита, был проведен дифференциально-термический анализ используемой в работе пирофиллитовой породы, а также смеси пирофиллита и гидродифторида аммония.
Данные проведенного дифференциально-термического анализа (рисунок 1) исследуемой пирофиллитовой породы свидетельствуют о многостадийности процесса его дегидратации. Удаление структурной воды начинается при температуре 450 - 460°С, причем дегидратация основной массы начинается при температуре 530°С.
В отличие от каолинита и других природных алюмосиликатов в структуре пирофиллита группировки [SiO4] и [Al(O, OH)6] жестко связаны друг с другом, что обусловливает его широкий
интервал дегидратации – 420-900°С. В частности, выделение конституционной воды происходит при температуре до 800°С.
100
