
- •2.Классификация технологического оборудования по характеру протекающих в нем процессов.
- •3.Опоры и строповые устройства для аппаратов
- •5.Характеристика процесса измельчения.
- •6.Однородные и неоднородные системы.
- •14, В чем заключается технологический расчет дробилок, разрушающих материал сжатием?
- •1.3. Основные конструкции и расчеты дробилок
- •Способы переноса теплоты
- •22. Конструкционные материалы химического машиностроения.
- •3.1. Железо и его сплавы
- •3.2. Никель, кобальт и их сплавы
- •3.3. Медь и её сплавы
- •3.4. Свинец
- •3.5. Алюминий и его сплавы
- •3.6. Титан и его сплавы
- •12. Силикатные материалы
- •2. Полиэтилентерефталат – лавсан.
- •3. Эпоксидные смолы.
- •1. Химическая.
- •2. Электрохимическая.
- •3. Фреттинг-коррозия (коррозия в механически нагруженных материалах).
- •4. Фото- и радиационнохимическая коррозия.
- •5. Абляция
- •1. Равномерная коррозия
- •3. Коррозионное растрескивание
- •4. Щелевая коррозия
- •25. Классификация химических процессов
- •О лимитирующей стадии технологического процесса
- •31 Билет
- •Глава 1. Прочность фланцевых соединений элементов открытого профиля
- •Глава 2. Напряженно-деформированное состояние фланцевых соединений
- •Глава 3. Усталостная прочность фланцевых соединений растянутых элементов
- •35 Билет Степень превращения
- •37. Псевдоожижение
- •38. Фланцевые соединения. Основные типы фланцев. Особенности расчета.
- •54. Реактор идеального вытеснения
- •55 Билет
- •57 Билет
- •58 Билет
- •59 Билет Классификация выпарных аппаратов
- •Выпарные аппараты с естественной циркуляцией, соосной греющей камерой, вынесенной зоной кипения и солеотделением Тип 1. Исполнение 2
- •Выпарные аппараты с естественной циркуляцией, вынесенной греющей камерой и кипением раствора в трубках Тип II. Исполнение 1
- •Выпарные аппараты с естественной циркуляцией, вынесенными греющей камерой и зоной кипения Тип II. Исполнение 2
- •Выпарные аппараты с принудительной циркуляцией, соосной греющей камерой и солеотделением Тип III. Исполнение 1
- •Выпарные аппараты с принудительной циркуляцией, соосной греющей камерой и вынесенной зоной кипения Тип III. Исполнение 2
- •Выпарные аппараты с принудительной циркуляцией, вынесенными греющей камерой и зоной кипения
- •Выпарные пленочные аппараты с восходящей пленкой и соосной греющей камерой Тип V. Исполнение 1
- •60 Билет
- •61 Билет
- •Аппараты с погружным горением для выпаривания различных химических растворов и пищевых сред.
- •5.1.2. Реактор полного смешения.
- •63.Тарельчатые и насадочные колоны. Области их применения.
- •64. Изменение концентрации основного исходного вещества по ступеням каскада реакторов полного смешения.
- •5.1.3. Каскад реакторов полного смешения.
- •65. Характеристика процесса кристализации
- •66. Ректификация. Области применения, аппаратурное оформление и основные отличия от простой перегонки.
- •Поясните принцип работы барабанного кристаллизатора.
- •72 Билет
- •73 Билет
55 Билет
Выпаривание,концентрирование растворов (чаще всего твёрдых веществ в воде) частичным испарением растворителя при кипении. При этом повышаются концентрация, плотность и вязкость раствора, а также температура его кипения. При пересыщении раствора растворённое вещество выпадает в осадок. Температура кипения растворов всегда выше температуры кипения растворителей; разность между ними, называется температурной депрессией, растёт с увеличением концентрации растворённого вещества и внешнего давления.
В. производится за счёт подводимого извне тепла: при температуре ниже 200°C теплоносителем является водяной пар, выше 200°С — высококипящие жидкости (дифенильная смесь, масло) и топочные газы. Обогрев производится через стенку аппарата, а при сильно агрессивных средах — барботажем пузырьков газа сквозь раствор или распылением последнего в струе газа.
В. ведут при атмосферном, пониженном или повышенном давлении. В большинстве случаев экономически выгодно работать под давлением выше 0,1 Мн/м2(1 кгс/см2), так как в этом случае можно использовать вторичный пар для обогрева других аппаратов. При работе с термически нестойкими веществами пользуются вакуум-выпаркой, что позволяет снизить температуру кипения растворов и уменьшить поверхность нагрева (вследствие увеличения разности температур между нагревающими агентами и кипящим раствором). Вакуум в аппаратах создаётся конденсацией вторичного пара и отсасыванием вакуум-насосом несконденсировавшейся паровоздушной смеси.
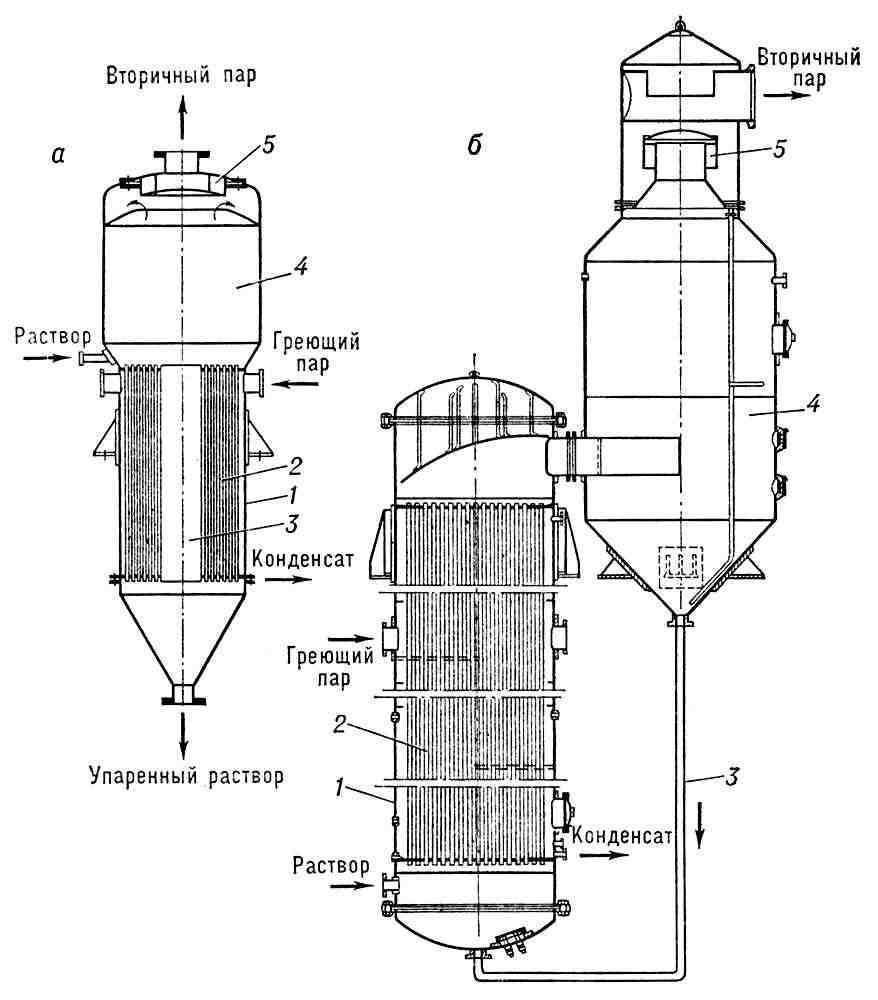
В. используется в химической, пищевой и других отраслях промышленности. Существует более 80 разновидностей выпарных аппаратов с паровым обогревом. В малотоннажных производствах обычно применяют вертикальные и горизонтальные цилиндрические выпарные аппараты с обогревом змеевиками или нагревательными рубашками; в крупнотоннажных производствах — аппараты с внутренними и выносными нагревательными камерами (рис. 1), плёночные аппараты, в которых струя пара увлекает вверх тонкую плёнку раствора, в результате чего создаются благоприятные условия для В., и аппараты с принудительной циркуляцией (рис. 2). Последние применяют при необходимости предотвратить осаждение солей на поверхности нагрева, а также при упаривании вязких растворов.
В однокорпусных аппаратах расход греющего пара составляет 1,2—1,25 кгна испарение 1 кгводы. Значительно экономнее многокорпусные выпарные установки, из которых наиболее распространены прямоточные (рис. 3); в них слабый раствор и греющий пар, движущиеся в одном направлении, последовательно поступают в выпарные аппараты. В последнем аппарате, присоединённом к барометрическому конденсатору и вакуум-насосу, создаётся разрежение, вследствие чего давление и температура кипения раствора постепенно понижаются от первого корпуса к последнему; благодаря этому осуществляется переток раствора и его испарение при обогреве вторичными парами. В противоточных установках раствор и греющий пар движутся навстречу друг другу, при параллельном питании слабый раствор подаётся одновременно во все корпуса.
На практике число корпусов редко бывает больше пяти, так как дальше полезная разность температур становится очень малой. Расход греющего пара на испарение 1 кгвыпариваемой воды составляет для трёхкорпусной установки 0,4кг, а для пятикорпусной 0,25—0,28кг. Многокорпусные выпарные установки широко применяются в многотоннажных производствах, потребляющих большое количество греющего пара (например, производство сахара).

56 билет
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности.
Типичные аппараты для проведения гомогенных процессов.
Для гомогенных реакций, проводимых в газовой среде, можно использовать реакционные
Аппараты ростого устройства,в частности, полый объем без перемешивания (например, окислительный
Объем при окислении 2NО+О2→2NО2)или с перемешиванием (например,печь с горелками при синтезе хлористого водорода).
Для процессов в жидкой фазе также используются реакционные емкости без перемешивания (баки, цистерны, котлы) и смесители с механическим (лопастные, пропеллерные и др. виды мешалок),пневматическим, струевым ,центробежным и прочими видами перемешивания.
Перемешивание обеспечивает не только получение однородных физическх смесей,
Но и интенсификацию многих реакции и идущих при этом процессов
Тепло и массообмена.При работе под давлением применяют автоклавы.
Скорость химических реакций
ии.
Гомогенные – это реакции, протекающие между веществами, находящимися в однородной среде, т. е. между ними нет границы раздела (газовая фаза, жидкая фаза). Реакции протекают равномерно по всему объему системы:
2NaOH(Ж) + H2SO(Ж) = Na2SO4(Ж) + 2Н2О(Ж).
Под
скоростью химической реакции
![]() понимается
изменение количества вещества (моль)
в единицу времени в единице реакционного
пространства.
Для гомогенных реакций реакционное
пространство – объем,
понимается
изменение количества вещества (моль)
в единицу времени в единице реакционного
пространства.
Для гомогенных реакций реакционное
пространство – объем,
![]() ,
моль/л∙ед.
времени,.
,
моль/л∙ед.
времени,.
Так как отношение количества вещества к единице объема называется концентрацией вещества (С, моль/л), то скорость гомогенного процесса равна изменению концентрации чаще исходных веществ во времени:
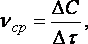 (36)
(36)
где
![]() –
средняя скорость реакции,
моль/л∙ед. времени;
–
средняя скорость реакции,
моль/л∙ед. времени;![]() –
изменение концентрации исходных
веществ, моль/л;
–
изменение концентрации исходных
веществ, моль/л;![]() –
время протекания процесса, с, мин и
пр.
–
время протекания процесса, с, мин и
пр.
Скорость реакций зависит от ряда факторов: природы реагирующих веществ, их концентрации, температуры и давления процесса, наличия в системе катализатора, а в случае гетерогенных реакций – от состояния поверхности раздела фаз.
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Гомогенной называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Отношение количества вещества к единице объема называется концентрацией с, моль/л.
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
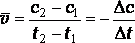 ,
,
где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, равна:
![]()
Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Скорость реакции имеет единицу измерения [моль м-3 с-1], [моль л-1с-1].
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции протекают со взрывом, другие могут идти годами. На скорость реакции влияют такие факторы как концентрация веществ, температура, катализаторы.
