
- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Раздел 3. Растворы
|
Растворы – это системы, состоящие из двух и более компонентов, состав и количество которых можно изменять в определенных пределах без нарушения однородности. Вещество, которое не меняет агрегатное состояние при растворении и содержится в большем количестве, называется растворителем. |
|
Истинными растворами называют однородную (гомогенную) смесь вещества, в которой компоненты находятся в виде молекул или ионов. Размеры частиц не превышают 1 нм. Такой раствор устойчив долго. Например: воздух, смесь газов – это газообразный раствор; морская вода – это жидкий раствор различных солей в воде; большинство сплавов металлов являются твердыми растворами. |
|
Совокупность химических взаимодействий между растворителем и растворенным веществом при образовании растворов называется сольватацией (гидратацией для водных растворов), а образующиеся химические соединения называются сольватами (гидратами для водных растворов). Если раствор находится в равновесии с избытком растворенного вещества, то образуется насыщенный раствор. Растворимость или коэффициент растворимости вещества – это максимальное количество вещества в граммах, растворенного в 100 г растворителя при данной температуре. Если вещество еще может растворяться в данном растворе, то он называется ненасыщенным. Мерой растворимости в данных условиях служит содержание его в насыщенном растворе. Растворимость данного вещества определяется концентрацией его насыщенного раствора. Сведения о растворимости различных веществ в воде при температуре 25 °С помещены в Приложении Г. Растворимость веществ определяется двумя факторами: 1) природой вещества и его агрегатным состоянием; 2) внешними условиями (температура, давление, изменение концентрации веществ и т.д.). Процесс растворения сопровождается тепловым эффектом ± ∆H. |
3.1. Способы выражения концентрации растворов
|
Массовая доля (процентная концентрация) ω – это отношение массы компонента m(x) к массе всего раствора mр-ра.
где m р-ля – масса растворителя, г; ρ – плотность раствора, г/см3; V – объем раствора, л. |
|
Молярная концентрация вещества (молярность) С(х) – это отношение количества вещества n(x), содержащегося в системе, к объему V этой системы.
где m – масса растворенного вещества, г; М – молярная масса вещества, г/моль; V – объем рабочего раствора, л. Единица измерения: моль/л, моль/дм3, моль/м3. Допускается обозначение М. Различают одномолярные (1М), двумолярные (2М), децимолярные (0,1М) и сантимолярные(0,01М) растворы. Например, 1М HCl – одномолярный раствор HCl, т.е. С(HCl)=1моль/л. |
|
Молярная концентрация эквивалентов (нормальность) С(fэквХ) – это отношение количества вещества эквивалентов растворенного вещества n(fэквХ) к объему раствора V.
Единица измерения: моль/л. Допускается обозначение н. Например, 0,1н NaOH – децинормальный раствор NaOH, т.е. С(
|
|
Моляльная
концентрация (моляльность)
Cm(x)
–
это количество растворенного вещества
где
|
|
Мольная
доля
где
|
|
Титр
раствора Т(х)
–
это масса вещества
|

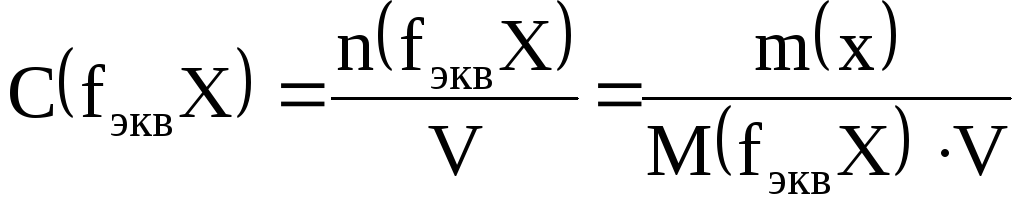 ,
,