- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
5.2. Модель состояния электрона в атоме Квантовые числа
|
Положение электрона в атоме описывается набором из четырех квантовых чисел. Охарактеризовать электронное строение атома – это значит указать значения четырех квантовых чисел для всех его электронов. | |
|
Главное квантовое число (n) определяет размер электронного облака, размер орбитали, номер энергетического уровня и энергию электрона на данном уровне, соответствует номеру периода в таблице Менделеева. |
У атомов элементов первого периода – один энергетический уровень (n = 1), второго периода – 2 уровня (n = 2), третьего – 3 уровня (n = 3) и т.д.
|
|
Орбитальное
квантовое число ( |
Число
орбиталей равно числу значений
Если
|
|
Число
n
обозначается цифрой, а
Например:
Бор – 5В
1s22s22р1
–
это означает, что в атоме бора есть 2
электрона, у которых n
= 1, а
| |
|
Магнитное
квантовое число (
Допускаются лишь строго определенные ориентации электронных облаков в пространстве. |
Число
возможных значений
|
|
ms – магнитное спиновое число характеризует собственный момент количества движения электрона, в результате вращения вокруг собственной оси. Такое движение называется спином. Спин – это собственный момент импульса электрона, не связанный с движением в пространстве. |
Для всех электронов абсолютное значение спина всегда равно s=1/2. Проекция спина на ось z (магнитное спиновое число ms) может иметь лишь два значения: ms = +1/2 или ms = –1/2. |
Возможные значения квантовых чисел
|
n |
l |
ml |
ms |
|
1 |
0 |
0 |
±1/2 |
|
2 |
0, 1 |
0; 1, 0, –1 |
±1/2 |
|
3 |
0, 1, 2 |
0; 1, 0, –1; 2, 1, 0, –1, –2 |
±1/2 |
|
4 |
0, 1, 2, 3 |
0; 1, 0, –1; 2, 1, 0, –1, –2; 3, 2, 1, 0, –1, –2, –3 |
±1/2 |
|
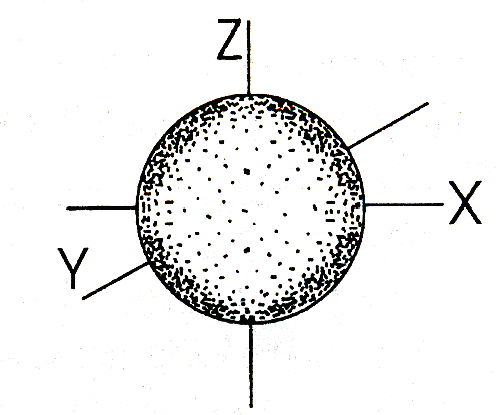
Форма s-электронной орбитали |
Форма d-электронной орбитали |
|
|
|
|
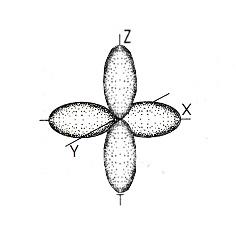
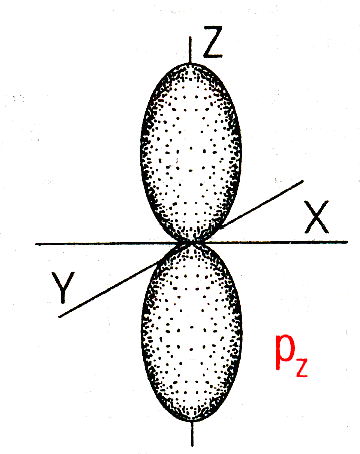
Форма и ориентация p-электронных орбиталей | |
|
| |
|
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. Совокупность электронов с одинаковым квантовым числом n называется электронным слоем или уровнем. Электроны, которые движутся в орбиталях близкого размера и образуют энергетические уровни. Они номеруются от ядра 1;2;3;4;5;6;7. Энергетические
уровни подразделяются на подуровни,
которые отличаются друг от друга
энергией связи с ядром. Совокупность
электронов с одинаковыми значениями
n
и
Число подуровней равно n, но не более 4–х. | |
|
Подуровни состоят из орбиталей: s – первый подуровень состоит из одной s- орбитали; p – второй подуровень состоит из трёх p-орбиталей; d – третий подуровень состоит из пяти d-орбиталей; f – четвёртый подуровень состоит из семи f-орбиталей. |
Схема подразделения энергетических уровней на подуровни
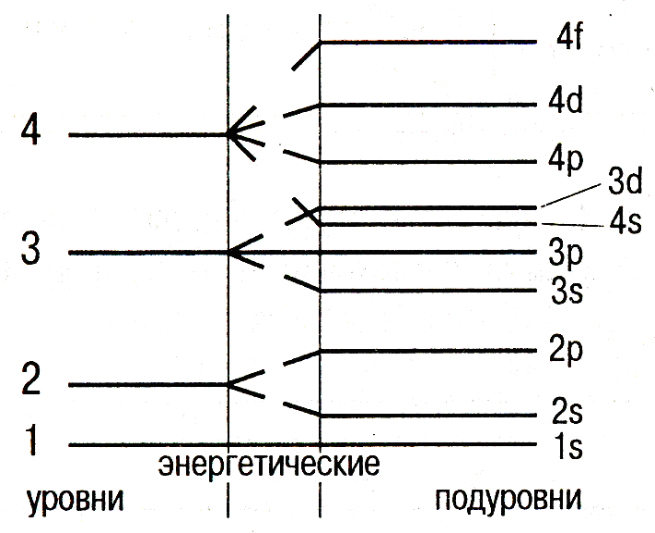
Электронные формулы – показывают распределение электронов по энергетическим уровням и подуровням.
число впереди формулы – номер уровня;
буква – подуровень (тип орбитали);
индекс справа вверху – число электронов на подуровне.