
- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
4.5. Электролиз
|
Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока.
|
Электролиз с инертным анодом
|
Порядок разрядки анионов на аноде: S кислородосодержащие бескислородные
A(+): 2Cl– – 2ē = Cl20 – процесс окисления 2) Кислородосодержащие анионы на аноде из раствора не окисляются, вместо них окисляются молекулы H2O A(+): 2H2O – 4ē = O2 ↑ + 4H+ – окисление |
|
Примеры: 1) Электролиз раствора CuSO4: CuSO4 = Cu2+ + SO42– + H2O (раствор) 2 1 А(+): H2O: 2H2O – 4 ē = O2↑ + 4H+ – окисление 2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+ Если какие-либо ионы не расходуется на электродах, то протекают побочные процессы. Побочные продукты: К(–): нет побочных продуктов, А(+) 2SO42– + 4H+ = 2H2SO4 2CuSO4
+ 2Н2О
2) Электролиз раствора NaCl: NaCl = Na+ + Cl– + H2O (раствор)
1 K(–): Na+, H2O: 2H2O + 2ē = H2↑ + 2OH– – восстановление 1 А(+): Cl– , H2O: 2Cl– – 2ē = Cl2 – окисление Побочные продукты: K(–): 2Na+ + 2OH– = 2NaOH 2NaCl
+ 2Н2О
3) Электролиз раствора Ni(NO3)2: Ni(NO3)2 = Ni2+ + 2NO3– + H2O (раствор) 1
восстановление 1 А(+): NO3–, H2O : 2H2O – 4ē = O2↑ + 4H+ – окисление Побочные продукты: K(–): Ni2+ + 2OH– = Ni(OH)2, А(+): NO3– + 4H+ = 4HNO3 2Ni(NO3)2
+
4H2O
4) Электролиз расплава Ca(OH)2: C 2 K(–): Са2+ + 2ē = Са – восстановление 1 А(+): 4 ОН– – 4ē = O2 + 2H2O – окисление 2Са(ОН)2 |
Электролиз с растворимым анодом
|
Металл растворимого анода соответствует катиону металла в растворе его соли. Пример: раствор CuSO4 (А–Сu) Металл анода при электролизе растворяется, окисляется. 1 1 А(+): Сu0 – 2ē = Cu2+ окисление C Используют для рафинирования (очистки) металлов. |

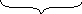
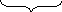 O42–,
NO3–,
OH–,
Cl–,
S2–,
I–
O42–,
NO3–,
OH–,
Cl–,
S2–,
I– K(–): Cu2+
+ 2 ē = Cu0
– восстановление
K(–): Cu2+
+ 2 ē = Cu0
– восстановление
 H2O
+ 2Cl–
= H2↑
+ Cl2↑
+ 2OH–
H2O
+ 2Cl–
= H2↑
+ Cl2↑
+ 2OH–
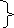
 4H2O
+ Ni2+
= Ni0
+ H2↑
+ 2OH–
+ O2↑
+ 4H+
4H2O
+ Ni2+
= Ni0
+ H2↑
+ 2OH–
+ O2↑
+ 4H+ a(OH)2
= Са2+
2ОН–
a(OH)2
= Са2+
2ОН– 2Са2+
+ 4ОН–
= 2Са + O2
+ 2H2O
2Са2+
+ 4ОН–
= 2Са + O2
+ 2H2O К(–): Cu2+
+ 2ē = Сu восстановление
К(–): Cu2+
+ 2ē = Сu восстановление u
+ Cu2+
= Cu2+
+ Cu
u
+ Cu2+
= Cu2+
+ Cu