
- •1. СТРОЕНИЕ АТОМА
- •2. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- •3. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
- •4. СТРОЕНИЕ КРИСТАЛЛОВ
- •5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •1. ТЕРМОХИМИЯ
- •2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3. ХИМИЧЕСКАЯ КИНЕТИКА
- •1. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ
- •3. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ПРИЛОЖЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
|
|
|
|
Окончание |
|
№ |
Соль |
С, моль/л |
Продукт полного гидролиза |
||
п/п |
Формула |
Значения Ka(b)i |
|||
|
|
||||
898 |
Na2S |
0,004 |
Н2S |
Kа I = 5,7 · 10−8 |
|
Kа II =1,2 · 10 −15 |
|||||
899 |
ZnCl2 |
0,002 |
Zn(OH)2 |
Kb I = 4,4 · 10 −5 |
|
Kb II = 1,5 · 10 −9 |
|||||
900 |
СН3СООK |
0,100 |
СН3СООH |
Kа = 1,8 · 10−5 |
|
901 |
Pb(NO3)2 |
0,060 |
Pb(OH)2 |
Kb I = 9,6 · 10 −4 |
|
Kb II = 3,0 · 10 −8 |
|||||
902 |
K2SiO3 |
0,001 |
H2SiO3 |
Kа I = 2,2 · 10 −10 |
|
Kа II = 1,6 · 10 −12 |
|||||
903 |
K2СО3 |
0,001 |
Н2CO3 |
Kа I = 4,3 · 10 −7 |
|
Kа II = 5,6 · 10 −11 |
|||||
904 |
NaCN |
0,020 |
HCN |
Kа = 4,9 · 10 −10 |
|
905 |
NH4Сl |
0,010 |
NH4OH |
Kb = 1,7 · 10−5 |
|
906 |
KNO2 |
0,001 |
HNO2 |
Kа = 5,1 · 10−4 |
|
907 |
KНСО3 |
0,050 |
Н2CO3 |
Kа I = 4,3 · 10 −7 |
|
Kа II= 5,6 · 10 −11 |
|||||
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ
Примеры решения задач
Задача 1. Потенциал кадмиевого электрода, токопроводящей фазой которого является насыщенный водный раствор гидроксида кадмия Cd(OH)2, при температуре 298,15 K равен 0,55 В. Вычислите значение ПРCd(OH)2 при указанной температуре.
Р е ш е н и е. Используем адаптированную для температуры 298,15 K форму уравнения Нернста для этого электрода:
Cd2 |
0 |
|
0,059 |
2 |
|
||
Cd2 |
2 |
lg[Cd |
|
] |
|||
Cd |
|
Cd |
|
|
|
|
|
|
|
|
|
|
|||
69
Поскольку Cd(OH)2 — малорастворимое соединение, его насыщенный водный раствор является предельно разбавленным, поэтому в приведенном уравнении вместо активности используется равновесная концентрация ионов Cd2+.
После преобразования и подстановки данных находим
|
2 |
|
|
Cd |
2+ |
0 |
|
2+ |
|
|
|
|
|
||
|
|
|
|
|
|
|
Cd |
|
|
|
2( 0,550 |
0,403) |
|
||
2 |
] |
|
|
|
Cd |
|
|
Cd |
|
|
4,98. |
||||
lg[Cd |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
0,059 |
|
|
|
|
0,059 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Отсюда
[Cd2 ] 1,04 10 5; [Cd2 ] = 1,04 10 5 моль/л.
В насыщенном водном растворе Cd(OH)2 устанавливается равновесие, описываемое уравнением
Cd(OH)2 (т) Cd2+(р) + 2ОН(р) .
Видно, что равновесная концентрация ионов ОН– в 2 раза
больше таковой для ионов Cd2+ и, таким образом, составляет
1,04 · 10−5 · 2 = 2,08 · 10−5 моль/л.
По определению ПР этого соединения записывается как
ПРCd(OH)2 = [Cd2+ ] [OH– ]2 .
После подстановки данных в последнее выражение получаем
ПРCd(OH)2 =1,04 10 5 |
(2,08 10 5 )2 |
|
4,50 10 15 (моль/л)3. |
Табличное значение ПРCd(OH)2 = 4,30 10 15 (моль/л)3.
70
Задача 2. С помощью уравнений опишите электродные процессы, протекающие в гальваническом элементе, схема которого такова:
(−) Ag | Pb | Pb2+ || Cu2+ | Cu | Ag (+).
Покажет ли наличие тока амперметр, включенный во внешнюю цепь этого элемента, если относительные активности ионов
aPb2 10 2 , aCu2 10 4 ? Приведите уравнение токообразующей реакции гальванического элемента и рассчитайте значение стан-
дартной константы равновесия этой реакции, а также значение электрической работы, совершаемой в гальваническом элементе.
Р е ш е н и е . Данный гальванический элемент состоит из двух металлических электродов: свинцового и медного. Известно, что катодом в гальваническом элементе является электрод с бóльшим значением потенциала. Так как разность значений стандартных потенциалов этих электродов
Е0 0Cu2 0Pb2 |
0,337 – 0,126 |
|
0,463 В 0,3 В. |
||||
|
Cu |
|
Pb |
|
|
|
|
то по значению стандартных потенциалов можно однозначно сказать, что медный электрод — катод, а свинцовый — анод. В соответствии с этим уравнения электродных процессов таковы:
(−) А: Pb → Pb2+ + 2е–
(+) K: Cu2+ + 2e– → Cu
Далее по адаптированной для температуры 298,15 K форме уравнения Нернста рассчитываем потенциалы свинцового и медного электродов:
|
Pb |
2 |
0 |
|
2 |
0,059 lga |
Pb |
2 0,126 |
0,059 lg10 2 |
0,185 B; |
||
|
|
|
Pb |
|
|
2 |
|
2 |
|
|||
|
Pb |
|
|
Pb |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
71
|
Cu |
2 |
0 |
|
2 |
0,059 lga |
2 |
0,337 |
lg10 4 0,219 В. |
||||
|
|
|
Cu |
|
|
2 |
Cu |
|
|
|
|
||
|
Cu |
|
|
Cu |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||||
Поскольку ЭДС этого гальванического элемента |
|
||||||||||||
|
Е Cu2 |
Pb2 = 0,219 |
– |
0,185 |
0,404 |
В 0, |
|||||||
|
|
|
Cu |
|
|
|
Pb |
|
|
|
|
|
|
то, следовательно, ток во внешней цепи присутствует. Его наличие покажет отклонение стрелки амперметра.
Складывая уравнения анодного и катодного процессов, получаем уравнение токообразующей реакции в ионно-молекулярной форме:
Pb + Cu2+ Pb2+ + Cu
Предварительного подведения баланса электронов с помощью коэффициентов не требуется, так как в анодном и катодном процессах участвует одинаковое число электронов (два). Значение стандартной константы равновесия K0 токообразующей реакции рассчитываем по стандартному уравнению изотермы
∆r G2980 = −R · 298,15 · 2,3 · lgK0,
где
∆r G2980 = −nFE0.
Подставляя в эти два последних уравнения значения постоянных F и R и затем их сочетая, получаем
0 |
|
nE0 |
2 0, 463 |
|
|
lg K |
= |
|
|
0,059 |
15,9 |
0,059 |
|||||
(где n — число электронов, участвующих в токообразующей реакции);
72
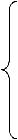
K0 = 4,9 · 1015.
Столь большое значение K0 говорит о сильном смещении положения равновесия в токообразующей реакции вправо, т. е. о практически необратимом ее протекании в направлении продуктов реакции.
Электрическая работа в гальваническом элементе совершается за счет энергии Гиббса, т. е.
A = −∆rG = nFE = 2 · 96485,3 · 0,404 = 77 960,12 Дж.
Задача 3. Электролизу подвергают водный раствор, содержащий смесь солей: бромида цинка ZnBr2 и нитрата меди Cu(NO3)2. Электроды (анод и катод) являются графитовыми. С помощью уравнений описать протекающие при этом электродные процессы, а также привести суммарное уравнение электролиза.
Р е ш е н и е . Хорошо растворимые соли ZnBr2 и Cu(NO3)2 в водном растворе находятся в полностью диссоциированном состоянии (сильные электролиты):
ZnBr2 → Zn2+ + 2Br−; Cu(NO3)2 → Cu2+ + 2NO3−
Таким образом, в растворе присутствуют два вида анионов (Br− и NO3−), два вида катионов (Zn2+ и Cu2+) и молекулы растворителя (Н2О). При участии перечисленных частиц и будут протекать электродные процессы. В анодном процессе могут участвовать
молекулы Н2О и анионы Br− и NO3−, в катодном − молекулы Н2О и катионы Zn2+ и Cu2+.
Возможными анодными полуреакциями являются следующие:
2Н2О → О2↑ + 4Н++ 4ē |
0О2 |
< 0,993 В (при рН > 4) |
|
|
|
Н2О |
|
(+)А: 2Br − → Br2 + 2ē |
0Br2 |
= 1,087 В |
|
|
|
Br |
|
ионы NO3− не окисляются в водных растворах
73

Известно, что на аноде в первую очередь окисляется самый сильный восстановитель — восстановитель с наименьшим значением потенциала.
Несмотря на то что потенциал первой полуреакции меньше ввиду значительного перенапряжения при выделении кислорода, особенно при больших плотностях тока, на аноде происходит вторая полуреакция. При этом в прианодном пространстве накапливаются ионы NO–3.
Возможными катодными полуреакциями являются следующие:
2Н2О + 2ē → Н2↑ + 2ОН− φ0Н2О < − 0,236 В (при рН > 4)
Н2
(−) К: Zn2+ + 2ē → Zn |
0Zn2 |
= − 0,763 В |
|
|
|
Zn |
|
Cu2+ + 2ē → Cu |
0 |
= 0,337 В |
|
|
|
Cu2 |
|
Cu
Известно, что на катоде в первую очередь восстанавливается самый сильный окислитель — окислитель с наибольшим значением потенциала. Выделение водорода, как и кислорода, протекает со значительным перенапряжением, но поскольку наибольшее значение потенциала наблюдается у третьей полуреакции, она и является катодной. Следует отметить, что в прикатодном пространстве накапливаются ионы Zn2+.
Суммарное уравнение электролиза получаем сложением анодной и катодной полуреакций:
2Br− + Cu2+ → Br2 + Cu
Предварительного подведения баланса участвующих электронов не требуется, так как их число в обеих полуреакциях одинаково.
С учетом одновременного накопления нитрат-ионов NO−3 в прианодном пространстве и ионов цинка Zn2+ в прикатодном пространстве итоговое уравнение процесса записываем так:
74

ZnBr2 + Cu(NO3)2 → Br2 + Cu + Zn2+ + 2NO−3
Задача 4. В течение какого времени при температуре Т = 298,15 K следует пропускать ток силой 5 А через 1 л водного раствора хлорида натрия, чтобы значение рН последнего стало равным 12? Рассчитать объемы выделившихся при этом на электродах газов при стандартных условиях. Электроды (анод и катод) графитовые. Анодный и катодный коэффициенты выхода по току
одинаковы и равны 1.
Ре ш е н и е . Так как NaCl — соль, образованная катионом сильного основания и анионом сильной кислоты, в водных рас-
творах она не подвергается гидролизу, т. е. значение рН ее водного раствора равно 7 и [H+] = [OH−] = 10−7 моль/л. В указанном растворе присутствуют три вида частиц: ионы Na+ и Cl− как продукты полной диссоциации соли и молекулы растворителя — воды Н2О. Из сравнения значений потенциалов:
0Cl2 |
= 1,360 В; 0Na = −2,714 В; φ0Н2О = −0,413 В; |
||
Cl |
|
|
Н2 |
|
Na |
||
φ0О2 = 0,816 В
Н2O
c учетом высокого перенапряжения выделения кислорода и водорода находим, что возможными процессами являются следующие (см. решение задачи 3):
(+) А : 2Cl− → Cl2↑ + 2ē
(−) К : 2Н2О + 2ē → Н2↑ + 2ОН−
Далее находим значение гидроксидного показателя рОН конечного раствора и активность а ионов ОН− в нем:
рОН = 14 – рН = 14 – 12 = 2; рОН = –lg aOH ;
aOH = 10−2; aOH = 10−2 моль/л.
75

По соотношению a = Cγ рассчитываем концентрацию ионов ОН– :
COH aOH 10 2 = 1,10 · 10−2 моль/л,
OH 0,905
где OH — коэффициент активности ионов ОН− (справочная ве-
личина).
Число моль эквивалентов ионов ОН−, образовавшихся в результате электролиза, равно
nэкв ОН− = ( COH − 10−7) · V = (1,1 · 10−2 − 10−7 ) · 1=
=1,1 · 10−2 моль экв.
Всоответствии с законом эквивалентов на электродах выделилось такое же число моль эквивалентов газов: на аноде – хлора, на катоде – водорода. Зная при стандартных условиях эквивалентный объем газов, равный 12,225 л/моль экв, находим их объемы:
VCl2 VH2 nэкв Vэкв0 =1,1 · 10−2 · 12,225 = 0,134 л.
Подставляя полученное значение объема в объединенное выражение законов Фарадея
V 0
V Fэкв I ,
находим время электролиза
|
VF |
|
0,134 |
96485,3 |
= 212 с = 3,5 мин. |
|
Vэкв0 I |
12,225 |
5 1 |
||||
|
|
|
Для нахождения последнего можно использовать и такую форму объединенного выражения законов Фарадея:
76

|
|
|
m |
|
Mэкв |
I , |
|
|
тогда |
|
|
|
F |
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
mF |
|
nэквF |
|
1,1 10 2 96485,3 |
212 c. |
||
M эквI |
I |
|
|
5 1 |
||||
|
|
|
|
|
|
|||
Задачи для самостоятельного решения
Задачи 908 — 919. Рассчитайте при стандартной температуре потенциал электрода, электронно-проводящая фаза которого из металла М погружена в насыщенный водный раствор его малорастворимого соединения МАn с известным значением произведения растворимости ПР (см. табл. П3.1).
№ |
М |
МАn |
ПР(МАn) |
№ |
М |
МАn |
ПР(МАn) |
п/п |
п/п |
||||||
908 |
Ni |
Ni(OH)2 |
1,6 · 10−16 |
914 |
Co |
Co(OH)2 |
1,6 · 10−15 |
909 |
Zn |
Zn(OH)2 |
1,4 · 10−17 |
915 |
Pb |
PbSO4 |
1,6 · 10−8 |
910 |
Cu |
CuCO3 |
2,5 · 10−10 |
916 |
Cd |
Cd(CN)2 |
1,1 · 10−8 |
911 |
Sn |
Sn(OH)2 |
6,3 · 10−27 |
917 |
Cu |
Cu(OH)2 |
8,3 · 10−20 |
912 |
Fe |
Fe(OH)3 |
6,3 · 10−38 |
918 |
Ag |
Ag2SO4 |
1,6 · 10−5 |
913 |
Pb |
PbCl2 |
1,6 · 10−5 |
919 |
Cr |
Cr(OH)3 |
6,3 · 10−31 |
Задачи 920 — 929. По приведенным данным (уравнениям полуреакций восстановления и значениям их стандартных потенциалов) напишите ионно-молекулярную форму уравнения токообразующей реакции. Рассчитайте для этой реакции значение стан-
дартной энергии Гиббса rG2980 при стандартной температуре.
№ |
Полуреакции |
О0 ф /Вф , B |
|
п/п |
|
|
|
920 |
MnO2 + 4H+ + 2ē Mn2+ + 2H2O |
+ 1,228 |
|
MnO4– + 4H+ + 3ē MnO2 + 2H2O |
+ 1,692 |
||
921 |
ClO3– + 3H2O + 6ē Cl– + 6OH– |
+ 0,630 |
|
Mn O42 + 4H2О + 4ē Mn2+ + 8OН– |
+ 0,710 |
||
|
77
|
|
|
Окончание |
|
№ |
Полуреакции |
О0 |
ф/Вф , B |
|
п/п |
|
|
|
|
922 |
NO2–+ 5H2О + 6ē NH3 + 7OН– |
+ 0,153 |
|
|
[Al(OH)4] – + 3ē Al + 4OH– |
− 2,236 |
|
||
|
|
|||
923 |
MnO2 + 4H+ + 2ē Mn2+ + 2H2O |
+ 1,228 |
|
|
NO3–+ 10H+ + 8ē NH4++ 3Н2О |
+ 0,870 |
|
||
924 |
Cl2 + 2ē → 2Cl– |
+ 1,359 |
|
|
2ClO3–+ 12H+ + 10ē → Cl2 + 6Н2О |
+ 1,471 |
|
||
925 |
Cr2O27– + 14H+ + 6ē 2Cr3+ + 7H2O |
+1,331 |
|
|
H2O2 + 2H+ + 2ē 2Н2О |
+ 1,770 |
|
||
|
|
|||
926 |
2ClO– + 2H2O + 2ē Cl2 + 4OH– |
+ 0,405 |
|
|
BrO–3 + 2Н2О + 4ē BrO– + 4OH– |
+ 0,540 |
|
||
927 |
2NO2– + 4H2O + 6ē N2 + 8OH– |
+ 0,411 |
|
|
MnO42– + 2H2O + 2ē MnO2 + 4OH– |
+ 0,579 |
|
||
928 |
NO–3+ H2O + ē NО2 + 2OH– |
− 0,859 |
|
|
PbO + H2O + 2ē Pb↓ + 2OH– |
− 0,579 |
|
||
|
|
|||
929 |
S + 2Н+ + 2е Н2S |
+ 0,140 |
|
|
SO32– + 6Н+ + 6е S + 3H2O |
+ 0,450 |
|
||
Задачи 930 — 939. По приведенной ионно-молекулярной форме уравнения токообразующей реакции, протекающей в гальваническом элементе, напишите уравнения анодного и катодного процессов. Рассчитайте значение стандартной константы равновесия данной токообразующей реакции, если известны значения
стандартных потенциалов 0 |
Оф |
и |
0 |
Оф электродных процессов. |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вф |
|
|
|
|
|
|
|
|
|
||||
|
|
1 |
|
Вф 2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ |
|
|
|
|
|
|
0 |
Оф |
, B |
0 |
Оф |
, B |
||
Токообразующая реакция |
|
|
|
|
||||||||||
п/п |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вф 1 |
|
|
Вф 2 |
|
|||
930 |
10Со3+ + Br2 + 6H2O 10Со2+ |
+ 2BrO3– + 12H+ |
+ 1,950 |
+ 1,522 |
||||||||||
931 |
Zn2+ + H2 + 2OH¯ Zn + 2Н2О |
|
|
|
− 0,764 |
− 0,831 |
||||||||
78

Окончание
№ |
|
0 |
Оф |
, B |
0 |
Оф |
, B |
||
Токообразующая реакция |
|
|
|
|
|||||
п/п |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вф 1 |
|
|
Вф 2 |
|
|||
932 |
PbO2 + 2Cl¯+ 4H+ Pb2+ + Cl2 + 2Н2О |
+ 1,461 |
+1,360 |
||||||
933 |
2NO2 + 2I¯ + 4H+ 2NO + I2 + 2H2O |
+ 1,002 |
+ 0,540 |
||||||
934 |
2MnO4 + 5H2S + 6H+ 2Mn2+ + 5S + 8Н2О |
+ 1,518 |
+ 0,171 |
||||||
935 |
Cr2O72 + 3SO2 + 2H+ 2Cr3+ + 3SO42 + H2O |
+ 1,332 |
+ 0,170 |
||||||
936 |
3Cl2 + I− + 3H2O 6Cl− + IO3 + 6H+ |
+ 1,358 |
+ 1,090 |
||||||
937 |
2HNO2 + 2Br− + 2H+ Br2 + 2NO + 2H2O |
+ 0,981 |
+ 1,087 |
||||||
938 |
2MnO4 + 5HNO2 + H+ 2Mn2+ + 5NO3−+ 3H2O |
+ 1,510 |
+ 0,940 |
||||||
939 |
2IO3 + 5MnO2 + 8OH− 5MnO42 + I2 + 4H2O |
+ 0,211 |
+ 0,580 |
||||||
Задачи 940 — 951. Для приведенного гальванического элемента напишите уравнения анодного и катодного процессов, а также токообразующей реакции. По термодинамическим данным рассчитайте значение его стандартной ЭДС при стандартной температуре (см. табл. П2.3).
№Схема гальванического
п/п элемента
940(−) Zn | Zn2+ || Ag+ | Ag (+)
941(−) Pt, H2| H+ || Sn2+, Sn4+| Pt (+)
942(−) Al | Al3+ || Cu2+ | Cu (+)
943(−) Zn | Zn2+ || Ag+ | Ag (+)
944(−) Pt, H2| H+ || Fe2+, Fe3+| Pt (+)
945(−) Ni | Ni2+ || Cu2+ | Cu (+)
№Схема гальванического
п/п элемента
946(−) Fe | Fe2+ || Pb2+ | Pb (+)
947(−) Pt, H2| H+ || Co2+, Co3+| Pt (+)
948(−) Cd | Cd2+ || Sn2+ | Sn (+)
949(−) Mg | Mg2+ || Fe2+ | Fe (+)
950(−) Mn | Mn2+ || Ag+ | Ag (+)
951(−) Pt, Cr2+, Cr3+ || H+ | H2, Pt (+)
Задачи 952 — 961. Гальванический элемент состоит из двух стандартных электродов 1 и 2. Изобразите схему гальванического элемента. Напишите уравнения его электродных процессов, а также уравнение токообразующей реакции. По значениям стан-
дартных электродных |
потенциалов рассчитайте стандарт- |
ную энергию Гиббса |
r G2980 его токообразующей реакции (см. |
табл. П3.1). |
|
79

№ |
|
Электрод |
|
№ |
|
Электрод |
|
||
п/п |
1 |
|
2 |
|
п/п |
1 |
|
2 |
|
952 |
Cu2+ |
| Cu |
Fe2+ |
| Fe |
957 |
Ni2+ |
| Ni |
Au3+ |
| Au |
953 |
Zn2+ |
| Zn |
Pb2+ |
| Pb |
958 |
Mg2+ |
| Mg |
Cu2+ |
| Cu |
954 |
Ag+ | Ag |
Cd2+ |
| Cd |
959 |
Fe2+ |
| Fe |
Zn2+ |
| Zn |
|
955 |
Mn2+ |
| Mn |
Cu2+ |
| Cu |
960 |
Sn2+ |
| Sn |
Ag+ | Ag |
|
956 |
Co2+ |
| Co |
Sn2+ |
| Sn |
961 |
Ni2+ |
| Ni |
Pb2+ |
| Pb |
Задачи 962 — 971. Напишите уравнения электродных процессов и суммарной реакции электролиза водного раствора указанного вещества. Какие вещества и в каком количестве (г или л при ст. у.) выделятся на электродах за время τ при силе тока I и равных катодном и анодном коэффициентах выхода по току β?
|
|
|
|
|
|
|
|
|
|
№ |
Вещество |
τ, ч |
I, A |
β, % |
№ |
Вещество |
τ, ч |
I, A |
β, % |
п/п |
|
|
|
|
|
|
|
|
|
962 |
CuSO4 |
2,1 |
5 |
80 |
967 |
AlCl3 |
4,2 |
5 |
89 |
963 |
NaCl |
0,8 |
10 |
85 |
968 |
AgNO3 |
8,5 |
10 |
77 |
964 |
Pb(NO3)2 |
3,6 |
15 |
76 |
969 |
MgBr2 |
1,6 |
15 |
92 |
965 |
KOH |
1,8 |
20 |
68 |
970 |
HgCl2 |
2,5 |
20 |
90 |
966 |
SnSO4 |
6,3 |
25 |
83 |
971 |
K2S |
3,7 |
25 |
65 |
Задачи 972 — 981. Напишите уравнения электродных процессов и суммарной реакции электролиза водного раствора указанного вещества. Сколько времени потребуется для того, чтобы при силе тока I и равных анодном и катодном коэффициентах выхода по току β выделился указанный при ст. у. объем газа?
|
|
|
|
|
|
|
|
|
|
№ |
Вещество |
I, A |
V, л |
β, % |
№ |
Вещество |
I, A |
V, л |
β, % |
п/п |
|
|
|
|
|
|
|
|
|
972 |
HgCl2 |
5 |
2,4 |
90 |
977 |
AgNO3 |
5 |
0,8 |
84 |
973 |
Cu(NO3)2 |
10 |
1,8 |
75 |
978 |
SnCl2 |
10 |
3,4 |
79 |
974 |
KI |
15 |
0,6 |
88 |
979 |
AgF |
15 |
2,8 |
92 |
975 |
SnSO4 |
20 |
3,7 |
95 |
980 |
CuSO4 |
20 |
1,7 |
66 |
976 |
Na2S |
25 |
4,0 |
80 |
981 |
NaBr |
25 |
4,2 |
96 |
80
Задачи 982 — 991. В двух последовательно соединенных электролизерах находятся водные растворы 1 и 2 соответственно. Напишите уравнения происходящих электродных процессов. Рассчитайте при ст. у. объем газа, выделившегося во втором электролизере, если в первом на катоде выделилось m г металла.
№ |
Раствор 1 |
Раствор 2 |
Газ |
m, г |
|
п/п |
|||||
|
|
|
|
||
|
|
|
|
|
|
982 |
AgNO3 |
H2SO4 |
О2 |
5,6 |
|
983 |
CuCl2 |
K2S |
Н2 |
4,8 |
|
984 |
SnSO4 |
NaCl |
Сl2 |
1,4 |
|
985 |
Pb(CH3COO)2 |
MgCl2 |
Сl2 |
3,5 |
|
986 |
HgCl2 |
Ca(NO3)2 |
О2 |
6,7 |
|
987 |
NiSO4 |
HCl |
Н2 |
8,2 |
|
988 |
Co(NO3)2 |
NaOH |
О2 |
2,9 |
|
989 |
AuCl3 |
KI |
Н2 |
7,1 |
|
990 |
CuSO4 |
AlCl3 |
Сl2 |
9,3 |
|
991 |
AgF |
MgSO4 |
О2 |
10,4 |
Задачи 991 — 1000. Определите металл, выделяющийся на катоде при электролизе водного раствора его нитрата, если известны масса выделившегося металла m, сила тока I, время протекания процесса τ и катодный коэффициент выхода по току β. Напишите уравненияэлектродных процессов исуммарнойреакцииэлектролиза.
№ |
m, г |
I, A |
τ, ч |
β, % |
№ |
m, г |
I, A |
τ, ч |
β, % |
п/п |
|
|
|
|
п/п |
|
|
|
|
991 |
16,1 |
5 |
1 |
80 |
996 |
105,0 |
20 |
2 |
68 |
992 |
15,9 |
7 |
4 |
88 |
997 |
61,1 |
25 |
3 |
74 |
993 |
67,6 |
10 |
3 |
92 |
998 |
63,7 |
10 |
6 |
89 |
994 |
96,8 |
12 |
5 |
77 |
999 |
170,5 |
20 |
4 |
96 |
995 |
89,1 |
15 |
6 |
90 |
1000 |
78,6 |
12 |
7 |
85 |
81
