
- •1. СТРОЕНИЕ АТОМА
- •2. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- •3. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
- •4. СТРОЕНИЕ КРИСТАЛЛОВ
- •5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •1. ТЕРМОХИМИЯ
- •2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3. ХИМИЧЕСКАЯ КИНЕТИКА
- •1. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ
- •3. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ПРИЛОЖЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
Московский государственный технический университет имени Н.Э. Баумана
ВЫПОЛНЕНИЕ ДОМАШНИХ ЗАДАНИЙ ПО КУРСУ ХИМИИ
Методические указания
Москва Издательство МГТУ им. Н.Э. Баумана
2013
1
УДК 54 ББК 24
В92
Авторы:
С.Ю. Богословский, А.М. Голубев, А.А. Гуров, Ж.Н. Медных, П.В. Слитиков, А.Д. Смирнов
Рецензент П.А. Носов
В92 Выполнение домашних заданий по курсу химии : ме-
тод. указания / [C.Ю. Богословский и др.]. — М. : Изд-во МГТУ им. Н.Э. Баумана, 2013. — 98 [6] с.
ISBN 978-5-7038-3673-6
Даны задачи, которые включены в три домашних задания по основным разделам курса химии: «Строение вещества», «Закономерности протекания химических процессов» и «Электрохимические процессы». В каждом разделе приведены примеры решения типовых задач. В приложениях представлены справочные материалы.
Для студентов (бакалавров и специалистов) всех факультетов МГТУ им. Н. Э. Баумана, изучающих базовый курс химии.
Рекомендовано Учебно-методической комиссией Научноучебного комплекса «Фундаментальные науки» МГТУ им. Н.Э. Баумана.
УДК 54 ББК 24
ISBN 978-5-7038-3673-6 |
МГТУ им. Н.Э. Баумана, 2013 |
2

Д О М А Ш Н Е Е З А Д А Н И Е № 1
1. СТРОЕНИЕ АТОМА
Пример решения задачи
Составьте электронную и электронно-графическую формулы атома кремния в основном и возбужденном состояниях. Определите число неспаренных электронов. Укажите магнитные свойства атома кремния в основном состоянии. Отметьте значения главного, орбитального и магнитного квантовых чисел для электронов внешнего энергетического уровня атома кремния в основном состоянии.
Решение. Порядковый номер кремния в Периодической таблице химических элементов Д.И. Менделеева равен 14. Ядро атома кремния содержит 14 протонов, следовательно, заряд равен +14 и вокруг ядра расположено 14 электронов. Электронная и электронно-графическая формулы атома кремния имеют соответственно следующий вид:
1s22s22p63s23p2
14Si n = 3 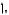

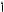

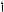

 n = 2
n = 2 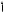

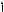


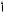


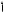

 n = 1
n = 1
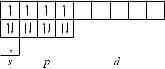
Таким образом, в основном состоянии атом кремния на внешнем электронном уровне содержит два неспаренных электрона (тогда суммарное магнитное спиновое квантовое число Σms ≠ 0) и поэтому является парамагнитным. Квантовые числа имеют следующие значения:
3
Атомная |
|
Значения квантовых чисел |
|
||
орбиталь |
n |
|
l |
|
ml |
3s |
3 |
|
0 |
|
0 |
3p |
3 |
|
1 |
|
−1 и 0 |
При затрате некоторой энергии один 3s-электрон атома кремния может быть переведен на вакантную 3p-орбиталь, при этом энергия атома возрастет, так как возникшая электронная конфигурация (1s2 2s2 2p6 3s1 3p3) будет соответствовать возбужденному состоянию атома кремния 14Si*. Электронно-графическая формула приобретает вид
n = 3 n = 2
n = 1

Задачи для самостоятельного решения
Задачи 1 — 15. По заданным координатам атома (период, группа) найдите элемент в длиннопериодном варианте Периодической системы химических элементов, составьте полную электронную формулу атома, покажите распределение электронов по квантовым ячейкам, укажите магнитные свойства (диамагнитные или парамагнитные) нейтральных атомов данного элемента.
№ |
Период |
Группа |
№ |
Период |
Группа |
№ |
Период |
Группа |
п/п |
п/п |
п/п |
||||||
|
|
|
|
|
|
|
|
|
1 |
5 |
6 |
6 |
4 |
11 |
11 |
4 |
15 |
2 |
4 |
5 |
7 |
4 |
17 |
12 |
5 |
5 |
3 |
3 |
17 |
8 |
5 |
1 |
13 |
3 |
6 |
4 |
2 |
14 |
9 |
4 |
12 |
14 |
3 |
16 |
5 |
4 |
3 |
10 |
4 |
7 |
15 |
5 |
2 |
|
|
|
|
|
|
|
|
|
Задачи 16 — 35. Определите, в каком периоде, группе и подгруппе Периодической системы химических элементов находится элемент, атом которого имеет электронную структуру, выражае-
4
мую электронной формулой. Укажите магнитные свойства (диамагнитные или парамагнитные) нейтральных атомов данного элемента.
№ |
Элек- |
№ |
Элек- |
№ |
Элек- |
№ |
Элек- |
тронная |
тронная |
тронная |
тронная |
||||
п/п |
формула |
п/п |
формула |
п/п |
формула |
п/п |
формула |
16 |
… 4d25s2 |
21 |
… 3d54s2 |
26 |
… 4d15s2 |
31 |
… 5s25p5 |
17 |
… 3d14s2 |
22 |
… 3d104s1 |
27 |
… 3d04s2 |
32 |
… 4d25s2 |
18 |
… 4d105s2 |
23 |
… 4s24p3 |
28 |
… 4f 05d16s2 |
33 |
… 5d54s2 |
19 |
… 3s23p4 |
24 |
… 3d10 4s2 |
29 |
… 4d105s25p1 |
34 |
… 3d104s1 |
20 |
… 3s23p5 |
25 |
… 4d55s15p0 |
30 |
… 3d44s2 |
35 |
… 2s22p5 |
Задачи 36 — 40. Электрон в атоме находится на указанной атомной орбитали (АО). Опишите состояние электрона квантовыми числами n, l, ml.
№ п/п……………….. |
36 |
37 |
38 |
39 |
40 |
АО …………………. |
3d |
4f |
3p |
6d |
7p |
Задачи 41 — 45. Определите, на какой атомной орбитали (s, p или d ) находится электрон, если его состояние характеризуется указанными квантовыми числами n, l, ml. Укажите форму атомной орбитали.
№ п/п……………...... |
41 |
42 |
43 |
44 |
45 |
n…………………....... |
3 |
5 |
4 |
6 |
2 |
l……………………… |
2 |
1 |
2 |
0 |
1 |
ml……………………. |
–2 |
–1 |
+2 |
0 |
+1 |
Задачи 46 — 50. Используя правила Клечковского, определите последовательность заполнения электронами подуровней, для которых суммаквантовых чисел n + l равназаданному значению.
№ п/п ……………… |
46 |
47 |
48 |
49 |
50 |
n + l……….………… |
5 |
7 |
4 |
8 |
6 |
5
Задачи 51 — 56. Напишите полные электронные формулы данного атома в основном и возбужденном состояниях, покажите распределение валентных электронов по квантовым ячейкам, определите число неспаренных электронов. Укажите магнитные свойства атомов (диамагнитные, парамагнитные) в основном состоянии.
№ п/п ………………. |
51 |
52 |
53 |
54 |
55 |
56 |
Атом ……………….. |
S |
As |
Al |
Mn |
Cl |
Ti |
Задачи 57 — 61. Приведите полные электронные формулы атомов в невозбужденном состоянии. Укажите значения квантовых чисел n, l, m для электронов, находящихся на внешнем энергетическом уровне. Определите число неспаренных электронов и магнитные свойства атомов (диамагнитные, парамагнитные).
№ п/п………….……. |
57 |
58 |
59 |
60 |
61 |
Атомы ……………... |
Si, Mn |
Ca, Ti |
Sc, Pb |
Se, Mo |
Cs, Pd |
Задачи 62 — 66. Определите порядковый номер элемента в Периодической таблице химических элементов Д.И. Менделеева, у которого заканчивается заполнение электронами орбиталей данного уровня.
№ п/п………….……. |
62 |
63 |
64 |
65 |
66 |
Подуровень ……….. |
3d |
4p |
4f |
5s |
5d |
Задачи 67 — 78. Напишите полные электронные формулы указанного атома и его иона. Покажите для них распределение электронов внешнего энергетического уровня по квантовым ячейкам. Укажите количество неспаренных электронов в атоме и ионе.
№ п/п |
Атом |
Ион |
№ п/п |
Атом |
Ион |
67 |
S |
S2- |
73 |
Cu |
Cu2+ |
68 |
Ti |
Ti3+ |
74 |
Cr |
Cr3+ |
69 |
Al |
Al3+ |
75 |
Au |
Au3+ |
70 |
Sn |
Sn2+ |
76 |
Sc |
Sc3+ |
71 |
Mn |
Mn2+ |
77 |
Pd |
Pd2+ |
72 |
Co |
Co3+ |
78 |
Ag |
Ag+ |
6
Задачи 79 — 83. Напишите полные электронные формулы атомов указанного ряда. Предскажите изменения (увеличение, уменьшение, постоянство) атомного радиуса и первой энергии ионизации атомов.
№ п/п……………….. |
79 |
80 |
81 |
82 |
83 |
Ряд атомов ………… |
Cl−Br−I |
N−O−F |
N−P−As |
O−S−Se |
Al−Si−P |
Задачи 84 — 97. Объясните изменение первой энергии ионизации в указанном ряду элементов. Составьте полные электронные формулы атомов элементов, покажите распределение электронов по квантовым ячейкам.
№ |
|
|
Элемент |
|
№ |
|
|
Элемент |
|
|
|
|
|
|
|
|
|
|
|||
Первая энергия |
Первая энергия |
|||||||||
п/п |
п/п |
|||||||||
|
|
ионизации, эВ |
|
|
ионизации, эВ |
|||||
84 |
Li |
|
Na |
K |
91 |
Li |
|
Be |
B |
|
|
|
|
|
|
|
|
|
|||
5,39 |
|
5,14 |
4,34 |
5,39 |
|
9,32 |
8,30 |
|||
|
|
|
|
|||||||
85 |
Be |
|
Mg |
Ca |
92 |
C |
|
N |
O |
|
|
|
|
|
|
|
|
|
|||
9,32 |
|
7,64 |
6,11 |
11,26 |
|
14,54 |
13,61 |
|||
|
|
|
|
|||||||
86 |
B |
|
Al |
Ga |
93 |
K |
|
Ca |
Sc |
|
|
|
|
|
|
|
|
|
|||
8,29 |
|
5,98 |
6,00 |
2,36 |
|
1,97 |
1,64 |
|||
|
|
|
|
|||||||
87 |
C |
|
Si |
Ge |
94 |
Na |
|
Mg |
Al |
|
|
|
|
|
|
|
|
|
|||
11,26 |
|
8,15 |
7,88 |
5,14 |
|
7,64 |
5,98 |
|||
|
|
|
|
|||||||
88 |
Cu |
|
Ag |
Au |
95 |
B |
|
C |
N |
|
|
|
|
|
|
|
|
|
|||
7,72 |
|
7,57 |
9,22 |
8,29 |
|
11,26 |
14,54 |
|||
|
|
|
|
|||||||
89 |
Zn |
|
Cd |
Hg |
96 |
O |
|
F |
Ne |
|
9,39 |
|
8,99 |
10,34 |
13,61 |
|
17,42 |
21,56 |
|||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
90 |
N |
|
P |
As |
97 |
Al |
|
Si |
P |
|
14,54 |
|
10,55 |
9,81 |
5,98 |
|
8,15 |
10,55 |
|||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Задачи 98 — 111. Объясните изменение радиусов атомов в указанном ряду атомов элементов. Составьте полные электронные формулы атомов элементов, покажите распределение электронов по квантовым ячейкам.
7
