
- •1. СТРОЕНИЕ АТОМА
- •2. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- •3. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
- •4. СТРОЕНИЕ КРИСТАЛЛОВ
- •5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •1. ТЕРМОХИМИЯ
- •2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3. ХИМИЧЕСКАЯ КИНЕТИКА
- •1. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ
- •3. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ПРИЛОЖЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
№ |
|
Элемент |
|
№ |
|
Элемент |
|
|
п/п |
Радиус атома R·1010 , м |
п/п |
Радиус атома R·1010, м |
|||||
98 |
Li |
Na |
K |
105 |
Li |
Be |
B |
|
|
|
|
|
|
|
|||
1,55 |
1,89 |
2,36 |
1,55 |
1,13 |
0,91 |
|||
|
|
|||||||
99 |
Be |
Mg |
Ca |
106 |
C |
N |
O |
|
1,13 |
1,60 |
1,97 |
0,77 |
0,75 |
0,73 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
100 |
B |
Al |
Ga |
107 |
K |
Ca |
Sc |
|
0,90 |
1,42 |
1,39 |
2,36 |
1,97 |
1,64 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
101 |
C |
Si |
Ge |
108 |
Na |
Mg |
Al |
|
0,77 |
1,34 |
1,39 |
1,89 |
1,60 |
1,43 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
102 |
Sc |
Ti |
V |
109 |
B |
C |
N |
|
1,64 |
1,46 |
1,34 |
0,81 |
0,77 |
0,75 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
103 |
Fe |
Co |
Ni |
110 |
O |
F |
Ne |
|
1,26 |
1,25 |
1,24 |
0,73 |
0,72 |
0,70 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
104 |
N |
P |
As |
111 |
Al |
Si |
P |
|
0,71 |
1,30 |
1,48 |
1,43 |
1,34 |
1,30 |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
2. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Пример решения задачи
Постройте энергетические диаграммы молекулярных орбиталей в молекуле CN и в молекулярном ионе CN– , сравните энергии химических связей этих частиц. В какой из частиц длина связи наименьшая? Укажите диамагнитную и парамагнитную частицы.
Решение. Энергетические диаграммы молекулярных орбиталей данных частиц в упрощенном виде представлены в таблице на с. 9. Видно, что кратности связи в CN и CN− соответственно равны 2,5 и 3. Наименьшей длиной связи характеризуется ион CN−, в котором кратность связи наибольшая. Наличие неспаренного электрона на молекулярной орбитали в CN указывает на парамагнитные свойства, в то время как ион CN− не имеет магнитных свойств (диамагнитные свойства).
8

Энергетическая диаграмма
|
|
CN |
|
|
CN− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задачи для самостоятельного решения
Задачи 112 — 216. Постройте энергетические диаграммы молекулярных орбиталей заданных частиц (молекул и молекулярных ионов), сравните энергии химических связей и укажите диамагнитную и парамагнитную частицы. Номер задачи соответствует заданной молекуле (столбец) и заданному молекулярному иону (строка).
Ион |
|
|
|
Молекула |
|
|
|
||
H2 |
O2 |
B2 |
|
Li2 |
|
Cl2 |
N2 |
C2 |
|
|
|
|
|||||||
N2+ |
112 |
127 |
142 |
|
157 |
|
172 |
187 |
202 |
N2− |
113 |
128 |
143 |
|
158 |
|
173 |
188 |
203 |
O2+ |
114 |
129 |
144 |
|
159 |
|
174 |
189 |
204 |
O2− |
115 |
130 |
145 |
|
160 |
|
175 |
190 |
205 |
H2+ |
116 |
131 |
146 |
|
161 |
|
176 |
191 |
206 |
H2− |
117 |
132 |
147 |
|
162 |
|
177 |
192 |
207 |
B2+ |
118 |
133 |
148 |
|
163 |
|
178 |
193 |
208 |
B2− |
119 |
134 |
149 |
|
164 |
|
179 |
194 |
209 |
C2+ |
120 |
135 |
150 |
|
165 |
|
180 |
195 |
210 |
C2− |
121 |
136 |
151 |
|
166 |
|
181 |
196 |
211 |
He2+ |
122 |
137 |
152 |
|
167 |
|
182 |
197 |
212 |
Cl2+ |
123 |
138 |
153 |
|
168 |
|
183 |
198 |
213 |
Cl2− |
124 |
139 |
154 |
|
169 |
|
184 |
199 |
214 |
Li2+ |
125 |
140 |
155 |
|
170 |
|
185 |
200 |
215 |
Be2+ |
126 |
141 |
156 |
|
171 |
|
186 |
201 |
216 |
9
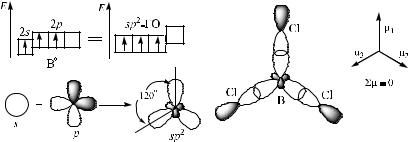
3. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Пример решения задачи
Рассмотрите по методу валентных связей строение молекул ВCl3 и PCl3: укажите тип гибридизации АО центрального атома; изобразите пространственное перекрывание орбиталей; укажите, полярны ли эти молекулы. Поясните, почему значения валентных углов в указанных молекулах составляют 120° и 100,3° соответственно.
Решение. Рассмотреть строение частицы по методу валентных связей, применив модель гибридизации АО, значит определить гибридизацию центрального атома, указать образующийся валентный угол, сколько и каких ( , ) связей содержит частица, каков механизм их образования, а также изобразить пространственное строение частицы и определить ее полярность.
Стабильному состоянию атома бора В отвечает конфигурация [He]2s22p1. Для образования трех ковалентных σ-связей с атомами хлора по обменному механизму необходимо промотировать один электрон с 2s-АО на 2р-АО, тогда возникнет конфигурация возбужденного состояния бора В* [He]2s12p2. В данном случае валентные орбитали атома бора при образовании ковалентных связей будут находиться в состоянии sp2-гибридизации, под углом
120° (рис. 1).
Рис. 1
Молекула представляет собой плоский треугольник, в котором суммарный дипольный момент трех связей равен нулю (Σμ = 0), т. е. молекула ВСl3 неполярна.
10

В молекуле PCl3 центральным атомом является атом фосфора P, электронная конфигурация которого в основном состоянии такова: [Ne]3s23p3. При образовании молекулы PCl3 три атома хлора Cl ([Ne]3s23p5) образуют с атомом фосфора, находящимся в основном состоянии, три σ-связи по обменному механизму. При этом у атома фосфора образуются четыре sp3-ГО, на которых располагаются пять электронов. Таким образом, молекула PCl3 представляет собой тригональную пирамиду с валентным углом Cl–P–Cl 100,3°. Искажение валентного угла происходит из-за наличия несвязывающей электронной пары (НЭП).
Рис. 2
Молекула PCl3 является полярной, так как суммарный дипольный момент связей, также из-за наличия НЭП, по правилу сложения векторов не равен нулю (Σμ ≠ 0).
С позиции теории отталкивания электронных пар валентных орбиталей (ОЭПВО) рассматриваемые молекулы относятся к различным геометрическим типам, что уже само по себе должно приводить к различному пространственному строению молекул. Так, молекула ВCl3 относится к типу АХ3, тогда как молекула PCl3 — к типу АХ3Е.
Согласно одному из правил теории ОЭПВО, НЭП занимает в пространстве больший объем, чем пара электронов, образующих σ-связь, поэтому вследствие отталкивания типа Е — Х валентный угол в молекуле PCl3 меньше 109,5° и составляет 100,3°.
11
Задачи для самостоятельного решения
Задачи 217 — 240. Рассмотрите по методу валентных связей строение молекулы: а) укажите тип гибридизации орбиталей центрального атома; б) изобразите пространственное перекрывание орбиталей; в) объясните значение экспериментально найденного валентного угла; г) определите типы присутствующих в молекуле связей (σ, π).
№ |
Молекула |
Валентный |
№ |
Молекула |
Валентный |
|
п/п |
угол, град |
п/п |
угол, град |
|||
|
|
|
|
|
|
|
217 |
BF3 |
F−Be−F 120 |
229 |
SiH4 |
H−Si−H 109,5 |
|
|
|
|
|
|
|
|
218 |
CCl4 |
Cl−C−Cl 109,5 |
230 |
SiO2 |
O−Si−O 180 |
|
|
|
|
|
|
|
|
219 |
COF2 |
F−C−F 108; |
231 |
POCl3 |
Cl−P−Cl 104; |
|
F−C−O 126 |
Cl−P−O 115 |
|||||
|
|
|
|
|||
220 |
C2H4 |
H−C−H; |
232 |
PCl3 |
Cl−P−Cl 100 |
|
H−C−C 120 |
||||||
|
|
|
|
|
||
221 |
CH2Cl2 |
H−C−Cl 108; |
233 |
PF5 |
F−P−F 120; |
|
Cl−C−Cl 107 |
F−P−F* 90 |
|||||
|
|
|
|
|||
222 |
CO2 |
O−C−O 180 |
234 |
SCl2 |
Cl−S−Cl 103 |
|
|
|
|
|
|
|
|
223 |
C2H2 |
H−C−C 180 |
235 |
SF6 |
F−S−F 90 |
|
|
|
|
|
|
|
|
224 |
NF3 |
F−N−F 102 |
236 |
CS2 |
S−C−S 180 |
|
|
|
|
|
|
|
|
225 |
AsF5 |
F−As−F 120; |
237 |
SCl4 |
Cl−S−Cl 104; |
|
F−As−F* 90 |
Cl−S−Cl* 89 |
|||||
|
|
|
|
|||
226 |
NOCl |
O−N−Cl 113 |
238 |
H2S |
H−S−H 92 |
|
|
|
|
|
|
|
|
227 |
HOF |
H−O−F 97 |
239 |
OF2 |
F−O−F 103 |
|
|
|
|
|
|
|
|
228 |
AlCl3 |
Cl−Al−Cl 120 |
240 |
CNCl |
N−C−Cl 180 |
|
|
|
|
|
|
|
Задачи 241 — 256. Объясните с позиции метода валентных связей геометрическую форму приведенной частицы: а) укажите тип гибридизации орбиталей центрального атома; б) установите количество связей и механизм их образования; в) изобразите пространственное перекрывание орбиталей; г) определите, полярна ли приведенная частица?
12

№ |
Частица |
Геометрическая |
№ |
Частица |
Геометрическая |
п/п |
форма |
п/п |
форма |
||
241 |
[BH4]− |
Тетраэдр |
249 |
[GeF6]2− |
Октаэдр |
242 |
[AlF6]3− |
Октаэдр |
250 |
NH2− |
Угловая |
243 |
[BeF4]2− |
Тетраэдр |
251 |
NH4+ |
Тетраэдр |
244 |
[BrF2]− |
Линейная |
252 |
NO2+ |
Линейная |
245 |
[BrF2]+ |
Угловая |
253 |
[PCl4]+ |
Тетраэдр |
246 |
[BrF4]− |
Плоский квадрат |
254 |
[PF6]− |
Октаэдр |
247 |
[BrF4]+ |
Квадратная |
255 |
[SF3]+ |
Тригональная |
|
[GaCl4]– |
пирамида |
|
[SiF6]2− |
пирамида |
248 |
Тетраэдр |
256 |
Октаэдр |
Задачи 257 — 272. Рассмотрите с позиции метода валентных связей строение частиц, имеющих одинаковую геометрическую форму: а) определите тип гибридизации орбиталей центрального атома; б) изобразите пространственное перекрывание орбиталей; в) установите количество и типы связей (σ, π), присутствующих в частице.
№ |
Частица 1 |
Валентные |
Частица 2 |
Валентные |
Геометрическая |
||
п/п |
углы, град |
углы, град |
форма |
||||
257 |
BeCl2 |
Cl−Be−Cl 180 |
NO2+ |
O−N−O 180 |
Линейная |
||
258 |
CS2 |
S−C−S 180 |
HCN |
H−C−N 180 |
Линейная |
||
259 |
C2H2 |
H−C−C 180 |
[BrF2]− |
F−Br−F 180 |
Линейная |
||
260 |
AlCl3 |
Cl−Al−Cl 120 |
CSCl2 |
Cl−C−Cl 112; |
Плоский |
||
Cl−C−S 124 |
треугольник |
||||||
|
|
|
|
|
|||
261 |
NOCl |
O−N−Cl 113 |
SF2 |
|
F−S−F 98 |
Угловая |
|
262 |
NH2 |
H−N−H 104 |
H2O |
|
H−O−H 105 |
Угловая |
|
263 |
H2Se |
H−Se−H 91 |
[BrF2]+ |
F−Br−F 94 |
Угловая |
||
264 |
ClO2 |
O−Cl−O 111 |
SiF2 |
|
F−Si−F 101 |
Угловая |
|
265 |
AsF3 |
F−As−F 96 |
H3O+ |
H−O−H 109 |
Пирамида |
||
266 |
SOF2 |
O−S−F 107; |
NH3 |
|
H−N−H 107 |
Пирамида |
|
F−S−F 93 |
|
||||||
267 |
CF4 |
F−C−F |
[BF4]− |
F−B−F 109,5 |
Тетраэдр |
||
|
|
109,5 |
|
|
|
|
|
268 |
+ |
H−N−H 109,5 |
POCl3 |
Cl−P−Cl 104; |
Тетраэдр |
||
NH4 |
Cl−P−O 115 |
||||||
|
|
|
|
|
|
||
269 |
SiF4 |
F−Si−F 109,5 |
[BeCl4]2− |
Cl−Be−Cl 109,5 |
Тетраэдр |
||
270 |
ClF5 |
F−Cl−F 90; |
[AsF5] |
2− |
F−As−F 90; |
Квадратная |
|
F−Cl−F* 86 |
|
F−As−F* 88 |
пирамида |
||||
271 |
SCl6 |
Cl−S−Cl 90 |
[SiF6]2− |
F−Si−F 90 |
Октаэдр |
||
272 |
[AlF6]3− |
F−Al−F 90 |
[GeF6]2− |
F−Ge−F 90 |
Октаэдр |
||
13
