
- •1. Центральный (прикорневой) рак:
- •2. Периферический рак:
- •3. Атипические формы:
- •I. Первичные симптомы:
- •II. Симптомы (синдромы) местно распространенного рака:
- •III. Симптомы отдаленных метастазов: поражение ЦНС, метастазы в печени, л.у. отдаленных групп, костные метастазы, метастазы в надпочечники и др.
- •1. эндокринопатии: синдром Кушинга, карциноидный синдром (гиперпродукция серотонина, брадикининов, катехоламинов), гинекомастия, акромегалия, гипогликемия и др.
- •2. нервно-мышечные симптомы: энцефалопатия, подострая дегенерация мозжечка, периферические нейропатии, неврит зрительного нерва, полимиозит
- •1. Обязательные методы диагностики:
- •2. Уточняющая диагностика – для всесторонней оценки топографии первичного опухолевого очага и зон потенциального метастазирования: компьютерная (ЯМР) томография, остеосцинтиграфия, ангиография, лапароскопия и др.
- •3) химиотерапия – особенно эффективна у больных мелкоклеточным раком легкого
- •в) осложнения рака желудка:
- •4. Функциональное исследование почек:
- •5. Специальные методы исследования почек:
- •Диагностика подагры:
- •Классификация СВ в зависимости от калибра пораженных сосудов:
- •Клинические признаки, которые позволяют заподозрить диагноз системного васкулита:
- •Диагностика причин кровотечения из верхних отделов ЖКТ:
- •КЛИНИЧЕСКАЯ АЛЛЕРГОЛОГИЯ И ИММУНОЛОГИЯ
Основная цель лечения: достижение и продление ремиссии заболевания, снижение риска развития осложнений, улучшение качества жизни пациентов.
1.При низкой активности заболевания – аминосалицилаты внутрь со снижением дозы при достижении ремиссии (месалазин 3-4 г/сут внутрь, поддерживающая доза 1 г/неделю, сульфасалазин 3-6 г/сут внутрь).
2.При обострениях средней тяжести и тяжелом течении заболевания, при недостаточной эффективности от лечения аминосалицилатами – ГКС (преднизолон внутрь 40-60 мг/сут или будесонид внутрь 9 мг/сут) с постепенным снижением дозы на 5 мг/нед.
3.При недостаточной эффективности ГКС или их непереносимости – иммунодепрессанты (азатиоприн внутрь 2,5 мг/кг/сут, метотрексат 25 мг в/м один раз в неделю или перорально по 5 мг через день)
4.При присоединении бактериальных инфекций – АБ (ципрофлоксацин, метронидазол).
5.При отсутствии эффекта от консервативного лечения, при возникновении осложнений – хирургическое лечение.
БОЛЕЗНИ ПОЧЕК
45. Критерии оценки функционального состояния почек. Основные методы исследования и их трактовка.
1.Общеклиническое исследование мочи – позволяет изучить ее физические свойства, химический состав, состав осадка, сделать бактериологический посев. Для исследования собирают среднюю порцию мочи после туалета наружных половых органов в чистую посуду. Основные показатели ОАМ:
а) прозрачность - в норме моча прозрачная; помутнение мочи может быть вызвано солями, клеточными элементами, слизью, бактериями и т. д.
б) цвет – зависит от концентрации мочи, колеблется от соломенно-желтого до янтарно-желтого; при сильном разведении или низкой относительной плотности моча на фоне ХПН, приема диуретиков моча бесцветная, при появлении в ней билирубина – зеленоватая или зелено-бурая, при макрогематурии – цвета мясных помоев или красная, при приеме амидопирина – красная и др.
в) запах – в норме нерезкий, специфический; при наличии кетоновых тел (ацетонемический криз) моча с запахом ацетона, при врожденных нарушениях метаболизма запах специфический (мышиный, кошачьей мочи, гниющей рыбы)
г) реакция – в норме кислая или слабокислая; при преобладании в рационе овощной диеты, приеме щелочных минеральных вод, после обильной рвоты, при гипокалиемии, при наличии фосфатных камней моча щелочная д) удельный вес – в норме колеблется в широких пределах - от 1,001 до 1,040; удельный вес мочи повышается при глюкозурии,
протеинурии и др., понижается при нарушении концентрационной способности почек; при относительной плотности мочи ниже 1,008 - гипостенурия; 1,008-1,010 - изостенурия; 1,010-1,030 - гиперстенурия.
е) химический состав – при исследовании ОАМ определяют, не содержатся ли в ней патологические составные части (белок – в норме до 0,033 г/л , глюкоза – в норме в следовых количествах, билирубин, уробилин, ацетон, гемоглобин, индикан).
ж) клеточные элементы:
1)лейкоциты - в норме при ОАМ находят до 1-3 лейкоцитов в поле зрения в виде небольших зернистых клеток округлой формы (нейтрофилов); при увеличении числа лейкоцитов свыше 20 – лейкоцитурия: нейтрофильная – при банальной инфекции мочевыводящих путей, пиелонефрите, туберкулезе почек, мононуклеарная – при ГН, интерстициальном нефрите, моноцитарная – при СКВ, эозинофильная – при аллергозах
2)эритроциты - в норме при ОАМ находят до 1-3 свежих или выщелоченных эритроцитов в поле зрения, при этом морфология эритроцитов зависит от осмолярности мочи; эритроцитурия (гематурия) может быть слабовыраженной – микрогематурия, когда эритроцитов до 200 в поле зрения и выраженной – макрогематурия, когда эритроцитов более 200 в поле зрения, а гематурия определяется даже при макроскопическом исследовании мочи Для определения уровня гематурии применяют 3-х стаканную пробу: больной мочится последовательно в 3 сосуда; при кровотече-
нии из мочеиспускательного канала гематурия наибольшая в 1-й порции, при кровотечении из мочевого пузыря и/или простаты - в последней порции, при других источниках кровотечения эритроциты распределяются равномерно во всех 3-х порциях.
3)цилиндры – белковые или клеточные образования канальцевого происхождения (слепки), имеющие цилиндрическую форму и различную величину; бывают гиалиновыми, зернистыми, восковидными, эпителиальными, эритроцитарными, лейкоцитарными и др.; в норме могут появиться при физической нагрузке, лихорадке, ортостатической протеинурии; при нефротическом синдроме обнаруживаются гиалиновые цилиндры, при тяжелых дегенеративных поражениях канальцев – зернистые, при гематурии почечного генеза – эритроцитарные.
з) соли в моче - соли выпадают в осадок при их большой концентрации; ураты (мочекислые соли) встречаются при лихорадке, физической нагрузке, больших потерях воды, лейкозе, нефролитиазе (при нефролитиазе также встречаются единичные кристаллы фосфорнокислого кальция и аморфных фосфатов в виде «крышек гробов», мочекислого аммония); оксалаты кальция в виде «конвертов» выделяются при подагре, мочекислом диатезе, интерстициальном нефрите и) слизь – в норме в моче не встречается; обнаруживается при воспалительных заболеваниях мочевыводящих путей и дисметаболических нарушениях
2.Бактериологическое и бактериоскопическое исследования мочи – проводится при необходимости выяснения инфекционной природы патологии мочевыводящих путей; наличие бактерий в свежевыпущенной моче (бактериурия) наблюдается при воспалительных заболеваниях мочевыводящих путей и оценивается по количеству (мало, умеренно, много) и типу флоры (кокки, палочки); посев мочи дает возможность выявить вид возбудителя и его чувствительность к антибактериальным препаратам.
3.Количественные методы исследования мочи - используют при отсутствии патологической лейкоцитурии и эритроцитурии. а) проба Аддиса-Каковского - соотношение лейкоцитов, эритроцитов, цилиндров – до 2 млн, 1 млн, 5 тыс. в суточном
объеме мочи б) проба Амбурже – соотношение лейкоцитов, эритроцитов, цилиндров – до 2000, 1000 и 20 в полученной за 1 мин моче
в) проба Нечипоренко - используют порцию утренней свежевыпущенной мочи из средней струи, соотношение лейкоцитов и эритроцитов - до 2000 и 1000 соответственно в 1 мл мочи
4. Функциональное исследование почек:
а) проба Зимницкого – функциональный тест для определения концентрационной способности почек, а также соотношения дневного и ночного диуреза; в течение суток собирается 8 трехчасовых порций мочи при произвольном мочеиспускании и водном режиме, к дневному диурезу относят порции, полученные с 9.00 до 21.00, к ночному – с 21.00 до 9.00; в норме дневной диурез значительно превышает ночной и составляет 2/3-3/4 от общего количества суточной мочи; никтурия (увеличение ночного диуреза) характерно для ХПН; определение относительных плотностей в каждой из 8 порций позволяет установить концентрационную способность почек, если ее максимальное значение 1,012 и менее (гипостенурия) или имеется ограничение колебаний относительной плотности в пределах 1,008-1,010 (изостенурия) – выраженное нарушение концентрационной функции почек
б) определение СКФ по клиренсу эндогенного креатинина (проба Реберга-Тареева)
Клиренс - условное понятие, характеризующееся скоростью очищения крови, определяется объемом плазмы, который целиком очищается почками от того или иного вещества за 1 мин, расчитывается по формуле: клиренс = концентрация тест в-ва в моче x величина минутного диуреза / концентрация тест-вещества в плазме.
в) проведение нагрузочных проб, определение концентрации в крови мочевины, индикана, остаточного азота, электролитов и др. методы функционального исследования
5. Специальные методы исследования почек:
а) обзорный снимок (рентгенограмма) – позволяет выявить размеры почек, их контуры, тени конкрементов (в основном из солей кальция)
68
б) внутривенная (экскреторная) урография с применением контрастных веществ (уротраста, верографина) - позволяет оценить анатомо-функциональные особенности почек и мочевых путей, уродинамику, проконтролировать динамику патологического процесса
в) цистоуретрография – используется для исследования нижних отделов мочевыделительной системы; позволяет оценить положение, форму, размер мочевого пузыря, его контуры, определить опухоль, инородное тело, камни, дивертикулы, уретроцеле, пузырно-мочеточниковый рефлюкс
г) ретроградная пиелография – позволяет изучить строение и функцию чашечно-лоханочной системы д) почечная ангиография – позволяет выявить добавочные сосуды почек, их локализацию и распределение почечной
паренхимы, зону кровоснабжения отдельных сосудов, кисту почки, диспластические изменения, сморщенность почки е) радиоизотопная ренография – основана на свойстве канальцев почек избирательно извлекать йод-131- гиппурат из
кровотока с последующим выведением его мочой, при этом накопление и выведение гиппурата регистрируются с помощью сцинтилляционных датчиков, устанавливаемых над областью почек, и представляются (суммируются) в виде 2-х кривых - ренограммы правой и левой почек;
ж) статическая сцинтиграфия почек (сканирование) - позволяет выявить образования в паренхиме (кисты, опухоли) и очаги деструкции
з) термография (тепловидение) - позволяет в ряде случаев судить об активном воспалительном процессе или злокачественном новообразовании
и) УЗИ почек и забрюшинного пространства - позволяет судить о размере, положении, форме, структуре и функциональном состоянии почек, исключить наличие камней, кист, опухолей, полостных отеков, оценить почечный кровоток
46. Острый гломерулонефрит: этиология, патогенез, клинические варианты, диагностика, принципы лечения.
Острый гломерулонефрит (ОГН) – острое двустороннее диффузное иммуновоспалительное заболевание почек с преимущественным поражением почечных клубочков, а также с вовлечением канальцев и (реже) интерстициальной ткани.
Этиология ОГН:
1) инфекции (80%):
а) бактериальные – нефритогенные штаммы (12, 49) β-гемолитического стрептококка группы А (80% всех инфекционных ОГН; ОГН возникает через 6-12 дней после тонзиллитов, скарлатины, фарингитов, отита, синусита), стафилококки и др.
б) вирусные – гепатит В, С, краснуха, герпес, аденовирус в) паразитарные – малярия, шистосомоз, трихинеллез
2)токсические вещества (органические растворители, алкоголь, свинец, ртуть, ЛС: АБ, лазикс)
3)экзогенные неинфекционные антигены, действующие с вовлечением иммунных механизмов (прививки, сыворотки) Предрасполагающие факторы: наследственная предрасположенность (HLA B12, DRw6, DRw4); повышенная семейная восприимчи-
вость к стрептококковой инфекции; хронические очаги инфекции в организме; гиповитаминозы; охлаждение.
Патогенез пострептококкового ОГН:
1.Антигены нефритогенных штаммов стрептококков (эндострептолизин, стрептолизин-О, НАД-нуклеотидаза, дезоксирибонуклеаза В, гиалуронидаза) индуцируют выработку АТ, при этом часть АГ осаждается на базальной мембране клубочковых капилляров, а часть – циркулирует в крови.
2.Образовавшиеся АТ связывают АГ с образованием иммунных комплексов, в конечном счете фиксирующихся на базальной мембране клубочковых капилляров. Иммунные комплексы вызывают активацию системы комплемента, выделение хемотаксинов, привлечение нейтрофилов, что приводит к повреждение эндотелия и увеличению его проницаемости; также активируется фактор Хагемана, происходит агрегация тромбоцитов и отложение фибрина в капиллярах клубочков.
Морфологические формы ОГН: пролиферативный эндокапиллярный, пролиферативный экзокапиллярный, мезангиопролиферативный, мезангиокапиллярный, склерозирующий.
Клинические варианты ОГН:
а) классическая триадная: мочевой синдром + отечный синдром + артериальная гипертензия б) бисиндромная форма: мочевой синдром + артериальная гипертензия ИЛИ нефротический синдром
в) моносиндромная форма: изолированный мочевой синдром (иногда выделяют также моносимптомные отечную, гипертоническую, гематурическую формы)
г) нефротический синдром.
Основные клинические синдромы:
а) мочевой синдром – протеинурия (от 1 до 3 г/л и более), эритроцитурия (микрогематурия – чаще, число эритроцитов от 5-15 до 50-100 в поле зрения, макрогематурия – реже, моча цвета «мясных помоев»), цилиндрурия (чаще гиалиновые цилиндры)
б) отечный синдром: отеки - ранний признак заболевания у большинства больных; располагаются преимущественно на лице («лицо нефритика»), бледные, плотные, теплые, следы от надавливания не характерны, появляются после ночи, исчезают обычно через 2-3 недели; в тяжелых случаях возникает экссудативные плеврит, перикардит, асцит (причина нефритических отеков – снижение СКФ)
в) артериальная гипертензия – ранний признак заболевания у большинства больных; АД может быть повышено до умеренных, реже - до высоких цифр (180/120 мм рт.ст. и выше), возможно развитие ОЛЖН (причина гипертензии - гиперволемия и увеличение ОПС сосудов при активации РААС)
г) нефротический синдром: 1) массивная протеинурия больше 3 г/сут 2) гипопротеинемия (55 г/л и меньше) с диспротеинемией
3)гиперхолестеринемия (из-за компенсаторного усиления синтеза ХС при гипопротеинемии)
4)выраженные стойкие гипопротеинемические отеки (на ногах в положении стоя, на спине в положении лежа, мягкие, оставляют следы от надавливания, появляются быстро, т.е. это не нефритические, а нефротические отеки)
Клиника классической триадной формы ОГН:
-острое начало заболевания, иногда с явления ОЛЖН или судорожного синдрома («церебральный дебют»)
-жалобы на выраженную слабость, жажду, головные боли, тошноту, рвоту, интенсивные боли в пояснице с обеих сторон (чаще вместо боли – чувство холода или тяжести в пояснице)
-характерна олигурия (иногда может быть и анурия с умеренной азотемией), моча цвета «мясных помоев», протеинурия
-артериальное давление в пределах 140-160/90-110, иногда выше 180/120 мм рт.ст., но снижается сравнительно быстро
-быстро появляются отеки на лице, веках, туловише, сопровождаются бледностью и сухостью кожи; могут быть «скрытые» отеки, определяемые при взвешивании больного
Диагностика ОГН:
1. Лабораторные методы исследования:
1)ОАК: снижение уровня гемоглобина (из-за гемодиллюции), умеренное повышение СОЭ
2)БАК: гипопротеинемия с диспротеинемией (гипоальбуминемия, преобладание 2- и реже -глобулинов), гиперлипидемией
(проявления нефротического синдрома); снижение концентрации СН50 (отражает гемолитическую активность комплемента) и С3компонента комлемента; повышение мочевины и креатинина (при наличии ОПН)
3)ОАМ: протеинурия, гематурия; относительная плотность мочи не снижена
4)анализ мочи по Нечипоренко: гематурия (микроили макро-), эритроцитарные цилиндры
5)анализ мочи по Зимницкому: сохранение концентрационной функции почек
69
6)проба Реберга-Тареева: снижение СКФ
7)определение суточной протеинурии
2. Иструментальные методы исследования:
1)УЗИ почек: размеры органа не изменены или слегка увеличены, ткань отечна, чашечно-лоханочная система не изменена
2)мазок из зева – для выявления стрептококков
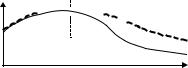
секреторный |
экскреторный |
3) |
изотопная ренография – в/в вводится гиппуран, меченый йодом, который избирательно на- |
сегмент |
сегмент |
|
капливается в почках и выводится только через них, затем ставится 2 датчика на поясницу и |
норма |
|
|
1 – на область сердца; кривая состоит из двух отрезков: секреторный сегмент говорит о рабо- |
ГН |
|
|
те клубочков и их способности захватывать из крови гиппуран, экскреторный – о работе ка- |
|
|
нальцев и собирательных трубочек; при ГН снижена почечная секреция, поэтому первый от- |
|
|
|
|
резок расположен ниже нормы. |
|
|
3) |
почечная биопсия – для морфологической верификации диагноза и подбора оптимального |
|
|
лечения.
Исходы ОГН: а) полное выздоровление б) летальный исход (чаще при осложнениях – эклампсии, ОЛЖН) в) переход в хроническое течение (1/2-1/3 всех случаев)
Принципы лечения ОГН:
1.Госпитализация в нефрологический стационар (4-8 недель), при выраженных отеках, АГ, значительных изменениях в моче – постельный режим (вплоть до улучшения состояния, но минимум 2 недели); диета № 7 (бессолевая): ограничение соли, ограничение потребления воды (суточный диурез + 400 мл), ограничение белков; ежедневный контроль выпитой и выделенной жидкости, контроль АД
2.Воздействие на стрептококковую инфекцию при высоких титрат антистрептококковых АТ и/или четкой связи ОГН с перенесенной стрептококковой инфекцией – бензилпенициллин по 1 млн – 2 млн ЕД/сут в/м 7-10 дней.
3.Подавление аутоиммунных реакций: при затянувшемся ОГН, наличии нефротического синдрома – ГКС (преднизолон 50-60 мг/сут 1,0-1,5 мес. с последующим постепенным снижением дозы), при неэффективности или противопоказании к ГКС – цитостатики.
4.Снижение свертывающей активности крови – рекомендуется при нефротическом синдроме (гепарин)
5.Диуретики – при выраженных отеках: фуросемид 20-80 мг 1 раз/сут
7.Лечение АГ: медикаментозная терапия показана при неэффективности диеты и постельного режима (ингибиторы АПФ, бетаблокаторы, блокаторы кальциевых каналов)
8.Санаторно-курортное лечение – показано не ранее, чем через 6 мес. после ОГН (приморские курорты).
Профилактика обострений гломерулонефрита:
1)лица, перенесшие ОГН, ставятся на диспансерный учет; обязательно проводится санация очаговой инфекции (особенно в миндалинах!)
2)противопоказана работа, связанная с переохлаждением, во влажной среде
3)лицам, страдающим аллергическими заболеваниями (крапивница, БА) противопоказаны профилактические вакцинации
47. Хронический гломерулонефрит: этиология, патогенез, клинические и морфологические варианты, диагностика, исходы, принципы лечения.
Хронический гломерулонефрит (ХГН) – группа длительно протекающих (не менее 1 года) иммунновоспалительных заболеваний почек, разных по происхождению и морфологическим проявлениям, характеризующихся первичным поражением клубочкового аппарата почек с последующим развитием гломерулосклероза и ХПН.
Этиология ХГН: 1) следствие не излеченного или своевременно не диагностированного ОГН
Предрасполагающие факторы для хронизации ОГН: наличие в организме и обострение очагов стрептококковой инфекции; повторные охлаждения (особенно влажный холод); неблагоприятные условия труда и быта; травмы; злоупотребление алкоголем и др.
2)длительно существующие очаги инфекции любой локализации (первично-хронический ГН)
3)продолжительное воздействие на почки ряда химических агентов (ЛС)
4)вакцинация (у предрасположенных к иммунокомплексным заболеваниям лиц)
Патогенез ХГН:
Аналогичен патогенезу ОГН (см. вопрос 50), но при этом макрофагальная реакция организма оказывается недостаточной и отложившиеся иммунные комплексы не удаляются из тканей почки, что приводит к хроническому течению воспалительного процесса. Патоморфология ХГН: воспаление клубочков (инфильтрация клетками воспаления); очаговая или диффузная пролиферация мезангиальных, эпителиальных или эндотелиальных клеток.
Морфологические варианты ХГН:
1. Невоспалительные:
а) минимальные изменения клубочков – гистологические изменения клубочков выявляются лишь при электронной микроскопии, при световой они кажутся интактными; клинически выраженный нефротический синдром с массивными отеками; очень эффективны ГКС (отеки могут исчезнуть за первую неделю терапии); благоприятный прогноз (ХПН развивается редко)
б) фокально-сегментарный гломерулосклероз (ФСГС) – гистологически в части клубочков – склероз отдельных капиллярных петель; характерен для ВИЧ-инфекции, парентерального введения наркотиков; клинически - персистирующая протеинурия или нефротический синдром в сочетании с эритроцитурией и АГ; течение прогрессирующее, прогноз серьезный (один из самых неблагоприятных морфологических вариантов)
в) мембранозный (мембранозная нефропатия) – гистологически диффузное утолщение стенок капилляров клубочков с их расщеплением и удвоением, массивные отложения ИК на базальной мембране; часто ассоциирован с ВГВ; клинически – протеинурия или нефротический синдром; течение относительно благоприятное 2. Воспалительные:
а) мезангиопролиферативный – гистологически пролиферация мезангиальных клеток, расширение мезангия, отложение ИК в мезангии и под эндотелией; клинически – преимущественно протеинурия и/или гематурия, реже – нефротический синдром и АГ; течение относительно благоприятное.
Болезнь Берже (IgA-нефропатия) - мезангиопролиферативный ГН с отложением в клубочках IgA – самая распространенная причина ХПН (особенно у мужчин 10-30 лет); чаще заболевают дети; клинически - эпизодическая гематурия, совпадающая по времени ОРВИ, легкая протеинурия, гипертензия, очень редко - нефротический синдром; в сыворотке крови характерно повышение уровня IgA.
б) мезангиокапиллярный – гистологически выраженная пролиферация мезангиальных клеток с их проникновением в клубочек, удвоение базальной мембраны; может быть связан с ВГС, с криоглобулинемией; клинически – протеинурия, гематурия, часто – нефротический синдром и АГ; неблагоприятный вариант с прогрессирующим течением и развитием ХПН
в) фибропластический – гистологически склероз мезангия, сосудистых петель клубочков с образованием множественных сращений между петлями капилляров и листками капсулы клубочка; клинически – нефротический синдром и АГ; неблагоприятный прогноз (чаще встречается в исходе других ХГН – терминальный нефрит)
Клинические варианты ХГН:
70
а) латентная форма (с изолированным мочевым синдромом, до 50%) – клинически имеются лишь изменения ОАМ (протеинурия до 2-3 г/сут, незначительная эритроцитурия), редко – мягкая АГ; течение медленно прогрессирующее (ХПН через 30-40 лет)
б) нефротическая форма (20%) – проявляется нефротическим синдромом, часто сочетается с эритроцитурией и/или АГ в) гипертоническая форма (20%) – клинически выраженная АГ (АД 180/100-200/120 мм рт.ст. с колебаниями в течение суток;
гипертрофия левого желудочка, акцент II тона над аортой; изменения глазного дна и других органов-мишеней) при минимальном мочевом синдроме г) смешанная форма (нефротическая + гипертоническая, до 7%)
д) гематурическая форма (до 3%) – клинически постоянная микрогематурия, нередко с эпизодами макрогематурии, слабовыраженной протеинурией (не более 1 г/сут)
Диагностика ХГН основана на выявлении ведущего синдрома – изолированного мочевого, нефротического, синдрома АГ (особенно с повышением диастолического АД) клинически и с помощью лабораторных исследований мочи (как при ОГН).
Для морфологической верификации диагноза, подбора оптимальной терапии и прогноза – пункционная биопсия почек (противопоказана при единственно функционирующей почке; гипокоагуляции; правожелудочковой недостаточности; подозрении на тромбоз почечных вен; гидро- и пионефрозе; поликистозе почек; аневризме почечной артерии; нарушении сознания; подозрении на злокачественное новообразование)
Прогноз ХГН определяется его морфологической формой, в исходе болезни - ХПН из-за прогрессирования гломерулосклероза с развитием вторично-сморщенной почки.
Лечение ХГН:
1.Диета: нефротическая и смешанная форма – NaCl не более 1,5-2,5 г/сут, пищу не солить, животный белок 1-1,5 г/кг; при гипертонической форме – умеренно ограничить NaCl до 3-4 г/сут при нормальном содержании в диете белков и углеводов; при латентной форме - питание без существенного ограничения, полноценное, разнообразное, богатое витаминами, но без раздражающих продуктов. NB! Длительная безбелковая и бессолевая диета не предупреждает прогрессирования нефрита и плохо отражается на общем состоянии больных.
2.Для подавления активности процесса при серьезных формах заболевания - иммуносупрессивная терапия:
а) ГКС – преднизолон в высоких (1-2 мг/кг/сут) или умеренно высоких (0,6-0,8 мг/кг/сут) дозах перорально в 2-3 приема или однократно утром длительно (1-4 мес) с последующим медленным снижением дозы; возможен альтернирующий режим (через день однократно утром двойная суточная доза); при высокой активности почечного воспаления для быстрого достижения очень высоких концентраций ГКС в плазме показана пульс-терапия.
б) цитостатики – показаны при активных формах ХГН с высокой вероятностью прогрессирования, при противопоказаниях, отсутствии эффекта или появлении побочных эффектов от ГКС - алкилирующие агенты (циклофосфамид 1,5-2 мг/кг/сут, хлорбутин 0,1- 0,2 мг/кг/сут), антиметаболиты (азатиоприн); обладают рядом побочных эффектов, самые тяжелые - супрессия костного мозга, присоединение инфекции, недостаточность гонад.
в) циклоспорин А (начальная доза 3-4 мг/кг/сут) – показан при ХГН с минимальными изменениями клубочков, фокальном сегментарном гломерулосклерозе
Варианты пульс-терапии ГКС и цитостатиков при ХГН:
1)пульс-терапия метилпреднизолоном – до 20 мг/кг в/в капельно на 400 мл физраствора с 10.000 ЕД гепарина (т.к. ГКС вызывают гиперкоагуляцию) 2-3 дня, повторить 3-4 раза с интервалом 10 дней
2)пульс-терапия циклофосфамидом - 10-20 мг/кг 1 раз в 4 недели с повторением от 6 до 12-14 пульсов
3)пульс-терапия метилпреднизолоном и циклофосфамидом в тех же дозах с интервалом 10-14 дней с повторением 2-4 раза и с последующим введением только циклофосфамида от 6 до 12 пульсов.
3. Неиммунная нефропротективная терапия – доказана эффективность 4-х методов:
а) ИАПФ и/или блокаторы рецепторов к ангиотензину – снижают давление в приводящих и отводящих артериолах, что является профилактикой гломерулосклероза
б) гепарин (20000 ЕД п/к минимум 3 недели под контролем свертывающей системы) в) дипиридамол (150-200 мг/сут в течение 3-9 месяцев)
г) статины (15 мг/сут) для борьбы с гиперхолестеринемией и атеросклерозом Диспансеризация – пожизненно: при латентной и гематурической форме 2 раза/год, при гипертонической форме 1 раз в 1-3 мес.,
при нефротической и смешанной форме – ежемесячно или 1 раз в 2 мес (выполняется весь объем клинико-лабораторного исследования). При обострении ХГН – временная нетрудоспособность 25-45 дней в зависимости от тяжести течения.
48. Тубуло-интерстициальный нефрит: причины развития, клиника, диагностика, лечение. Медико-социальная экспертиза. Реабилитация.
Тубулоинтерстициальный нефрит (ТИН) – мультифакториальное не бактериальное заболевание почек с преимущественным поражением тубулоинтерстициальной ткани, отличное от гломеруло- (не поражаются почечные клубочки) и пиелонефрита (отсутствует инфекция).
Классификация ТИН: острый и хронический; иммунный и неиммунный.
Этиология ТИН:
а) прием ЛС (антибиотики, сульфаниламиды, НПВС, барбитураты, каптоприл, циметидин, диуретики, аллопуринол) б) интоксикация этанолом, этиленгликолем, ртутью, свинцом, кадмией и др.
в) лечение вакцинами и сыворотками, белковыми препаратами г) гиперурикемия (при подагре, псориазе, саркоидозе, лимфопролиферативных заболеваниях)
д) гипероксалатурия (при избытка оксалатов и аскорбиновой кислоты в пище, наследственном оксалозе) г) иногда причину установить не удается (идиопатический ТИН)
Патогенез ТИН.
Развивается реакция на ЛС и др. чужеродные вещества в виде отека, гранулематозной инфильтрации интерстиция почек, сдавления канальцев и сосудов, дистрофических изменений в канальцах вплоть до очаговых некрозов.
Клиническая картина ТИН складывается из проявлений нарушений канальцевых функций: Общие признаки ТИН:
-на фоне приема ЛС (95% всех ТИН) у больного внезапно могут появиться: отеки, гипертензия, умеренная селективная (экскреция белков с низкой молекулярной массой) протеинурия, микрогематурия, абактериальная лейкоцитурия
-характерна полиурия со сниженным удельным весом мочи
-характерны электролитные сдвиги – гипокалиемия и гипонатриемия
Для острого ТИН типично острое начало с лихорадкой, иногда болями в пояснице, кожными проявлениями (геморрагические и уртикарные сыпи), эозинофилией и анемией (особенно при ТИН лекарственного генеза), полиурией, микрогематурией.
Для хронического ТИН типично постепенное нарастание изменений водно-электролитного баланса, расстройств концентрационной функции почек, анемии.
Чаще всего из ТИН встречается анальгетическая нефропатия (как результат длительного потребления комбинации анальгетиков, обычно фенацетина и ацетилсалициловой кислоты) - болеют обычно женщины с головной болью, анемией и симптомами нарушения функций ЖКТ, функция почек стабилизируется с полным прекращением приема медикаментов.
Диагностика ТИН:
71
1. Выявление провоцирующего фактора.
2. Лабораторные данные:
а) ОАК: эозинофилия (типичный признак), анемия б) ОАМ: преобладают эритроциты (микрогематурия), возможна абактериальная лейкоцитурия, слабо выраженная селективная
протеинурия; полиурия со сниженным удельным весом мочи
в) белково-ферментные исследования мочи (соотношение уровней 1-макроглобулина и концентрации N-ацетил-b-D-глюкозамини-
дазы позволяет оценить наличие и степень повреждения ткани почки) г) БАК: гипокалиемия, гипонатриемия
3. Инструментальные данные: УЗИ почек (уменьшение длины обеих почек в сочетании с неровностью контуров, кальцификацией сосочков), биопсия почек (отек и инфильтрация интерстиция, изменения канальцев и интактные клубочки)
Лечение ТИН:
1.Отмена ЛС, вызвавшего заболевание – при этом функции почек обычно восстанавливаются, а большинство больных выздоравливает; при повторном применении данного ЛС не исключена хронизация
2.Максимальное исключение других ЛС
3.Антигистаминные препараты (димедрол, пипольфен, фенкарол и др.)
4.При наличии полиурии и интоксикации – в/в капельно 5% р-р глюкозы, р-р Рингера, реополиглюкин, гемодез, коррекция электролитного обмена
5.При остром ТИН - ГКС (преднизолон 20-30 мг/сут несколько недель с постепенным снижением дозы) с антикоагулянтами (гепарин) и антиагрегантами (курантил).
6.При развитии ХПН показана трансплантация почки
МСЭ: общие сроки ВН от 12-16 дней при легкой форме до 30-45 дней при тяжелой форме ТИН.
Реабилитация: направлена в первую очередь на устранение действия этиологического фактора + общеукрепляющие мероприятия, повышающие резистентность организма.
49. Хронический пиелонефрит: этиология, патогенез, клинические проявления, диагностика, принципы лечения. Ме- дико-социальная экспертиза. Реабилитация.
Хронический пиелонефрит – хроническое неспецифическое инфекционно-воспалительное заболевание почек, развивающееся первоначально в чашечно-лоханочной системе (ЧЛС) и распространяющееся в дальнейшем на тубулоинтерстиций (мозговой слой) и корковое вещество почек.
Этиология хронического пиелонефрита: грамотрицательные бактерии кишечной группы (Escherichia coli, Proteus mirabilis), Enterococcus spp., Staphylococcus spp., Streptococcus spp., Pseudomonas aeruginosae, смешанная флора.
Патогенез хронического пиелонефрита:
1. Пути инфицирования почек:
а) урогенный (восходящий) – основной путь, преобладает при хроническом пиелонефрите и у женщин б) гематогенный – на фоне сепсиса или эпизодов бактериемии, преобладает при остром пиелонефрите и у мужчин
Чаще всего болеют: дети до 7 лет (из-за анатомических особенностей развития мочеполовой системы; девушки и женщины 18-30 лет с началом половой жизни, беременностью или родами; женщины в период менопаузы (при снижении уровня эстрогенов изменяется вагинальная флора - уменьшение числа лактобактерий и их замена кишечной палочкой); мужчины в пожилом возрасте (ДГПЖ); мужчины и женщины с МКБ.
2. Способствующие факторы: МКБ; аномалии развития мочевыделительной системы, нефроптоз; ДГПЖ; воспалительные заболевания близлежащих органов (колит, аднексит, аппендицит, простатит); общие заболевания (СД, ожирение); беременность; функциональные нарушения мочевых путей (пузырно-мочеточниковый рефлюкс), особенно при переполненном мочевом пузыре.
3. Причины перехода острого пиелонефрита в хронический: а) имеющиеся причины нарушения оттока мочи
б) неправильное или недостаточное по длительности лечение острого пиелонефрита
в) образование L-форм бактерий, способных длительное время персистировать в организме г) хронические сопутствующие заболевания (СД, ожирение, болезни ЖКТ, тонзиллит и др.) д) иммунодефицитные состояния
Фазы течения хронического пиелонефрита:
1)обострение (активный воспалительный процесс)
2)латентная фаза
3)ремиссия (клиническое выздоровление)
Каждое очередное обострение пиелонефрита сопровождается вовлечением в воспалительный процесс все новых участков функционирующей почечной паренхимы, которые затем замещаются рубцовой соединительной тканью, что в конечном итоге приводит к вторично сморщенной почке, а при двустороннем процессе – к ХПН.
Клинические проявления хронического пиелонефрита:
Субъективно - общие жалобы: слабость, снижение работоспособности, аппетита, головные боли и специфические:
-боли в поясничной области, чаще односторонние, ноющего характера, реже – интенсивные; могут иррадиировать в нижние отделы живота, половые органы, бедро
-дизурические явления (болезненное учащенное мочеиспускание из-за сопутствующего цистита, умеренная полиурия из-за поражения канальцев)
-выделение мутной мочи, иногда с неприятным запахом, дающей при стоянии мутный осадок
-познабливание при выраженном обострении, иногда скоропреходящие подъемы температуры тела до 38,5-39° С с нормализацией к утру
-повышение АД, головные боли, головокружения (АГ из-за снижения продукции депрессорных простогландинов в мозговом слое почек)
Объективно:
-бледность кожи и видимых слизистых оболочек
-пастозность лица (но для хронического пиелонефрита не характерны выраженные отеки)
-болезненность при ощупывании или поколачивании поясничной области (нередко односторонняя)
-симптом Тофило - в положении на спине больной сгибает ногу в тазобедренном суставе и прижимает бедро к животу, при наличии пиелонефрита усиливается боль в поясничной области, особенно если при этом глубоко вдохнуть
-увеличение левой границы сердца, приглушенность тонов, негромкий систолический шум на верхушке (признаки АГ)
-при прогрессировании заболевания – клиника ХПН, для которой характерно большее снижение функции почек в период обострений (при повышении температуры, пиурии, увеличении процента активных лейкоцитов) и некоторое восстановление функции почек (иногда даже с повышением относительной плотности мочи и улучшением биохимических показателей) при стихании воспалительного процесса под влиянием лечения
Клинические формы хронического пиелонефрита:
а) латентная форма – скудная клиническая симптоматика, больных беспокоит немотивированная слабость, познабливания, иногда никтурия и неинтенсивные боли в поясничной области
72
б) рецидивирующая форма – чередование периодов обострений и ремиссий; в период обострения клиника и лабораторные данные отчетливы, в фазе ремиссии клинико-лабораторные проявления болезни постепенно затихают в) гипертензивная форма – в клинике преобладает синдром АГ
г) анемическая форма – в клинике преобладает анемический синдром (из-за нарушения продукции эритропоэтина)
д) септическая форма - развивается в периоде очень выраженного обострения, характерны высокая температура тела, потрясающие ознобы, тяжелая интоксикация, гиперлейкоцитоз, нередко бактериемия.
е) гематурическая форма - в клинической картине на первый план выступает макрогематурия Диагностика хронического пиелонефрита:
1. Инструментальные исследования а) обзорная рентгенография области почек: уменьшение размеров почек с одной или обеих сторон.
б) рентгеноурологическое исследование:
1)экскреторная урография - выявляется снижение тонуса верхних мочевых путей, уплощенность и закругленность углов форниксов, сужение и вытянутость чашечек, позднее - деформация и сближение чашечек, пиелоренальные рефлюксы, пиелоэктазии, асимметрия размеров почек; увеличение ренально-кортикального индекса (норма 0,37-0,4), признак Хадсона (уменьшение толщины паренхимы почек на полюсах по сравнению с ее толщиной в средней части)
2)ретроградная пиелография - определяется деформация чашечно-лоханочной системы, возможно выявление врожденных аномалий почек в) хромоцистоскопия: нарушение выделительной функции почек с обеих или с одной стороны.
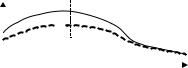
секреторный экскреторный
сегмент сегмент 



 пиелонефрит
пиелонефрит
норма
г) радиоизотопная ренография: асимметрия в поражении почек, нарушение экскреторного сегмента.
д) радиоизотопное сканирование почек: асимметрия размеров почек, диффузный характер изменений.
е) ультразвуковое исследование почек: асимметрия размеров почек, расширение и деформация чашечно-лоханочной системы, диффузная акустическая неоднородность почечной паренхимы, уплотнение сосочков почек, тени в лоханках (песок, мелкие камни, склероз сосочков), неровности контура почек, иногда уменьшение толщины паренхимы.
2. Лабораторные исследования:
а) OAK: признаки анемии, лейкоцитоз, сдвиг формулы крови влево и токсическая зернистость нейтрофилов (при выраженном обострении), увеличение СОЭ.
б) ОАМ: моча мутная, щелочная реакция, снижение плотности мочи; умеренная протеинурия, микрогематурия, выраженная лейкоцитурия, возможны цилиндрурия, бактериурия (больше 100 000 микробных тел в 1 мл мочи)
в) проба по Нечипоренко (определение содержания лейкоцитов и эритроцитов в 1 мл мочи) - преобладание лейкоцитурии над эритроцитурией (в норме количество лейкоцитов в 1 мл не превышает 4 тыс., эритроцитов – 2 тыс.)
г) проба по Зимницкому - снижение плотности мочи в течение суток (в норме плотность мочи в течение суток колеблется от 1010 до 1025 г/л)
д) БАК: увеличение содержания сиаловых кислот, фибрина, серомукоида, 2- и γ-глобулинов, креатинина и мочевины (при разви-
тии ХПН), появление СРП.
е) преднизолоновый тест - применяется для выявления скрытой пиурии и активного воспалительного процесса в почечной паренхиме (под влиянием ГКС из очага воспаления выходят и появляются в моче только «активные», «живые» лейкоциты); утром больной собирает среднюю порцию мочи (контроль), затем внутривенно вводят 30 мг преднизолона в 10 мл физ. р-ра и трижды с часовым интервалом собирают среднюю порцию мочи для анализа; в каждой порции определяют количество бактерий, форменных элементов и «активных» лейкоцитов в 1 мл мочи; тест положительный, если хотя бы в одной порции количество лейкоцитов увеличивается вдвое и при этом появляются активные лейкоциты.
ж) исследование мочи по Штернгеймеру-Мальбину - производится суправитальная окраска мочи генцианвиолетом и сафронином; при отсутствии инфекции в мочевых путях протоплазма лейкоцитов мочи окрашивается в темно-голубой цвет, ядра – в красный, при наличии хронического пиелонефрита выявляются «бледные» лейкоциты с бледно-голубой протоплазмой и бледно-голубым ядром, увеличенных размеров, многодольчатым ядром,
зернистостью в цитоплазме (клетки Штернгеймера-Мальбина – живые, активные лейкоциты из очага воспаления в почечной ткани) Принципы лечения хронического пиелонефрита.
Основные задачи при лечении пиелонефрита: 1) устранение причин, вызвавших нарушение пассажа мочи или почечного кровообращения; 2) назначение антибактериальных или химиопрепаратов с учетом данных антибиотикограммы; 3) повышение иммунной реактивности организма.
1.Обильное питье (количество мочи не менее 2 л/сут), жидкость ограничивать только при затруднениях к оттоку мочи; при обострении, АГ – ограничение соли до 4 г/сут
2.Санация очагов хронической инфекции (тонзиллит, кариес, холецистит, аднексит и т.п.)
3.Этиотропная терапия:
- АБ: бета-лактамные (пенициллин, амоксициллин/клавуланат, цефалоспорины II и III поколений), макролиды (азитромицин, кларитромицин, спирамицин), фторхинолоны (норфлоксацин, офлоксацин, ципрофлоксацин, ломефлоксацин, левофлоксацин)
-уросептики: сульфаниламиды: ко-тримоксазол (бактрим, бисептол), нитрофураны (фурагин, фурадонин) 4. Фитотерапия:
-диуретическим эффектом обладают: толокнянка, лист брусничника, полевой хвощ, земляничник, ягоды можжевельника, ромашка аптечная, трава и корень петрушки
-противовоспалительным эффектом обладают: зверобой, лист и почки березы, подорожник, календула, эвкалипт, ягоды клюквы, брусника, ромашка аптечная.
Этиотропная терапия - до исчезновения бактерий, затем в течение 3-6 месяцев прерывистая антибактериальная терапия (по 10 дней каждого месяца), в интервалах между циклами (оставшиеся 20 дней) – лекарственные травы.
5. Симптоматическое лечение (гипотензивные препараты и др.).
6. Физиотерапевтическое лечение: электрофорез фурадонина, эритромицина, кальция хлорида на область почек; УВЧ; тепловые процедуры.
7. Санаторно-курортное лечение в фазу ремиссии у питьевых источников (главный фактор – минеральные воды внутрь и в виде ванн)
8. Оперативное лечение показано при абсцессе почки и при выраженных устранимых нарушениях уродинамики.
Лечение тяжелого обострения хронического пиелонефрита: в/в или в/м цефалоспорины II и III поколений, аминогликозиды, фторхинолоны (пефлоксацин, офлоксацин, ципрофлоксацин), аминопенициллины с ингибиторами β-лактамаз; при септических состояниях, сопутствующих пиелонефриту, – карбапенемы (тиенам или меропенем по 500 мг 3 раза в сутки).
МСЭ: общие сроки ВН от 12-16 дней при легкой форме до 30-45 дней при тяжелой форме обострения ХПН.
Реабилитация: диета, санация очагов инфекции, плановая противорецидивная терапия, поливитаминотерапия, санаторно-курорт- ное лечение (основной лечебный фактор – минеральные воды внутрь и в виде ванн - курорты Железноводск, Трускавец, Славяновский и Смирновский минеральные источники)
73
50. Амилоидоз почек: этиология, патогенез, клинические проявления, диагностика, исходы, принципы лечения.
Амилоидоз – системное заболевание, в основе которого лежат обменные нарушения, приводящие к образованию и выпадению в тканях сложного белково-полисахаридного комплекса – амилоида (фибриллярного белка с β-складчатой структурой)
Классификация амилоидоза почек:
а) по этиологии:
1)первичный (идиопатический) – причины достоверно неизвестны
2)вторичный – при туберкулезе легких, хронических нагноительных заболеваниях легких (бронхоэктатическая болезнь, абсцесс легкого), остеомиелит, ревматоидный артрит, язвенный колит, опухоли, подострый инфекционный эндокардит, лимфогранулематоз и т.д.
3)наследственный (периодическая болезнь, португальский вариант амилоидоза и др.)
4)старческий – при этом отложения амилоида происходит чаще в головном мозге, аорте, миокарде, поджелудочной желе-
зе.
б) клинико-биохимическая:
1)AL-амилоидоз – первичный, связанный с миеломной болезнью
2)АА-амилоидоз – вторичный амилоидоз на фоне хронических воспалительных заболеваний, а также при периодической
болезни
3)ATTR – наследственно-семейный амилоидоз (семейная амилоидная полинейропатия) и старческий системный амилоидоз
4)Aβ2M – амилоидоз у больных на плановом гемодиализе
5)локализованный амилоидоз – чаще у людей старческого возраста, связан с СД 2 типа, болезнью Альцгеймера и др. Наиболее часто биохимически определяются 3 амилоида: AL – образуется плазмоцитами и содержит легкие цепи иммуноглобулина; AA – не иммуноглобулиновый белок, синтезирующийся печенью; Aβ – обнаруживается при мозговых нарушениях, связанных с болезнью Альцгеймера.
Теории патогенеза амилоидоза почек:
а) теория локального клеточного генеза – амилоид образуется в результате нарушения и извращения белково-синтетической функции ретикулоэндотелиальной системы б) теория диспротеиноза (органопротеиноза) – в результате диспротеинемии в плазме накапливаются грубодисперсные бел-
ковые фракции и аномальные белки (парапротеины), которые проникают в ткани и образуют амилоидную субстанцию в) мутационная теория – в результате мутации образуется особый клон клеток – амилоидобласты, которые и продуцируют амилоид
г) иммунная теория – в образовании амилоиди играет роль взаимодействие АГ с АТ при хронических воспалительных заболеваниях
Клинические проявления амилоидоза почек – 4 стадии:
а) латентная – протекает практически бессимптомно (может выявляться гепатоспленомегалия); в БАК – устойчивая диспротеинемия (повышение α2- и γ-глобулинов); в ОАК – существенное и стойкое повышение СОЭ без признаков обострения основного заболевания; в ОАМ – преходящая, нестойкая, незначительная протеинурия, иногда микрогематурия, лейкоцитурия; функция почек не страдает б) протеинурическая – в ОАМ характерна протеинурия с колебаниями от 0,1 до 3,0 г/сут, также могут быть микрогематурия,
цилиндрурия; ОАК – умеренная анемия, значительное повышение СОЭ; БАК - гипоальбуминемия, гиперглобулинемия; гипонатриемия и гипокалиемия; гиперфибриногенемия; повышение сиаловых кислот при нормальном или пониженном уровне холестерина. в) нефротическая – проявляется нефротическим синдромом г) азотемическая – проявляется клиникой ХПН.
Также характерны ряд внепочечных проявлений:
а) амилоидоз сердца – рестриктивная кардиомиопатия б) поражение ЖКТ: макроглоссия (язык увеличенный, плотный при пальпации), опухолеподобная инфильтрация стенки желудка,
синдром мальабсорбции при амилоидозе кишечника, гепатомегалия (печень увеличенная, плотная, с ровным, безболезненным краем) и др.
в) полисерозит (плеврит, перитонит)
г) периферическая полинейропатия, запястный туннельный синдром (сдавление срединного нерва – резкие жгучие боли в I-III пальцах кисти и лучевой стороне IV пальца, снижение чувствительности кончиков пальцев и силы мышц кисти)
д) симметричный полиартрит с утренней скованностью е) психические нарушения в виде деменции и др.
Диагностика:
1.Данные анамнеза: стойко и значительно повышенная СОЭ; гепатоспленомегалия; синдром мальабсорбции; протеинурия.
2.Биопсия – необходима для верификации диагноза.
3.Лабораторная диагностика – ее данные зависят от стадии процесса (см. клинические проявления)
4.Различные инструментальные исследования: Эхо-КГ, ЭКГ, УЗИ, рентгенография и др. в зависимости от пораженных органов
Принципы лечения амилоидоза:
-ограничение синтеза предшественника амилоида
-подавление синтеза амилоида и предотвращение отложения его в тканях
-лизис тканевых амилоидных структур
-лечение фонового заболевания
-симптоматическое лечение НС и/или ХПН
1.Щадящий режим, избегание физического и эмоционального переутомления
2.Диета: белок 60-70 г/сут, исключить казеин-содержащие продукты (молоко, сыр), говядину, телятину, рекомендуется баранина, крупы
3.Колхицин (1-2 мг/сут, в зависимости от переносимости) – ингибирует синтез предшественников амилоида;
4.Унитиол 5% р-р от 3-5 до 10 мл/сут в/м 30-40 дней 2-3 раза в год – тормозит агреггацию амилоидных фибрилл
5.Аминохинолиновые производные (хлорохин по 0,25-0,5 г/сут длительно) – уменьшают образование амилоида через влияние на отдельные звенья амилоидообразования
6.Диметилсульфоксид 1-5% по 30-100 мл/сут перорально
7.Сырая печень 80-120 г/сут в течение 6-12 мес – содержит комплекс антиоксидантов, улучшает общее состояние, уменьшает размеры печени, селезенки, снижает протеинурию.
Исход амилоидоза почек зависит от осложнений (интеркуррентные инфекции, кровоизлияния, тромбозы и т.д.); продолжительность жизни – 1-3 года; причины смерти – СН (после ее возникновения продолжительность жизни около 4 мес), ХПН (после ее возникновения продолжительность жизни – менее 1 года); при вторичном амилоидозе прогноз лучше, чем при первичном; у пожилых больных прогноз всегда тяжелее.
51.Клинико-лабораторные критерии нефротического синдрома.
74
Нефротический синдром (НС) – клинико-лабораторный симптомокомплекс, включающий: 1. массивную протеинурию (более 3,0-3,5 г/сут) 2. нарушения белково-липидного обмена (диспротеинемия, гипоальбуминемия, гиперлипидемия, липидурия) 3. массивные отеки (вплоть до анасарки)
Эпидемиология: частота НС у больных с заболеваниями почек 20% случаев.
Этиология нефротического синдрома:
а) первичный нефротический синдром – возникает из-за самостоятельных заболеваний почек, в первую очередь ГН (до 80% нефротического синдрома; у взрослых наиболее часто это мембранозный и мезангиопролиферативный ГН, у детей – первичный липоидный нефроз)
б) вторичный нефротический синдром – является следствием многих заболеваний, при которых почки вовлекаются вторично:
1)системные заболевания: амилоидоз, сахарный диабет
2)инфекционные заболевания (туберкулез, сифилис, малярия, гепатит В)
3)диффузные заболевания соединительной ткани (СКВ, системная склеродермия, ревматоидный артрит)
4)различные аллергические заболевания
5)отравления тяжелыми металлами (ртуть, золото, свинец)
6)медикаментозное поражение почек (препараты золота, D-пеницилламин, пенициллины)
Патогенез нефротического синдрома:
1. Образование иммунных комплексов (ИК) при взаимодействии АТ с АГ экзогенного (бактериальные, вирусные, пищевые, медикаментозные) и эндогенного (ДНК, криоглобулины, белки опухолей, вещество базальных мембран клубочковых капилляров) генеза и комплементом сыворотки осаждение ИК на базальных мембранах клубочковых капилляров повреждение базальных мембран, нарушение их структуры повышение проницаемости, активация гуморальных и клеточных звеньев воспалительной реакции высвобождение лизосомальных ферметов, гистамина, серотонина нарушение микроциркуляции в клубочковых капилляров, процессов фибринолиза с развитием внутрисосудистой коагуляции.
2. Основные механизмы протеинурии при НС:
а) потеря нормального отрицательного заряда капиллярной стенкой исчезновение отткалкивания отрицательно заря-
женных молекул белков стенкой капилляра б) повреждение барьера, препятствующего прохождению через капилляры клубочка крупных молекул появление круп-
ных брешей в базальной мембране клубочков, слушивание эпителиальных клеток и отложением на базальной мембране соединений, нарушающих целостность капиллярной стенки Степени протеинурии: в норме – до 150 мг/сут (прежде всего, за счет альбуминов); незначительная (следовая) – до 1 г/сут; уме-
ренная (средняя) – 1-3 г/сут; выраженная (значительная) – более 3 г/сут.
NB! При НС протеинурия массивная, постоянная, клубочковая, неселективная (альбумины + гамма-глобулины) Последствия протеинурии:
1)гипокальциемия и вторичный гиперпаратиреоидизм с остеопорозом из-за дефицита витамина Д (усиливается экскреция холе- кальциферол-связывающего белка)
2)повышенная чувствительность к инфекциям (следствие низких уровней IgG из-за их потерь с мочой и интенсивного катаболизма)
3)железодефицитная анемия из-за потери трансферрина
4)нарушение всасывания белка (синдром мальабсорбции)
5)непредсказуемое действие лекарств (из-за нарушения нормальной связывающей способности альбуминов плазмы)
3. Основные механизмы патогенеза отеков при НС:
а) нарушение экскреции почками натрия (теория «переполнения» - первичная причина отеков)
б) поражение базальной мембраны капилляров, эндотелия, подоцитов --> протеинурия --> гипоальбуминемия (+ повышен почечный метаболизм, снижен синтез альбуминов печенью) --> снижение онкотического давления плазмы --> снижение ОЦК (гиповолемия) --> повышение активности РААС и СНС --> задержка жидкости и повышение тонуса периферических сосудов (однако у 60% больных ОЦК повышен!)
в) активация кининовой системы усиление сосудистой проницаемости
г) повышение продукции антидиуретического гормона и снижение секреции натрийуретического гормона
4. Причины гиперкоагуляции при НС: потеря с мочой антитромбина III; гиперфибриногенемия из-за увеличения синтеза фибриногена печенью в ответ на гипопротеинемию; нарушение активности белков С и S из-за их потерь с мочой; нарушение фибринолиза; повышение агрегации тромбоцитов.
5. Причины гиперлипидемии при НС: снижение онкотического давления плазмы + потеря с мочой белков, регулирующих липидный гомеостаз повышение синтеза печенью ЛПНП и холестерина, реже ЛПОНП и ТГ (хилезная сыворотка крови)
Патоморфология НС: наиболее ранно изменения выявляются при ЭМ – исчезают педикулы (подошвенные отростки) подоцитов, затем присоединяются нарушения структуры базальной мембраны капилляров клубочков.
Клинические проявления НС:
-жалобы на общую слабость, быструю утомляемость, недомогание, головные боли, отсутствие аппетита, отеки, жажду, сухость во рту, малое количество выделяемой за сутки мочи, неприятные ощущения или тяжесть в поясничной области
-больные малоподвижны, адинамичны, кожа бледная, при выраженном НС сухая, волосы теряют блеск, выпадают
-отеки значительно выражены в области лица, стоп, голеней; появляются на стопах в конце дня или на лице по утрам, затем распространяются на все тело, локализуясь в зависимости от положения тела; отеки наиболее выражены в областях с самым высоким внутрисосудистым гидростатическим давлением (лодыжки и стопы) и самым низким тканевым гидростатическим давлением (ткани гениталий, периорбитальная зона); общий отек может сопровождаться полостными отеками (асцит, гидроперикард, гидроторакс)
Осложнения НС:
а) инфекционные (вирусные, бактериальные, грибковые) осложнения из-за выраженной иммунодепрессивной терапии б) нефротический криз (гиповолемический шок) – рвота, боли в животе различной локализации; болезненные мигрирующие роже-
подобные эритемы, чаще в области живота, нижних конечностей; резкое падение АД (из-за уменьшения ОЦК на фоне анасарки и тяжелой гипопротеинемии)
в) периферические артерио- и флеботромбозы (периферические тромбофлебиты, ТЭЛА, тромбозы артерий почки с инфарктом почки, инсульты, инфаркт миокарда)
г) ДВС-синдром (из-за дефицита факторов противосвертывающей системы) д) отек мозга – может развиться на высоте массивных отеков
е) ОПН – из-за тромбоза почечных вен, гиповолемического шока, сепсиса и т.д. Течение нефротического синдрома:
1.эпизодическое - ремиссии от нескольких месяцев до нескольких лет (20% больных с НС)
2.персистирующее – вялое, медленное, но упорно прогрессирующее течение (через 8-10 лет от начала заболевания - ХПН)
3.непрерывно-рецидивирующее (прогрессирующее) – в течение 1-3 лет развивается ХПН, несмотря на лечение, режим и т.д. Благоприятный исход может быть только у детей с болезнью минимальных изменений (первичным липоидным нефрозом).
Диагностика НС:
75
1.ОАМ: массивная протеинурия (более 3,0-3.5 г/сут), могут встречаться эритроцитурия, лейкоцитурия, цилиндрурия (гиалиновые, зернистые, восковидные), двоякопреломляющие липиды; олигурия с высокой плотностью мочи (до 1030-1040), с развитием ХПН снижается.
2.ОAK: гипохромная анемия, увеличение СОЭ до 50-60 мм/ч.
3.БАК: гипопротеинемия, гипоальбуминемия (альбумин иногда до 30-35 г/л), повышение 2- и b-глобулинов; гиперлипидемия
(уровень ХС иногда до 26 ммоль/л), сыворотка имеет хилезный вид (молочно-белого цвета); увеличение уровня креатинина, мочевины; гипокальциемия, гипокалиемия
4.Коагулограмма: признаки гиперкоагуляции
5.Проба Реберга-Тареева: СКФ снижена, канальцевая реабсорбция повышена.
Принципы лечения нефротического синдрома:
1.Госпитализация, постельный режим, диета с ограничение соли (при выраженных отеках вплоть до ее исключения), жидкости, липидов (гиполипидемическая диета приводит к уменьшению альбуминурии)
2.Иммунодепрессивная терапия (ГКС, цитостатики) + антикоагулянты прямого (гепарин) и непрямого (фенилин) действия по схемам лечения ОГН + НПВС, антиагреганты, плазмаферез, гемосорбция (при упорном тяжелом течении НС и отсутствии эффекта от других методов и средств патогенетической терапии)
3.Снижение протеинурии и коррекция нарушений белкового обмена: ингибиторы АПФ + гиполипидемические средства (ловастатин); в/в капельное введение 100-150 мл 20% р-ра альбумина 1 раз в 2-3 дня, курс лечения – 5-6 вливаний; анаболические стероиды (1 мл ретаболила в/м 1 раз/неделю, всего 4-5 инъекций)
4.Диуретическая терапия (противопоказана при гиповолемическом варианте НС): тиазидовые диуретики (гипотиазид 25-100 мг/сут внутрь), при неэффективности – петлевые диуретики (фуросемид от 20-40 до 400-600 мг/сут внутрь или от 20 до 1200 мг/сут в/в в зависимости от выраженности отечного синдрома) + калийсберегающие диуретики (верошпирон 50-200 мг/сут, триамтерен 50-300 мг/сут) или готовые комбинации (триампур – в 1 таб 25 мг триамтерена и 12,5 мг гипотиазида, фурезис – в 1 таб 50 мг триамтерена и 40 мг фуросемида); действие диуретиков можно потенцировать эуфиллином (10 мл 2,4% р-ра в 20 мл физ. р-ра в/в через 30 мин после приема фуросемида).
5.Симптоматическая терапия и коррекция осложнений.
52. Хроническая почечная недостаточность: этиология, патогенез, стадии течения, диагностика, тактика ведения больных, лечение. Медико-социальная экспертиза.
Хроническая почечная недостаточность (ХПН) – симптомокомплекс, развивающийся вследствие снижения и изменения функции нефронов, что приводит к нарушению экскреторной и инкреторной деятельности почек Большинство диффузных заболеваний почек неуклонно прогрессирует с постепенной заменой функционирующих нефронов скле-
ротической тканью и развитием ХПН, в терминальной стадии которой происходит резкое падение всех функций почек, требующее заместительной терапии (программного гемодиализа, перитонеального диализа или трансплантации почек).
Морфологический эквивалент ХПН – нефросклероз (гиперазотемия возникает при гибели 60-75% функционирующих нефронов). Этиология ХПН:
а) хронический гломерулонефрит б) хронический пиелонефрит
в) сахарный диабет (диабетический гломерулосклероз) г) амилоидоз д) тубулоинтерстициальный нефрит
е) врожденные аномалии почек (гипоплазия, поликистоз) ж) системные заболевания соединительной ткани з) артериальная гипертензия и др.
Патогенез ХПН:
Снижение массы функционирующих нефронов (нефросклероз) повышение содержания АТII, эндотелина компенсаторная внутриклубочковая гипертензия и гиперфильтрация в сохранившихся нефронах гидродинамическое повреждение стенки капилляров клубочков усиление протеинурии, прохождения макромолекул через мезангий активация макрофагов, экспрессия широкого спектра цитокинов, факторов роста активация почечных фибробластов фибропластическая трансформация дифференцированных клеток нефросклероз (патологический круг)
Стадии течения ХПН:
1)начальная (латентная) – нет клинических проявлений ХПН, СКФ 45-60 мл/мин
2)компенсированная – удовлетворительное состояние, легкая жажда, диспепсия, полиурия, СКФ 30-45 мл/мин
3)интермиттирующая – резкое ухудшение общего состояния, СКФ 20-30 мл/мин
4)терминальная – прогрессирующее развитие клиники уремии, СКФ 20 мл/мин и ниже.
Клинические проявления ХПН. Характерно медленно прогрессирующее течение с периодами ухудшения и ремиссии.
В начальном периоде клиника определяется основным заболеванием, жалобы на общую слабость, утомляемость, снижение работоспособности, сонливость, апатию, снижение аппетита, полиурию и никтурию, при прогрессировании появляется ряд синдромов: а) астенический синдром - слабость, быстрая утомляемость, вялость, апатия, значительное ограничение работоспособности б) дистрофический синдром – значительное похудание; мышечная слабость, мышцы атрофичны, их сила и тонус резко снижены; одутловатое лицо бледно-серого цвета; сухость и мучительный зуд кожи; кожа желтовато-бронзовая, со следами расчесов и кристаллами «мочевины» в виде своеобразного «инея»; в) желудочно-кишечный синдром – сухость и горечь во рту, металлический привкус, извращение вкуса, отвращение к пище,
тошнота, неукротимая рвота, икота; тяжесть и боли в подложечной области (уремический гастрит), диарея (уремический энтероколит), иногда – желудочно-кишечные кровотечения; в терминальной стадии – аммиачный запах изо рта, гиперсаливация, изъязвления слизистых рта г) сердечно-сосудистый синдром – головные боли, боли в области сердца, снижение или потеря зрения, гипертрофия и дилата-
ция левого желудочка (злокачественная АГ); постоянные боли в области сердца, одышка, сердцебиения, перебои, глухость тонов, расширение границ сердца (уремическая миокардиодистрофия); шум трения перикарда («похоронный звон» уремика) и др. проявления уремического фибринозного или экссудативного перикардита д) плевропульмональный синдром – сухой кашель, коробочный оттенок перкуторного звука, жесткое или ослабленное везику-
лярное дыхание, усиление легочного рисунка на рентгенограмме (уремический пневмонит); нефрогенный отек легких; уремический плеврит е) костно-суставной синдром – боли в костях, усиливающиеся при движении, мышечная слабость, переломы ребер, реже –
трубчатых костей, боли в позвоночнике (в связи с компрессией позвонков), интенсивный кожный зуд (за счет отложения в коже фосфорно-кальциевых солей), ограничение подвижности (почечная фиброзная остеодистрофия - вторичный гиперпаратиреоз изза гипокальциемии вследствии недостаточной продукции активных метаболитов витамина D в почках и почечная остеомаляция) ж) эндокринная дисфункция - гипогонадизм и импотенция у мужчин, нарушение менструального цикла у женщин з) анемический синдром (дефицит эритропоэтина)
76
и) синдром поражения ЦНС - больные угнетены, характерна частая смена настроения, могут быть подергивания, иногда болезненные судороги икроножных мышц; со временем усиливается слабость, сонливость, утомляемость, апатия (уремическая энцефалопатия); в терминальной стадии - тяжелые полинейропатии с болевым и дистрофическим синдромами, судорожные подергивания, энцефалопатия вплоть до развития уремической комы с большим шумным ацидотическим дыханием (дыхание Куссмауля); иногда развивается тяжелая миопатия.
Диагностика ХПН:
1. Лабораторные данные:
а) ОАМ: в начальных стадиях характерна полиурия, никтурия, в терминальной – олигурия (вплоть до анурии); ранний симптом ХПН – снижение относительной плотности мочи до 1004-1011 б) Проба Реберга-Тареева: прогрессивное снижение СКФ (в среднем колебания СКФ по клиренсу эндогенного креатинина в норме
80-120 мл/мин при расчете на стандартную площадь тела – 1,73 м2; клинически определяют концентрацию креатинина в сыворотке и в моче, собранной за сутки, вычисляют минутный диурез, разделив общее количество мочи за сутки в мл на 1440 минут, и считают СКФ по формуле: СКФ = [креатинин мочи (ммоль/л) * минутный диурез (мл/мин)] / креатинин крови (ммоль/л).
Во избежание погрешностей, возникающих при сборе мочи, можно пользоваться формулой Cockroft-Gault:
для мужчин: СКФ = [1,23 * (140-возраст) * вес (кг)] / креатинин крови (мкмоль/л), для женщин: СКФ = [1,05 * (140-возраст) * вес (кг)] / креатинин крови (мкмоль/л).
в) ОАК: постепенно нарастающая анемия; токсический лейкоцитоз со сдвигом влево; снижение числа тромбоцитов и их способности к агрегации; ускоренная СОЭ в различной степени.
г) БАК: повышение мочевины, креатинина, средних молекул; при полиурии – гипокалиемия, при олигоанурии – гиперкалиемия; в терминальной стадии – гипермагниемия, гиперфосфоремия, гипокальциемия, метаболический ацидоз 2. Инструментальные данные:
а) ЭКГ: малый зубец Т и косовосходящая депрессия сегмента ST (при уровне калия ниже 3,5 ммоль/л); высокий некоронарный зубец Т (при уровне калия выше 7,0 ммоль/л)
б) УЗИ, обзорная рентгенография почек, радиоизотопная ренография (РРГ), биопсия почки – для установления причины ХПН (информативны только на первых двух стадиях процесса)
Лечение и тактика ведения больных с ХПН:
Лечение одновременно является патогенетическим и симптоматическим и включает мероприятия, направленные на: нормализацию АД, коррекцию анемии, липидного и углеводного обмена, КЩС, водно-электролитных расстройств, предупреждение накопления в организме токсичных продуктов обмена (дезинтоксикационная терапия).
1.Режим: избегать переохлаждения, физических и эмоциональных перегрузок; в начальных стадиях – лечение основного заболевания
2.Диета: ограничение белка – от 0,5 до 1,0 г/кг массы тела; количество потребляемой жидкости = диурез за предыдущие сутки + дополнительно 300 мл (при отсутствии выраженных отеков); ограничение поваренной соли; коррекция ионов калия
3.Коррекция ацидоза, электролитных нарушений: 4,2% р-р NaHCO3, трисамин в/в
4.Противоазотемическая терапия: сорбенты; кишечный диализ, форсированная диарея; желудочный лаваж;
леспенефрил, кофитол; дезинтоксикационная терапия (гемодез в/в)
5.Лечение АГ: ИАПФ (только на начальной стадии при СКФ > 30-40 мл/мин и при отсутствии гиперкалиемии), петлевые диуретики (фуросемид), допегит/клофелин, бета-адреноблокаторы.
6.Лечение анемии: препараты железа, андрогены (тестостерона пропионат 5% – 1,0 в/м); рекомбинантный эритропоэтин 25-50 ЕД/кг 3 раза в неделю п/к или в/в; переливание эритроцитарной массы
7.Лечение уремической остеодистрофии: ограничение продуктов, богатых фосфором (зерновые, бобовые, отруби, рыба, творог); фосфорсвязывающие агенты (карбонат кальция, ацетат кальция, альмагель и др.); соли кальция перорально по 1,0-1,5 г/сут; препараты витамина D3
8.Гемодиализ – показан в следующих случаях: 1) СКФ < 10 мл/мин; 2) мочевина плазмы > 30 ммоль/л; 3) креатинин плазмы >
750ммоль/л; 4) стойкая олигурия < 500 мл/сут; 5) калий > 6 ммоль/л; 6) начинающийся отек легких на фоне гипергидратации; перитонеальный диализ
9.Трансплантация почки – показана только в терминальной фазе ХПН (возможна в I и II периодах терминальной фазы).
МСЭ: определяется стадией ХПН, на начальных стадиях больные трудоспособны.
БОЛЕЗНИ СИСТЕМЫ КРОВЕТВОРЕНИЯ
53. Железодефицитные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение.
Железодефицитная анемия (ЖДА) – гипохромная микроцитарная анемия, развивающаяся вследствие абсолютного уменьшения запасов железа в организме.
Эпидемиология: ЖДА страдают около 200 млн. людей во всем мире; самая частая форма анемий (80%). Этиология ЖДА:
1.Хронические периодические кровопотери (желудочно-кишечные кровотечения, маточные кровотечения, гематурия, кровоточащие опухоли, донорство и др.)
2.Повышенный расход железа (беременность, лактация, половое созревание, хронические инфекции)
3.Недостаточное поступление железа с пищей
4.Нарушение всасывания железа (синдром мальабсорбции, резекция желудка, высокая энтеропатия и др.)
5.Нарушение транспорта железа (наследственный недостаток трансферина, АТ к трансферрину)
6.Врожденный дефицит железа (нарушение реутилизации железа и т.д.)
Патогенез ЖДА: В основе заболевания – дефицит железа, в котором выделяют 2 стадии:
а) латентный дефицит – уменьшаются запасы железа в печени, селезенке, костном мозге, при этом снижается уровень ферритина в крови, происходит компенсаторное усиление всасывания железа в кишечника и повышение уровня мукозного и плазменного трансферина; содержание сывороточного железа еще не снижено, анемии нет б) собственно ЖДА – истощенные депо железа не способны обеспечить эритропоэтическую функцию костного мозга и, несмотря
на сохраняющийся высокий уровень трансферина в крови, значительное содержается содержание сывороточного железа, синтез гемоглобина, развивается анемия и последующие тканевые нарушения.
При дефиците железа, помимо анемии, снижается активность железосодержащих и железозависимых ферментов в различных органах и тканях, уменьшается образование миоглобина дистрофические поражения эпителиальных тканей (кожи, слизистых ЖКТ, мочевыводящих путей и др.) и мышц (скелетный, миокарда).
Распределение железа в организме: 57-65% – гемоглобин; 27-30% – железо негемовых белков (ферритин, гемосидерин); 8-9% – миоглобин; до 0,5% – железо ферментов (цитохромов и пероксидаз); 0,1% – транспортное железо (с трансферрином).
Классификация ЖДА:
1) по этиологии:
а) хроническая постгеморрагическая ЖДА б) ЖДА вследствие повышенного расхода железа
в) ЖДА вследстие недостаточного исходного уровня железа (у новорожденных и детей младшего возраста)
77
г) алиментарная ЖДА д) ЖДА вследствие недостаточного всасывания в кишечнике
е) ЖДА вследствие нарушения транспорта железа
2)по стадии развития: латентная анемия и ЖДА с развернутой клинико-лабораторной картиной заболевания
3)по степени тяжести: легкая (Hb 90-120 г/л), средняя (Hb 70-90 г/л), тяжелая (Hb ниже 70 г/л).
Клиника ЖДА:
а) общеанемический синдром:
-общая слабость, повышенная утомляемость, снижение работоспособности, памяти, сонливость, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиение, одышка при физических нагрузках, склонность к ортостатическим обморокам
-бледность кожи и видимых слизистых оболочек (иногда с зеленоватым оттенком – «хлороз»)
-небольшая пастозность в области голеней, стоп, лица, утренние отеки – «мешки» над и под глазами
-синдром миокардиодистрофии (одышка, тахикардия, часто аритмия, умеренное расширение границ сердца влево, глухость тонов, систолический шум на верхушке)
б) сидеропеничекий синдром (синдром гипосидероза):
-извращение вкуса - непреодолимое желание употреблять в пищу что-либо необычное и малосъедобное (мел, зубной порошок, уголь, глину, сырое тесто, фарш, крупу); чаще встречается у детей и подростков
-пристрастие к острой, соленой, кислой, пряной пище
-извращение обоняния - пристрастие к запахам, которые большинством окружающих воспринимаются как неприятные (бензин, керосин, ацетон, запах лаков, красок, гуталина, нафталина и др.)
-выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы; императивные позывы на мочеиспускание, невозможность удержать мочу при смехе, кашле, чихании, возможно даже ночное недержание мочи (слабость сфиктера мочевого пузыря)
-дистрофические изменения кожи и ее придатков (сухость, шелушение, склонность к быстрому образованию на коже трещин; тусклость, ломкость, выпадение, раннее поседение волос; истончение, ломкость, поперечная исчерченность, тусклость ногтей; симптом койлонихии - ложкообразная вогнутость ногтей)
-дистрофические изменения слизистых: ангулярный стоматит - трещины, «заеды» в углах рта; глоссит - ощущение боли и распирания в области языка, покраснение его кончика, в дальнейшем атрофия сосочков («лакированный» язык); склонность к пародонтозу и кариесу; атрофические изменения ЖКТ (сухость слизистой пищевода и затруднения, а иногда боли при глотании пищи, особенно сухой - сидеропеническая дисфагия или симптом Пламмера-Винсона; атрофический гастрит и энтерит)
-снижение репаративных процессов в коже и слизистых
-симптом «синих склер» Ослера - синеватая окраска или выраженная голубизна склер (из-за нарушения гидроксилирования пролина и лизина при дефиците железа склера истончается и через нее просвечивается сосудистая оболочка глаза)
-«сидеропенический субфебрилитет» - длительное повышение температуры до субфебрильных величин
-выраженная предрасположенность к ОРВИ, хронизации инфекций (из-за нарушения фагоцитоза)
Диагностика ЖДА:
а) ОАК: снижение содержания гемоглобина и (в меньшей степени) эритроцитов; микроцитоз; ЦП < 0,8 (= 3*Hb / 3 первые цифры числа эритроцитов); нормальные лейкоциты и тромбоциты
б) БАК: тесты феррокинетики:
1)сывороточное железо (СЖ): женщины - норма 11,5-30,4 мкмоль/л, при дефиците железа < 11,5 мкмоль/л; мужчины - норма 13,0-31,4 мкмоль/л, при дефиците железа < 11,5 мкмоль/л
2)общая железосвязывающая способность сыворотки (ОЖСС): женщины – норма 44,8-70,0 мкмоль/л, при дефиците железа > 70,0 мкмоль/л; мужчины – норма 44,8-70,0 мкмоль/л, при дефиците железа > 70,0 мкмоль/л
3)процент насыщения трансферрина железом (%НТЖ): женщины – норма 25-40%, при дефиците железа < 25%, мужчины
–норма 25-50%, при дефиците железа < 25%
4)сывороточный ферритин: женщины – норма 10-100 нг/мл, при дефиците железа < 10 нг/л; мужчины – норма 30-200 нг/мл, при дефиците железа < 30 нг/мл
Принципы рациональной терапии ЖДА:
1.Основа лечения – препараты солевого железа per os; ЖДА невозможно купировать только диетой, богатой железом, т.к. из пищи в тонкой кишке всасывается 2-2,5 мг железа в сутки, а из препаратов – в 10-15 раз больше.
NB! Перед применением препаратов железа следует исключить сидероахрестическую (железонасыщенную) анемию, при которой дефицита железа нет, но оно не используется; образуются гипохромные эритроциты, а железо захватывается клетками макрофагальной системы и откладывается в органах и тканях, вызывая их гемосидероз. Назначение препаратов железа при данной анемии только ухудшит состояние больного!
2.Этапность лечения – 2 этапа (3-5 мес.):
1)купирование анемии (от начала терапии до нормального уровня Hb – обычно 4-6 недель)
2)«терапия насыщения» - восполнение депо железа в организме (8-12 недель - по 30-60 мг ЭЖ/сут).
3.Правильный расчет лечебной и профилактической дозы по элементарному железу (ЭЖ): лечебная доза рассчитывается по содержанию элементарного железа в препарате и для взрослого весом 70-80 кг составляет 100-200 мг ЭЖ Основные препараты железа для перорального приема: «Ферроплекс»: 1 таблетка = 10 мг ЭЖ, «Ферроцерон»: 1 таблетка = 40 мг
ЭЖ, «Феррокальм»: 1 таблетка = 44 мг ЭЖ; пролонгированные формы (1-2 раза/сут): Ферро-градумет»: 1 таблетка = 105 мг ЭЖ; «Мультирет»: 1 таблетка = 105 мг ЭЖ; «Тардиферон»: 1 таблетка = 80 мг ЭЖ; «Сорбифер»: 1 таблетка = 100 мг ЭЖ.
4.Лечение сочетают с одновременным применением аскорбиновой кислоты (0,3-0,5 г на прием), которая в 2-3 раза повышает всасывание железа в кишечнике; целесообразны также антиоксиданты и витамин В6.
5.Оптимально принимать препарат железа за 30 мин до еды, при плохой переносимости – через 1 час после еды, не разжевывая, запивая водой, можно фруктовыми соками без мякоти, но не молоком (кальций молока тормозит всасывание железа); для детей можно использовать сиропы - «Ферринсол», «Гемофер», «Интрофер».
6.Парентерально препараты железа используются по показаниям: синдром мальабсорбции; резекция желудка; резекция верхнего отдела тонкой кишки («Феррум-лек», «Эктофер», «Фербитол»).
7.При уровне гемоглобина < 70 г/л показано переливание эритроцитарной массы.
8.Критерии излеченности:
а) повышение уровня ретикулоцитов на 5-7 день от начала ферротерапии б) повышение уровня гемоглобина с 3 (и раньше) недели лечения и восстановление его к 6-ой
в) нормализация показателей СФ, СЖ, ОЖСС, %НТЖ по окончании курса лечения 9. Профилактический курс ферротерапии – приём препарата по 30-40 мг ЭЖ/сутки в течение 4-6 недель (тардиферон по 1 таблетке в 2 дня и др.)
54. Мегалобластные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение.
Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ).
78
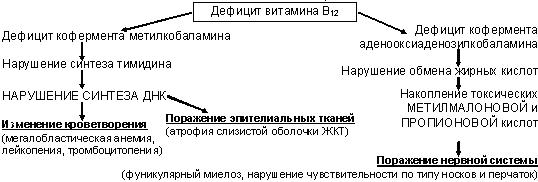
Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге.
Классификация мегалобластных анемий:
а) В12-дефицитная анемия б) Фолиеводефитиная анемия
в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.)
г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание) д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты)
е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.)
Этиология мегалобластных анемий:
1. Причины дефицита витамина В12:
а) недостаточное поступление его с пищей б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов
ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин)
2. Причины дефицита фолиевой кислоты:
а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей)
б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ)
в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин) г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы - метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др.
Патогенез мегалобластных анемий:
Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция - перенос метильной или формильной группы от одного вещества к другому.
Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника моноглютамат всасывание в проксимальном отделе тонкой кишки попадание с помощью переносчика в клетку потеря метильной группы (при участии витамина В12) повторное образование полиглютамата использование на нужды клетки.
При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований.
Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм);
Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок комплекс В12+R-белок поступает в ДПК соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки связь кобаламина с транскобаламином II (переносчиком) перенос кровью к костному мозгу и печени.
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Клиническая картина В12-дефи- цитной анемии:
а) поражение пищеварительной системы – чаще всего самые ранние признаки заболевания:
- снижение или отсутствие аппетита, ощущение тяжести и полноты в подложечной области после еды, отрыжка съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в об-
ласти прямой кишки (из-за глоссита, атрофического гастрита и атрофии слизистой кишечника)
-воспалительно-атрофические изменения слизистой полости рта и языка (слизистая рта бледная, с признаками афтозного стоматита; гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета, иногда с изъязвлениями - глоссит Hunter)
-пальпаторно - неинтенсивная боль в эпигастральной области, иногда – гепатоспленомегалия
б) поражение кроветворной системы – чаще всего ведущие признаки заболевания:
-общеанемический синдром (как при ЖДА)
-кожа бледная, часто с лимонно-желтым оттенком (в связи с гипербилирубинемией из-за гемолиза), легкая иктеричность склер
-несколько одутловатое лицо, часто – пастозность в области голеней и стоп
-синдром миокардиодистрофии (тахикардия, экстрасистолия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум в области верхушки)
в) поражение нервной системы – фуникулярный миелоз – возникает при тяжелом и длительном течении болезни, характеризуется поражением задних и боковых столбов спинного мозга с демиелинизацией и дегенерацией нервных волокон в спинном мозге и спинномозговых нервах:
1)при преимущественном поражении задних столбов:
-жалобы на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног; больным кажется, что они не чувствуют при ходьбе опоры под ногами, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата (больные неоднократно как бы «пробуют землю ногой»)
-снижение сухожильных рефлексов, атрофия мышц нижних конечностей
-нарушение функции тазовых органов (недержание мочи, недержание кала)
79
2)при преимущественном поражении боковых столбов:
-нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей
-нарушение функции тазовых органов (задержка мочеиспускания и дефекации)
Клиническая картина фолиеводефицитной анемии отличается от В12-дефицитной анемии отсутствием поражения пищеварительной и нервной системы.
Диагностика В12-дефицитной анемии:
1. Лабораторные исследования:
а) ОАК: гиперхромная (ЦП > 1,1) макроцитарная анемия, анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются эритроциты нормальных размеров), пойкилоцитоз (изменение формы эритроцитов); тельца Жолли, кольца Кебота, базофильная пунктация (остатки ядра в мегалоцитах); лейкопения, нейтропения, эозинопения, от-
носительный лимфоцитоз, гиперсегментированные нейтрофилы (большие сегментоядерные нейтрофилы с полисегментированным ядром); умеренная тромбоцитопения б) миелограмма (пункцию необходимо делать до начала лечения!): раздражение красного кроветворного ростка, его гиперплазия;
клетки красного ряда преобладают над клетками белого ряда, отношение лейкоциты/эритроциты 1:2 - 1:3 (при норме 3:1-4:1); мегалобластный тип кроветворения (гиганская клетка с эксцентрично расположенным ядром без ядрышек, нежной хроматиновой сетью) с преобладанием в разгар болезни базофильных мегалобластов («синий костный мозг»); изменение клеток миелоидного ряда; нарушение созревания мегакариоцитов в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) тест Шеллинга - позволяет оценить всасывание витамина В12 в кишечнике в присутствии гастромукопротеина или без него и сделать заключение о патогенетическом варианте В12-дефицитной анемии:
1)Шеллинг – I: больному дают принять внутрь витамин В12, меченный 60Со и через 1-6 часов в/м вводят «ударную дозу» немеченого витамина В12 для насыщения печеночного депо, затем измеряют содержание радиоактивного витамина В12 в суточной моче; снижение его экскреции указывает на нарушение всасывания витамина В12 в кишечнике
2)Шеллинг – II: повторяется тест Шеллинг-I с использованием гастромукопротеина, меченого радиоактивным кобальтом;
повышение экскреции радиоактивного витамина В12 указывает на дефицит гастромукопротеина в качестве основного механизма развития В12-дефицитной анемии; если экскреция радиоактивного витамина В12 не увеличилась, причина развития МА - нарушение всасывания витамина
В12 в кишечнике.
2. Инструментальные исследования: ФГДС с биопсией (атрофические изменения слизистой ЖКТ); исследование желудочной секреции (резкое уменьшение количества желудочного сока, ахилия) и др.
Диагностика фолиеводефицитной МА: а) ОАК – те же признаки, что и при В12-дефицитной анемии
б) миелограмма – те же признаки, что и при В12-дефицитной анемии; при окраске пунктата по Кассу (ализариновым красным) мегалобласты окрашиваются только при В12-дефицитной анемии и не окрашиваются при фолиеводефитиной анемии в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) проба с гистидином - больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина; в норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты; при фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается ( до 1500 мг)
Лечение МА:
При В12-дефицитной анемии - препараты витамина В12 (цианокобаламин, оксикобаламин) 400-500 мкг/сут в/м (30-40 инъекций), затем – поддерживающая доза 500 мкг 1 раз в неделю 3 месяца, затем 500 мкг 1 раз в 2 недели еще 3 мес.
При фуникулярной миелозе 1000 мкг/сут + кобамид (кофермент витамина) 500 мкг/сут в/м до исчезновения признаков поражения спинного мозга.
При фолиеводефицитной анемии: фолиевая кислота внутрь по 10-15 мг/сут до 6 недель.
55. Гемолитические анемии: классификация, основные диагностические критерии, принципы терапии.
Гемолитические анемии (ГА) – группа анемий, обусловленных снижением средней продолжительности жизни эритроцитов в результате их усиленного гемолиза (внутриклеточного, тканевого – чаще всего в селезенке или внеклеточного, внутрисосудистого). В норме продолжительность жизни эритроцитов 100-120 дней, при гемолитической анемии она укорачивается до 12-14 суток. Признаки ГА: 1) выраженный ретикулоцитоз в периферической крови (признак хорошей регенераторной способности костного мозга); 2) реактивная гиперплазия красного ростка костного мозга; 3) неконьюгированная гипербилирубинемия; 4) гипергемоглобинемия (при внесосудистом гемолизе).
Классификация ГА:
1. По этиологии:
а) наследственные ГА:
1)мембранопатии - наследственный микросфероцитоз (болезнь Минковского-Шоффара) – снижение количества спектрина клеточной мембраны эритроцитов повышает ее проницаемость для воды и ионов натрия; клетки набухают, из дискоцитов превращаются в микросфероциты, которые гибнут в селезенке, а их гемоглобин поглощается макрофагами (внутриклеточный гемолиз); клинически: анемия, желтушность, спленомегалия, гиперхромный кал, могут быть пигментные камни в желчном пузыре, нарушение костеобразования (из-за очагов кроветворения); ОАК: нормохромная анемия, микросфероциты, ретикулоциты; сниженная осмотическая резистентность эритроцитов в гипотонических растворах (в норме 0,36-0,42); миелограмма: соотношение лейкоциты/эритроциты 1:1-1:2 при норме 3:1-4:1; лечение: спленэктомия
2)ферментопатии - дефицит активности глюкозо-6-фосфатдегидрогеназы эритроцитов; клинически анемия, желтушность и другие признаки гемолиза при воздействии агентов, провоцирующих гемолиз (СА, конские бобы, черника, голубика); ОАК – тельца Гейнца (деградация Hb).
3)гемоглобинопатии – нарушения структуры гемоглобина:
а. количественная – талассемия - из-за наличия мутантного гена происходит торможение синтеза цепей глобина; клинически нарушения скелета (квадратный череп), болезнь Кули (желтуха, гепатоспленомегалия, гипохромная микроцитарная анемия, снижение осмотической резистентности эритроцитов – при гомозиготный вариант) или умеренная гипохромная анемия (при гетерозиготном варианте); в ОАК – много овальных и грушевидных эритроцитов
б. качественная – гемоглобинопатия S (серповидно-клеточная анемия) - в HbS в положении 6 четвертого пептида β-цепи гидрофильная глютаминовая кислота заменена на валин, поэтому гемоглобин начинает кристаллизоваться; клинически – анемия, высокий башенный череп, желтушность; часты осложнения – инфаркты органов, гемолитические кризи, тромботические осложнения в любом возрасте; ОАК – деформированные (вытянутые, серповидные) эритроциты
б) приобретенные ГА:
1)при гиперспленизме
2)иммунные ГА: аутоиммунные, лекарственные и др.
3)обусловленные механическим повреждением эритроцитов: маршевая гемоглобинурия, ГА при протезировании клапанов сердца и сосудов
80
4)токсические: при укусе змей и пауков, интоксикации рядом металлов (медь), органическими растворителями
5)пароксизмальная ночная гемоглобинурия
2. По серологическому принципу – различные типы аутоиммунных гемолитических анемий (АИГА) – возникают при срыве иммунологической толерантности к неизмененным АГ собственных эритроцитов или к АГ, имеющим сходные с эритроцитами детерминанты
1) АИГА с неполными тепловыми агглютининами – наиболее частый вариант; фиксация IgG и IgA на поверхности эритроцитов с последующей гибелью эритроцитов в селезенке (ее макрофаги имеют рецепторы к Fc-фрагменту иммуноглобулина и осуществляют иммунный фагоцитоз)
Клиника: острое, внезапное начало с появлением слабости, одышки, артралгии, болей в пояснице, повышения температуры тела (из-за распада эритроцитов); больные бледные, характерна спленомегалия, пальпаторно селезенка безболезненна; при частых гемолитических кризах – вторичный токсический гемолитический гепатит; кал темного цвета (повышен стеркобилин), моча светложелтая (уробилин отсутствует)
Диагностика: нормохромная анемия со значительным снижением гемоглобина (при гемолитическом кризе – до 30-40 г/л), постепенным нарастанием ретикулоцитоза; лейкоцитоз до 10-15*109/л, сдвиг влево до миелоцитов (лейкемоидная реакция миелоидного типа на гемолиз); СОЭ – до 30 мм/ч; тромбоциты в норме или снижены; миелограмма – нормобластический тип кроветворения, иногда с чертами мегалобластического; положительная реакция Кумбса - прямая (выявление фиксированных на эритроцитах антител; при малом количестве Ig может дать отрицательный результат) и непрямая (выявление АТ к эритроцитам в сыворотке крови)
Лечение: преднизолон 1 мг/кг/сут уровень гемоглобина через 3 дня не стабилизировался преднизолон 2 мг/кг/сут с последующим постепенным снижением дозы (при рецидиве – возрат к лечебной дозе) гемолиз не купировался за 6 мес спленэктомия недостаточный эффект азатиоприн 50-100 мг/сут до 6 мес., плазмаферез (но не гемосорбция – усиливает гемолиз); по показани-
ям - гемотрансфузии (используют только отмытые эритроциты).
2) АИГА с тепловыми гемолизинами – внутрисосудистое разрушение эритроцитов под действием АТ-гемолизинов в присутствии комплемента.
Клиника: чаще подострое начало; бледность, желтушность кожных покровов, анемический синдром, нормальные резмеры селезенки; на высоте гемолиза может начаться ДВС-синдром, микротромбоз мезентериальных сосудов, развиться полиорганная недостаточность.
Диагностика: гипергемоглобинемия и гемоглобинурия (моча черного цвета); БАК: повышение ЛДГ (из-за разрушения клеток); отрицательная реакция Кумбса; положительная качественная реакция на аутогемолиз (в чистую пробирку наливают 2-3 мл крови без стабилизатора, ставят ее в термостат на 24 часа при температуре 37 °С, при этом происходит гемолиз, т.к. аутоантитела в сыворотке при t = 37°С фиксируются на поверхности эритроцитов, затем присоединяется комплемент и мембрана эритроцитов раз-
рушается)
Лечение: преднизолон 1-2 мг/кг нет эффекта цитостатики; при гиперкоагуляции: гепарин, реополиглюкин, при кровоточиво-
сти – альбумин, сыворотка, плазмаферез (но не СЗП – приводит к гемолизу из-за содержания в ней комплемента); при гемоглобине ниже 70 г/л – переливание отмытой эритроцитарной массы.
3) АИГА с полными холодовыми агглютининами – фиксация холодовых аутоантител на АГ собственных эритроцитах с их последующей внутрикапиллярной агглютинацией при температуре 4-15 °С и возникновением синдрома повышенной вязкости
(гипервискозности).
Клиника: в холодную погоду наблюдается посинение и отек кожи лица, синюшная кожа рук, ног, ушей, синдром Рейно (вплоть до гангрены), летом симптомы проходят; желтуха отсутствует (гипербилирубинемия не характерна, т.к. происходит не гемолиз, а агглютинация); селезенка не увеличена.
Диагностика: умеренное снижение гемоглобина, невысокий ретикулоцитоз, лейкоцитоз до 10-12*109/л, СОЭ увеличена до 70 мм/час и более; осмотическая резистентность эритроцитов не изменена; реакция Кумбса отрицательная.
Лечение: коррекция синдрома гипервискозности: плазмаферез 4-5 процедур (возвращаемые эритроциты подогревают до 37°С) + реополиглюкин как дезагрегант (подогретый 37 °С); при гемотрансфузии – переливание отмытой, подогретой эритроцитарной мас-
сы
4) АИГА с двухфазными гемолизинами Доната-Ландштейнера – фиксация IgG на эритроцитах с участием комплемента при низких температурах с последующим их внутрисосудистым гемолизом после согревания Клиника: вскоре после переохлаждения появляется головная боль, боли в ногах и поясничной области, чувство «ломоты в теле»,
озноб, повышается температура тела, рвота, черная моча (гемолитический криз);после криза характерны желтушность кожи, увеличение печени и селезенки, иногда – синдром Рейно и холодовая крапивница.
Диагностика: во время криза – нормохромная анемия с ретикулоцитозом, СОЭ умеренно увеличена, лейкоцитоз; гемоглобинурия; серологический анализ крови: если пробирку с кровью поставить на час в холодильник, а затем согреть в термостате до температуры 37 °С, - происходит гемолиз.
Лечение: ГКС в дозах 1-2 мг/кг, при неэффективности – цитостатики
56. Апластические анемии: этиология, патогенез, клиника, классификация, диагностика, принципы лечения.
Апластические анемии (АА) – группа патологических состояний, характеризующихся панцитопенией, уменьшением клеточности (абсолютного содержания клеток) костного мозга при содержании бластов менее 5%.
Классификация апластических анемий по этиологии: а) врожденная (анемия Фанкони, анемия Джозефа-Дайемонда-Блекфена и др.)
б) приобретенная вследствие:
1)воздействия химических веществ (бензол, пестициды, соединения свинца)
2)воздействия лекарственных средств (хлорамфеникол, фенитоин, фенилбутазон, соединения золота и др.)
3)аутоагрессии и появления аутоантител к кроветворным клеткам
4)воздействия радиоактивного излучения
5)инфекционных заболеваний (ВГВ, ВГС, инфекционный мононуклеоз, цитомегаловирусная инфекция)
6)других заболеваний (тимомы, лимфомы и др.)
в) идиопатическая (с неустановленной причиной)
Патогенез апластических анемий: генетические нарушения, воздействие агрессивных веществ, аутоиммунные реакции нарушение созревания частично детерминированной стволовой клетки уменьшение количества стволовых клеток уменьшение количества эритроцитов, тромбоцитов, лейкоцитов в периферической крови.
Клиника апластических анемий:
а) приобретенная апластическая анемия: постепенное или острое начало с быстро нарастающей панцитопенией, выраженным анемическим синдромом, тяжелым геморрагическим синдромом и инфекционными осложнениями; иногда заболевание осложняется внутрисосудистым гемолизом (появляются желтушность кожи и видимых слизистых, темная моча, незначительное увеличение печени, тромбозы множественной локализации).
б) анемия Фанкони: чаще начинается в 5-10 лет; вместе с нарушениями гемопоэза характерны низкий рост, врожденные дефекты скелета (микроцефалия, аномалии фаланг пальцев), аномалии мочеполовой системы (подковообразная почка и др.), гиперили гипопигментация кожи, умственная отсталость
81
Диагностика апластических анемий:
1.ОАК: панцитопения (эритро-, тромбо-, лейкоцитопения с нейтропенией и относительным лимфоцитозом)
2.Миелограмма: уменьшение количества миелокариоцитов, относительное повышение содержания лимфоцитов, абсолютное снижение количества нейтрофилов, элементов эритропоэза, резкое уменьшение мегакариоцитопоэза
3.Трепанобиопсия с иммунофенотипированием клеток (необходима для установки генеза апластической анемии): жировой костный мозг преобладает над деятельным, очаги кроветворения редки и малоклеточны
Лечение апластических анемий:
1.Госпитализация в гематологический стационар; при резкой нейтропении – изоляция больного в асептический бокс
2.Трансплантация стволовых клеток периферической крови или костного мозга – рекомендуется всем больным до 20 лет, даже при тяжелом течении апластической анемии, особенно показана зависимым от гемотрансфузий больным (у которых нужны переливания крови чаще 1 раза в мес); до трансплантации костного мозга проводят химиотерапию с тотальным облучением тела.
3.Специфическая консервативная терапия – основной метод лечения для больных старше 20 лет при легком течении заболевания или невозможности выполнить трансплантацию костного мозга: антитимоцитарный иммуноглобулин 20 мг/кг/сут в/в капельно 5 дней в асептических условиях; циклоспорин 5 мг/кг/сут внутрь; метилпреднизолон по 2 мг/кг/сут в/в с 1-ого по 14-ый день, затем по 1 мг/кг/сут с 15-ого по 21-ый день; колониестимулирующие факторы - молграмостим 5 мкг/кг/сут п/к до увеличения числа гранулоцитов > 1*109/л.
4.Спленэктомия (наиболее эффективна при нетяжелой апластической анемии)
5.Профилактика и лечение осложнений (анемического синдрома, геморрагического синдрома, инфекционных осложнений, гемосидероза, сердечной и почечной недостаточности и др.)
57.Острые лейкозы: этиология, патогенез, классификация, клиника, диагностика, основные принципы терапии.
Острые лейкозы (ОЛ) – гетерогенная группа опухолевых заболеваний, при которых бластами (морфологически незрелыми клетками) поражается костный мозг с вытеснением нормальных элементов кроветворения и инфильтрируются внутренние органы. Эпидемиология: заболеваемость 5 на 100 тыс. ежегодно.
Этиология достоверна неизвестна, предрасполагающие факторы: а) ионизирующее излучение (частота возникновения ОЛ прямо пропорциональна дозе облучения) б) химиотерапия и лучевая терапия других опухолей в) курение (возможная причина 20% всех лейкозов)
г) химические агенты (бензол, летучие органические растворители, левомицетин, бутадион) д) вирус Т-клеточной лейкемии – лимфомы человека
е) врожденные заболевания с повышенной хромосомной нестабильностью (болезнь Дауна, синдром Блума) ж) Т-клеточный вирус 1-ого типа е) накопление в организме метаболитов триптофана и тирозина (обменная теория)
Патогенез ОЛ:
Мутация в генетическом материале кроветворной клетки и ее размножение с образованием опухолевого клона диссеминация опухолевых клеток (метастазирование по кроветворной системе) распад бластных клеток с повышением мочевой кислоты в сыворотке (вторичная гиперурикемия), их пролиферация:
а) в костном мозге с угнетением нормального кроветворения и развитием гранулоцитопении, анемии, тробмоцитопении б) экстрамедуллярно в ЦНС, печени, селезенке, л.у., других органах
В результате повышенной изменчивости хромосом периодически наблюдается опухолевая прогрессия – образование новых субклассов бластов, из-за которых изменяются свойства опухоли в сторону большей агрессивности.
ФАБ-классификация ОЛ.
В основу положены внешний вид, цитохимические и генетические особенности, иммунофенотип бластных клеток: а) нелимфобластные (миелоидные) лейкозы – 8 типов (М0-М7)
б) лимфобластные лейкозы – 3 типа (L1-L3) в) миелопоэтические дисплазии – 4 типа
Клинические проявления для всех видов острого лейкоза одинаковы:
а) начальная стадия - начало заболевания острое (с высокой температурой тела, выраженной слабостью, интоксикацией, болями в суставах, при глотании, в животе и т.д.) или медленное (с нарастающей слабостью, прогрессирующим снижением работоспособности, болями в костях, мышцах, суставах, незначительным увеличением л.у., небольшими геморрагиями на коже)
б) стадия развернутой клинической картины – ряд синдромов («барометров лейкоза»):
1)гиперпластический синдром – обусловлен лейкозной инфильтрацией тканей: безболезненное увеличение л.у., миндалин, печени, селезенки; гиперплазия десен и развитие язвенно-некротического стоматита; субпериостальные лейкемические инфильтраты (выраженная болезненность костей при поколачивании); лейкемиды на коже (лей-
козные инфильтраты в виде распространенных красновато-синеватых папулообразных бляшек); болезненная инфильтрация яичек; нейролейкемия
2)геморрагический синдром - обусловлен тромбоцитопенией, повышением проницаемости и снижением резистентности стенки сосудов, нарушением коагуляционной активности крови в связи с дефицитом свертывающих факторов, повышение фибринолитической активности крови: обширные внутрикожные кровоизлияния, носовые, желудочные, кишечные, почечные, легочные, маточные, внутрицеребральные кровотечения
3)анемический синдром – обусловлен резким сокращением красного кроветворного ростка в костном мозге, интоксикацией и кровотечением
4)интоксикационный синдром – характеризуется выраженной общей слабостью, высокой температурой тела, проливными потами ночью, головной болью, отсутствием аппетита, падением массы тела, атрофией мускулатуры, тошнотой и рвотой.
5)иммунодефицитный синдром – обусловлен гранулоцитопенией и интоксикацией; характерны тяжелые инфекционные заболевания (пневмонии и др. инфекции вплоть до сепсиса)
Диагностика острых лейкозов:
1.ОАК: нормохромная нормоцитарная анемия; различное количество лейкоцитов (от 5*109/л до 200*109/л), нейтропения (не зависит от количества лейкоцитов), абсолютный лимфоцитоз; тромбоцитопения; «лейкемичекий провал» - присутствие бластов, зрелых форм на фоне отсутствия промежуточных; при ОМЛ – азурофильные гранулы и палочки Ауэра.
2.Миелограмма: увеличение содержания бластных клеток с различной морфологией (в зависимости от типа ОЛ) более 5% и вплоть до тотального бластоза; угнетение красного ростка кроветворения; мегакариоциты отсутствуют или их количество незначительно + цитохимическое исследование (при ОЛЛ – положительная ШИК-реакция, при ОМЛ – положительная миелопероксидазная реакция) + иммунофенотипирование бластов (определение CD-маркеров) + цитогенетическое исследование (определение хромосомных аномалий).
3.Исследование ликвора: повышенный цитоз за счет бластов при нейролейкемии
4.Рентгенограмма органов грудной клетки: расширение тени средостения за счет увеличения внутригрудных л.у., лейкемиды в легких.
5.УЗИ органов брюшной полости: увеличение печени и селезенки; очаги лейкемоидной инфильтрации в паренхиматозных органах и др. исследования по показаниям
82

Лечение ОЛ:
1) основной принцип лечения – максимально полное удаление лейкозных клеток на всех этапах При ОЛ есть 2 популяции клеток – пролиферирующая (находится в митотической фазе цикла, на нее действует полихимиотерапия)
и непролиферирующая. Терапия должна быть интенсивной, длительной, сочетать циклоспецифические и циклонеспецифические препараты с целью достижения стабильной ремиссии (5 лет и >).
2) терапия ОЛЛ: программа CALGB: курс I – индукция ремиссии (4 нед); курс II – ранняя интенсификация (4 нед); курс III – ЦНСпрофилактика и межкурсовая поддерживающая терапия (12 нед); курс IV – поздняя интенсификация (8 нед); курс V – длительная поддерживающая терапия (до 24 месяцев от момента установления диагноза)
При рецидиве или рефрактерных формах используют специальные схемы – 5-дневная RACOP, COAP, COMP, а затем основная схема.
Другие препараты, применяемые для лечения ОЛ: а) алкилирующие соединения, нарушающие синтез нуклеиновых кислот: циклофосфан б) антиметаболиты – предшественники нуклеиновых кислот: 6-меркаптопурин, метотрексат
в) антимитотические средства – блокируют митоз в стадии метафазы путём денатурации тубулина: винкристин г) противоопухолевые АБ – антрациклины, подавляют синтез ДНК и РНК: рубомицин
д) ферменты: L-аспарагиназа (разрушает L-аспарагин, т.к. у бластов в нём повышенная потребность) е) ГКС: преднизолон
3)терапия ОМЛ: «7+3»: цитозин-арабинозид 7 дней, затем даунорубицин 3 дня
4)на фоне полихимиотерапии обязательна терапия прикрытия: АБ; дезинтоксикация, включая гемосорбцию, плазмаферез; заместительная компонентная терапия при глубокой цитопении (переливание эритроцитарной массы, тромбоцитов); аллопуринол (изза массивного клеточного распада); растворы АК и жировые эмульсии; профилактика вирусных и грибковых осложнений и др.
5)трансплантация стволовых кроветворных клеток или костного мозга показана при рецидивах или невозможности достичь стойкой ремиссии
58. Хронический миелолейкоз: этиология, патогенез, клиника, диагностика, принципы лечения
Хронический миелолейкоз (ХМЛ) – миелоидная опухоль, развивающаяся из полипотентной клетки-предшественницы, пролиферация и дифференцировка которой приводит к расширению ростков кроветворения, представленных преимущественно зрелыми и промежуточными формами. Закономерным исходом ХМЛ является бластный криз.
Эпидемиология: 20% всех лейкозов, на 3-ем месте по распространенности после острых лейкозов и ХЛЛ. Клеточный субстрат ХМЛ: преимущественно гранулоциты (в основном нейтрофилы).
Этиология ХМЛ – достоверно доказана роль в возникновении ХМЛ:
а) ионизирующего излучения (пострадавшие от бомбардировки Хиросимы и Нагасаки; больные спондилоартритом, получавшие рентгенотерапию)
б) химических агентов (бензол и др. органические растворители) Патогенез ХМЛ:
1.Перенос большей части длинного плеча хромосомы 22 на длинное плечо хромосомы 9, а малой терминальной части длинного плеча 9 хромосомы на хромосому 22 с образованием Рh-хромосомы («филадельфийской» - диагностический признак для ХМЛ)
2.На длинном плече хромосомы 9 расположен протоонкоген ABL, кодирующий образование белка семейства тирозинпротеинкиназ; при транслокации часть протоонкогена переносится на длинное плечо хромосомы 22 в тот участок, где произошел разрыв и находится ген BCR; в результате этого слияния на хромосоме 22 образуется ген BCR-ABL, который кодирует химерный белок, имеющий более выраженную тирозинкиназную активность, чем его нормальный прототип.
3.Активация различных участков химерного гена обусловливает цепь событий, ведущих к увеличению клеточной пролиферации.
Клиника и диагностика ХМЛ:
а) начальная стадия – ХМЛ практически не выявляется (при случайном исследовании ОАК можно выявить изменения: лейкоцитоз, базофильно-эозинофильная ассоциация), клиника отсутствует
б) стадия акселерации (развернутая стадия):
-появляется быстрая утомляемость, потливость, субфебрилитет, потеря массы тела
-тяжесть и боли в левом подреберье при увеличении селезенки (она может быть даже в малом тазу); возможны инфаркты селезенки с отрыми болями
-печень слабо увеличена
-л/у практически не увеличены
-геморрагический синдром обычно отсутствует
-в легких – пневмония, связанная с лейкемической инфильтрацией и вторичной инфекцией
Диагностика:
1)ОАК – нормохромная анемия средней степени тяжести, лейкоцитоз, увеличение базофилов и эозинофилов, снижение лимфоцитов и немного – моноцитов, присутствие всех форм нейтрофилов (миелобластов, промиелоцитов, юных, палочкоядерных, сегментоядерных, лейкемический провал отсутствует), тромбоциты умеренно снижены, СОЭ ускорено
2)миелограмма - увеличение числа мегакариоцитов, процента незрелых гранулоцитов с повышением миелоидно-эритроидного соотношения до 20-25 : 1 (в норме – 3-4 : 1); снижение ЩФ нейтрофилов менее 25 ед; Ph-хромосома в кроветворных клетка миелоидного ряда
3)БАК - увеличение витамина В12 в 10-15 раз, увеличение мочевой кислоты (гиперурикемический синдром), значительное повышение ЛДГ.
в) терминальная стадия (бластный криз) – характерно появление в клетках костного мозга дополнительных хромосомных нарушений, в период ремиссии бластного криза эти дополнительные хромосомные нарушения исчезают:
- ухудшение самочувствия, стойкое повышение температуры, истощение больного - увеличение селезенки и в меньшей степени печени - дистрофические изменения внутренних органов - рефрактерность к проводимой терапии - геморрагический синдром
- частые инфекционные осложнения и др. проявления острого лейкоза
Лечение ХМЛ:
1. Химиотерапия:
Влечении ХМЛ применяются ряд препаратов: а) миелосан (бусульфан, милеран) – алкилирующий препарат, использовался в лечении ХМЛ первым; б) гидроксимочевина (литалир) - ингибитор рибонуклеотидазы – фермента, необходимого для синтеза ДНК; в)
α-интерферон – позволяет получить гематологическую, цитогенетическую ремиссию, понижает уровни ЛДГ и витамина В12; г) цитозар - пиримидиновый нуклеозид, активный метаболит которого угнетает ДНК-полимеразу, что ведет к нарушению синтеза ДНК и подавлению роста Ph-позитивных клеток; д) рубомицин-антрациклин
Внастоящее время фазу акселерации и терминальную фазу применяют схему 3+7 (рубомицин-антрациклин + цитозар) каждые 1,5-2 месяца.
Новые препараты в терапии ХМЛ:
83
а) гомохаррингтонин – синтетический аналог китайского растительного алкалоида б) децитабин – ингибитор гиперметилирования в клеточных циклах (данный процесс наблюдается при прогрессировании опухолей, в период бластного криза)
в) полностью транс-ретиноевая кислота (ATRA) + IFNα
г) топотекан – ингибитор фермента топоизомеразы I, необходимой для репликации ДНК д) ГМ-КСФ + IFNα
е) ингибитор мутантной тирозинкиназы Гливек (иматиниб мозилат) – соединяесь с активными центрами BCR-ABL-тирозинкиназы, он нарушает процессы взаимодействия субстратов внутри клетки, что приводит к гибели клеток, содержащих белок р210, т.е. Phпозитивных
2.Лучевая терапия: показана при резко выраженной спленомегалии и перисплените, при экстрамедуллярных опухолевых образованиях, угрожающих жизни больного
3.При угрозе разрыва селезенки показана спленэктомия.
4.В период клинико-гематологической ремиссии показана трансплантация костного мозга.
59. Хронический лимфолейкоз: этиология, патогенез, клинические варианты, диагностика, осложнения, принципы лечения.
Хронический лимфолейкоз (ХЛЛ) – клональное лимфопролиферативное неопластическое заболевание, характеризующееся пролиферацией и увеличением в периферической крови количества зрелых лимфоцитов на фоне лимфоцитарной инфильтрации костного мозга, лимфатических узлов, селезенки и других органов.
Эпидемиология: около 30% всех лейкозов; заболеваемость 2,7 на 100 тыс.; болеют в основном пожилые; в 95% случаев клеточный субстрат представлен В-лимфоцитами, в 5% - Т-лимфоцитами
Этиология ХЛЛ:
1)ретровирусы – их роль в развитии ХЛЛ сегодня уже очевидна
2)наследственная предрасположенность (хромосомные аномалии, обнаруживаются в 100% случаев; наиболее характерны трисомия 12, делеция длинного плеча 13 хромосомы, избыток генетического материала в 14 хромосоме и др.)
В настоящее время развитие ХЛЛ не ассоциируется с воздействием ионизирующего излучения, лекарств, химических веществ.
Патогенез В-клеточного ХЛЛ (как наиболее частой формы):
1.Возникновение патологического клона клеток-предшественниц, дифференцирующихся только по В-лимфоцитарному пути, вследствие воздействия вирусов или спонтанных генетических мутаций
2.Развитие патологического клона клеток по законам опухолевой прогрессии, но значительно медленнее и менее агрессивно, чем при остром лейкозе, с преобладанием зрелых лимфоцитов, накапливающихся вначале в лимфатических узлах, далее – в лимфоидных тканях, печени, селезенки, костном мозге.
3.Прогрессирующая лимфоцитарная инфильтрация костного мозга, приводящая к нарушениям гемопоэза (анемии, гранулоцитопении, тромбоцитопении), продукции иммуноглобулинов, возникновению аутоиммунных конфликтов (из-за неполноценности лимфоцитов патологического клона).
Клинические проявления и диагностика ХЛЛ:
а) начальный период:
-общее состояние удовлетворительное, жалобы на небольшую слабость, потливость, частые простудные заболевания
-небольшое увеличение л.у. (в первую очередь – шейных, затем подмышечных, остальные л.у. увеличиваются в развернутой стадии заболевания); л.у. эластично-тестотваты, безболезненны, не спаяны с кожей и между собой, не изъязвляются и не нагнаиваются Диагностика: лейкоцитоз 10-30*109/л, не имеющий тенденции к увеличению; абсолютный лимфоцитоз до 60-80%
б) период выраженных клинических проявлений:
-жалобы на резко выраженную общую слабость, снижение работоспособности, значительную потливость, особенно ночью, похудание, повышение температуры тела
-выраженная лимфаденопатия (увеличены практически все группы периферических л.у. в различной степени – от горошины до куринового яйца); л.у. эластично-тестоватые, безболезненные, не спаяны между собой и с кожей
-неспецифические поражения кожи (обострения ранее существовавших болезней – экземы, псориаза; опоясывающий герпес, иногда генерализованного характера; крапивница, нейродермит; грибковые поражения)
-проявления лейкемической инфильтрации внутренних органов:
-значительно увеличенная селезенка (но меньше, чем при ХМЛ), плотная селезенка с гладкой поверхностью, реже – увеличенная печень с загругленным плотноватым краем и гладкой поверхностью
-язвенное поражение желудка, ДПК, желудочно-кишечные кровотечения, синдром мальабсорбции (из-за лейкемической инфильтрации слизистой ЖКТ)
-очаговые (клинически не проявляются) или диффузные диссеменированные (клинически – одышка, кашель, кровохарканье, крепитация над всей поверхностью легких) инфильтраты в легких; фибринозный или экссудативный плеврит; частые инфекци- онно-воспалительные заболевания органов дыхания
-очаговые поражения миокарда (клинически не проявляются) или миокардиодистрофия; повышение проницаемости сосудов различного калибра
-поражение почек с умеренной протеинурией, реже микрогематурией без нарушения их функции
-приапизм у мужчин (длительная и болезненная эрекция из-за лейкемической инфильтрации кавернозных тел)
-нейролейкемия с развитием менингита, менингоэнцефалита, параличей и даже комы
Диагностика:
1)ОАК: лейкоцитоз (50-200*109/л), резкий лимфоцитоз периферической хрови (10*109/л и более при норме < 4,5*109/л); в лейкоцитарной формуле лимфоцитов 80-90%, преимущественно зрелых (размеры 10-12 мкм, форма округлая или овальная, ядро расположено экцентрично, хроматин гомогенный, разделен светлыми бороздами, цитоплазма неширокая, светло-голубая); тени Боткина-Гумпрехта (полуразрушенные ядра лимфоцитов); нормохромная нормоцитарная анемия; тромбоцитопения; увеличение СОЭ
2)миелограмма: выраженная лимфоидная инфильтрация (более 30% лимфоцитов от общего числа миелоцитов), значительное уменьшение гранулоцитов
3)пункция л.у. – проводится в трудных дифференциально-диагностических случаях; пунктат состоит из преимущественно зрелых малых лимфоцитов
4)пункция селезенки – выполняется при алейкемическом лимфолейкозе, протекающем без увеличения
л.у. и без четких морфологических проявлений ХЛЛ в стернальном пунктате), главным образом при доминировании в клинической картине спленомегалии; характерно значительное увеличение количества лимфоцитов и пролимоцитов
5)ОАМ: протеинурия, нерезко выраженная микрогематурия
6)БАК: гипогаммаглобулинемия, которая усугубляется по мере прогрессирования процесса; гипоальбуминемия; изменения ферментов печени
7)иммунологический анализ крови и иммунотипирование: определение В- или Т-клеточной формы ХЛЛ; снижение содержания в крови IgG и особенно IgA и IgM; цитогенетическое и цитохимическое исследование лимфоцитов
84
8) методы инструментальной диагностики (УЗИ, КТ и др.) для выявления поражения внутренних органов.
в) терминальная стадия:
-резко прогрессирующее ухудшение общего состояния больных, истощение, выраженная интоксикация, исчезновение аппетита, высокая температура тела
-развитие тяжелых осложнений (различных инфекционно-воспалительных процессов, почечной недостаточности, нейролейкемии, кардиомиопатии и сердечной недостаточности, геморрагических кровотечений)
Осложнения ХЛЛ:
1)инфекционно-воспалительные процессы (особенно характерен генерализованный герпес), частые флегмоны (в т.ч. и от инъекций), присоединение внутрибольных инфекций, туберкулеза
2)ателектазы легких, нарушения вентиляции (при гиперплазии лимфатических фолликулов бронхиального дерева и инфильтрации опухолевыми клетками самой легочной ткани), плевриты
3)ХПН (при инфильтрации паренхимы почек)
4)синдром цитолиза (гемолиз, анемия, ретикулоцитоз, тромбоцитопения и тяжелые геморрагии)
5)кардиомиопатия и развитие сердечной недостаточности (при инфильтрации миокарда)
Основные клинические варианты ХЛЛ: а) доброкачественная; б) прогрессирующая; в) спленомегалическая; г) абдоминальная; д) опухолевая; е) костномозговая; ж) пролимфоцитарная.
Для определения показаний к началу лечения выделяют клинические стадии ХЛЛ: 0 стадия – Т-лимфоцитоз; 1 стадия – Т-лимфо- цитоз и лимфаденопатия, 2 стадия – спленоили гепатомегалия, 3 стадия – аутоиммунная гемолитическая анемия, 4 стадия – аутоиммунная тромбоцитопения.
Лечение ХЛЛ:
1.На ранней стадии болезни при стабильном лейкозе лечение не проводят, показано лишь наблюдение и периодический контроль анализов крови (терапия «ждать и наблюдать»); показания к началу лечения: ухудшение общего состояния (появление лихорадки, потливости, похудания и др.) с увеличением л.у. и внутренних органов; нарастание лейкоцитоза выше 50*109/л; появление аутоиммунных феноменов; учащение и тяжесть инфекционных осложнений.
2.Первоначальная цитостатическая терапия:
а) при лейкоцитозе и умеренной лимфаденопатии: лейкеран (хлорбутин) 4-10 мг 1 раз/сут, затем терапия поддержания 4-8 мг через день б) при лейкоцитозе и выраженной лимфаденопатии: циклофосфан (эндоксан) 200-400 мг внутрь 1 раз/сут, затем прерывистая
терапия 200-300-400 мг 1 раз/сут через день 10 дней, после двухнедельного перерыва – повторить курс.
3.При неэффективности монохимиотерапии – полихимиотерапия по следующим программам: СНОР – циклофосфамид, винкристин,
адриамицин, преднизолон; СОР – циклофосфамид, винкристин, преднизолон; САР – циклофосфамид, адриамицин, преднизолон; М2
– циклофосфамид, кармустин, винкристин, мелфалан, преднизолон и др.
4.При резистентности к цитостатикам: лимфоцитоферез + введение гамма-иммуноглобулина.
5.Дистанционная гамма-терапия показана при резком увеличении отдельных групп л.у. и селезенки и при выраженной генерализованной лимфаденопатии.
Новые перспективные препараты для лечения ХЛЛ: гемцитабин; кладрибин; мабтера (ритуксимаб – химерные антитела против поверхностного В-клеточного CD20); антитела Campath-1H (анти-CD52).
60.Истинная полицитемия: этиология, патогенез, клиника, диагностика, исходы, принципы лечения. Симптоматические эритроцитозы.
Истинная полицитемия (эритремия, болезнь Вакеза) – хронический лейкоз с поражением на уровне клетки-предшественни- цы миелопоэза с характерной для опухоли неограниченной пролиферацией этой клетки, сохранившей способность дифференцироваться по трем росткам, преимущественно по красному.
Этиология: неизвестна.
Патогенез: усиленный эритропоэз эритроцитоз в периферической крови вторичные реологические (из-за повышения гемато-
крита и вязкости крови) и коагуляционные нарушения, миелоидная метаплазия в селезенке аплазия костного мозга и миелофиброз или трансформация в ХМЛ с бластными кризами.
Клиника истинной полицитемии - – 2 синдрома:
а) плеторический (плетора – полнокровие) - увеличение в крови количества эритроцитов, лейкоцитов, тромбоцитов б) миелопролиферативный - обусловлен гиперплазией всех трех ростков кроветворения в КМ и экстрамедуллярно
Заболевание начинается постепенно, с покраснения кожи лица, появления тяжести в голове, протекает в несколько стадий:
I стадия (начальная, 5 и более лет):
-умеренный эритроцитоз в крови, панмиелоз в костном мозге
-селезенко несколько увеличена, но не пальпируется
-может быть увеличено АД
IIА стадия – эритремическая (развернутая) без миелоидной метаплазии селезенки:
-головные боли по типу мучительных мигреней с нарушением зрения, боли в сердце по типу стенокардиальных
-кожный зуд и эритромелалгии (жгучие приступообразные боли в кончиках пальцев рук и ног с покраснением кожи)
IIВ стадия – эритремический процесс с миелоидной метаплазией селезенки:
-спленомегалия, умеренная гепатомегалия
-красно-цианотичная кожа
-стабильно повышенное АД с выраженной церебральной симптоматикой
-тромбозы коронарных и церебральных сосудов, сосудов нижних конечностей с соответствующей клиникой
-иногда - кровотечения (хронический ДВС-синдром с потреблением) из десен, носа и др.
-может впервые появиться язва желудка и ДПК, нарушение обмена мочевой кислоты (клиника подагры), мочекаменная болезнь
-в крови: панцитоз, обилие клеток крови забивает микроциркуляторное русло, начинается истощение больного, шок, реакции в органах и тканях с потерей их функции
III стадия – терминальная - анемическое перерождение доброкачественной опухоли в злокачественную: типична клиника ХМЛ, который дает бластный криз; если исход в миелофиброз (т.е. фиброз стромы КМ) – снижение уровня эритроцитов (анемия), тромбоцитов, лейкоцитов.
Исходы истинной полицитемии: ХМЛ с бластными кризами; миелофиброз с панцитопенией. Диагностика:
1.ОАК: повышение эритроцитов и гемоглобина, тромбоцитов, лейкоцитов, СОЭ резко замедлена (1 мм или прочерк); увеличена активность щелочной фосфатазы лейкоцитов
2.Трепанобиопсия подвздошной кости проводится с целью морфологического подтверждения диагноза
3.Миелограмма: пролиферативная стадия – гиперплазия трех ростков кроветворения, патологические мегакариоциты, отсутствие отложений железа, признаки начинающегося фиброза (повышенное содержание ретикулина); стадия истощения – неэффективный гемопоэз, фиброз кроветворной ткани, скопление мегакариоцитов
4.Другие исследования (концентрация эритропоэтина в крови, цитогенетическое исследование для выявления филадельфийской хромосомы, УЗИ, КТ) на предмет обнаружения эритропоэтин секретирующих опухолей.
85
Лечение истинной полицитемии:
1.Ликвидация плеторы: кровопускание по 300-500 мл за раз через день до Hb 150 г/л, затем реополиглюкин и дезагреганты (трентал) в/в; эритроцитаферез 1-2 процедуры через 5-7 дней (забирается 1,0-1,5 л крови, возвращается плазма).
2.Борьба с миелоидной пролиферацией: цитостатики - гидроксимочевина, интерферон-α, анагрелид (сдерживает гиперпродукцию тромбоцитов)
3.Лечение исходов болезни:
а) миелофиброза: гемотрансфузии (эритроцитарная и тромбоцитарная массы), спленэктомия, анаболические стероиды (ретаболил)
б) ХМЛ, бластного криза: цитостатическая терапия 4. Лечение осложнений болезни: сосудистых тромбозов – антикоагулянты, антиагреганты; гиперспленизма – удаление селезенки; гиперурикемии - аллопуринол 300-1000 мг/сутки
Симптоматические эритроцитозы:
а) абсолютные:
1.вызванные гипоксией: «высотная болезнь», ХОБЛ, врожденные «синие» пороки, синдром Пиквика, карбоксигемоглобинемия, гемоглобинопатии с повышенным сродством к кислороду
2.вызванные повышенной продукцией эритропоэтина: гипернефроидный рак почек, гемангиобластома мозжечка, рак печени, миома матки, опухоли коркового и мозгового слоя надпочечников б) относительные: потеря жидкости организмом (инфекции, панкреатит и др.), алкоголизм, системная гипертензия, стресс-эритро- цитоз и др.
61.Плазмоцитома: клинические проявления, диагностика, лечение.
Парапротеинемические лейкозы – опухоли, секретирующие моноклональные Ig или их фрагменты (множественная миелома, солитарная плазмоцитома, макроглобулинемия Вальденстрема, лимфомы с моноклональной секрецией Ig, болезни тяжелых Ig, трудноклассифицируемые Ig-секретирующие опухоли).
Общие клинические особенности парапротеинемических лейкозов: синдром белковой патологии; нефропатия (вторичный амилоидоз); полинейропатия; гипервискозность крови; нарушения гемостаза; нарушения гуморального иммунитета; гиперурикемический синдром (типа вторичной подагры).
Плазмоцитома (множественная миелома, болезнь Рустицкого-Калера) – злокачественная опухоль из плазматических клеток (В-лимфоцитов конечной стадии дифференцировки), секретирующих парапротеины (в 70% - патологический моноклональный IgG, в 20% - патологический моноклональный IgA, в 5% - легкие цепи иммуноглобулинов).
Этиология плазмоцитомы достоверно неизвестна, развитию заболевания способствуют следующие факторы: а) генетическая предрасположенность б) дефекты Т-клеточной супрессии
в) влияние хронической антигенной стимуляции г) повреждения генома (в результате действия радиации, химических веществ, ЛС, вирусов и др.)
Патогенез: опухолевая трансформация на уровне В-лимфоцитов-клеток памяти или плазмобластов, сохраняющих способность созревать и дифференцироваться в плазматические клетки формирование клона плазматических клеток, продуцирующих однород-
ные по иммунологическим признакам Ig (парапротеины, М-протеины) или легкие цепи иммуноглобулинов (белки Бенс-Джонса)
1)хроническая стадия – миеломные клетки с низкой пролиферативной активностью, не выходящие за пределы костного мозга и кортикального слоя кости онкогенные мутации в опухолевом клоне
2)острая стадия (терминальная) – миеломные клетки с высокой пролиферативной активностью, выходящие за пределы костного мозга и метастазирующие во внутренние органы, приводящие к тяжелой миелодепрессии, выраженной интоксикации и др. проявлениям.
Клинические проявления плазмоцитомы:
1)бессимптомный период (5-15 лет) – общее состояние удовлетворительное, клиничеких проявлений поражения внутренних органов и костной системы нет; в ОАК - высокое СОЭ, при электрофорезе белков сыворотки крови – М-компонент, в ОАМ – необъяснимая протеинурия
2)развернутая клиническая стадия – жалобы на выраженную общую слабость, снижение трудоспособности, головокружение, снижение аппетита, похудание и др.; характерны ряд клинических синдромов:
а) синдром костной патологии – миеломатозные опухоли различных размеров в ребрах, грудине, позвоночнике, черепе, конечностях, проявляющиеся болями (вначале летучими, кратковременными, затем постоянными, интенсивными, продолжительными); остеопороз и литические повреждения костей из-за усиления их резорбции; частые патологические переломы (особенно позвоночника с компрессией позвонков)
б) синдром повышенной вязкости крови – нарушение микроциркуляции из-за гиперпротеинемии: неврологические нарушения (головная боль, головокружение, пошатывание при ходьбе, ощущение онемения и слабости в руках и ногах); нарушения периферического кровотока в конечностях (вплоть до гангрены); нарушение зрения (снижение остроты, мелькание мушке и пятен перед глазами); геморрагический синдром (кровоточивость слизистых, кожные геморрагии – из-за «окутывания» тромбоцитов парапротеинами с нарушением их агрегации).
в) поражение системы кроветворения – анемический синдром (из-за сокращения красного ростка костного мозга при выраженной миеломной пролиферации), в тяжелых случаях – нейтропения и тромбоцитопения.
г) синдром белковой патологии – обусловлен гиперпродукцией парапротеинов (патологических Ig или легких цепей иммуноглобулинов – белка Бенс-Джонса); гиперпротеинемия (общий белок может достигать 150-180 г/л), диспротеинемия (гипоальбуминемия, гипергаммаглобулинемия); М-компонент на электрофореграмме белков сыворотки крови; стойкая протеинурия; амилоидоз (AL-типа)
д) синдром поражения почек (миеломная нефропатия) – парапротеины накапливаются в почечных канальцах и реабсорбируются их клетками, вызывая повреждения; характерны протеинурия, гематурия, отеки, признаки ХПН
е) синдром висцеральной патологии – обусловлен развитием экстрамедуллярных поражений (чаще печени, селезенки, реже – плевральных оболочек, ЖКТ)
ж) синдром вторичного иммунодефицита – обусловлен снижением уровня нормальных иммуноглобулинов сыворотки, нарушением антителообразования, уменьшением гранулоцитов и их функциональной активности; проявляется предрасположенностью к инфекциям (частые ОРВИ, опоясывающий герпес и др.)
з) неврологический синдром – обусловлен плазмоклеточной инфильтрацией твердой мозговой оболочки, экстрадуральными миеломами, изменениями костей черепа и позвонков, компрессией нервных стволов миеломными разрастаниями; клинически
– периферическая нейропатия (мышечная слабость, снижение поверхностной чувствительности, парестезии и др.), сдавление корешков спинного мозга, поражение черепно-мозговых нервов
к) гиперкальциемический синдром – обусловлен вымыванием кальция из костей в связи с их резорбцией; клинически
– тошнота, рвота, сонливость, нарушения сознания, дезориентированность (если уровень кальция более 3,5 ммоль/л – необходимы прием внутрь более 3 л минеральной воды + форсированный диурез).
86
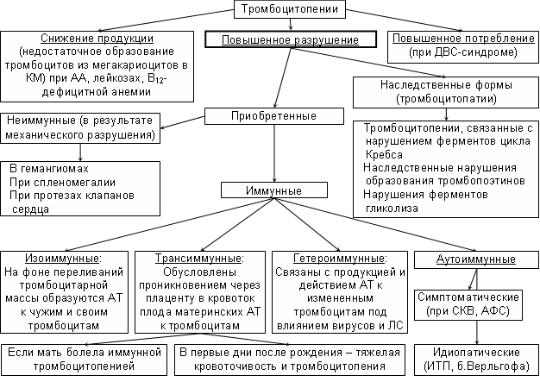
3) терминальная стадия – тяжелое клиническое течение, резкое обострение всей симптоматики, прогрессирование ХПН, анемии, тяжелых инфекционныз процессов, быстрое разрушение костей с прорастанием миеломой окружающих мягких тканей, внутренних органов и гибелью больного.
Диагностика плазмоцитомы:
1)ОАК: очень высокая СОЭ, могут быть анемия, лейкопения, тромбоцитопения
2)БАК: увеличение общего белка за счет гипергаммаглобулинемии; гиперкальциемия; повышение концентрации креатинина и мочевины
3)ОАМ: протеинурия, выявление белка Бенс-Джонса
3)иммунохимическое исследование крови и мочи: М-градиент во фракции гамма-глобулинов
4)миелограмма – плазмоцитоз (более 10% плазматических клеток в биоптате); плазматические клетки имеют широкую интенсивно синюю цитоплазму с четкими граница и овальное экцентрично расположенное ядро с колесовидным рисунком хроматина
5)рентгенологическое исследование костей – зоны лизиса костной ткани; компрессионные поражения позвоночника; «штампованные» литические поражения костей черепа и др.; различают 3 рентгенологические формы плазмоцитомы – остеолитическую (зоны просветления различной величины); кистозно-трабекулярную («мыльные пузыри»); диффузный остеопороз.
Лечение:
1.Основной метод – химиотерапия: мелфалан 9 мг/м2 + преднизолон 100-200 мг (режим М + Р) – стандарт терапии первой линии, 6-12 курсов --> ремиссия --> поддерживающая терапия интерфероном-α в дозе 3 млн. ЕД/м2 3 раза в неделю. При плазмоцитоме рецидивы неизбежны; другие алкилирующие препараты: алкеран, сарколизин, циклофосфан, препараты нитрозомочевины и т.д.
2.Лучевая терапия паллиативна, применяется при устойчивости плазмоцитомы к цитостатикам.
3.На фоне полихимиотерапии возможна трансплантация костного мозга
4.Симптоматическое лечение: остеопороз – бифосфонаты, гиперкальциемия – гидратация с форсированным диурезом; для снижения гипервязкости – плазмаферез; анемия – гемотрансфузии; инфекции – АБ и др.
62.Геморрагические диатезы: этиология, патогенез, классификация. Клиника, диагностика и лечение тромбоцитопенической пурпуры.
Геморрагические диатезы – патологические состояния, характеризующиеся повышенной кровоточивостью в результате недостаточности одного или нескольких элементов гемостаза.
Этиопатогенетическая классификация геморрагических диатезов:
а) наследственные – связаны с генетически детерминированными патологическими изменениями сосудистой стенки, аномалиями мегакариоцитов, тромбоцитов, адгезивных белков плазмы и плазменных факторов свертывающей системы крови.
б) приобретенные – обусловлены следующими причинами:
1)вследствие первичного поражения сосудистой стенки: наследственная геморрагическая телеангиэктазия РандюОслера; геморрагический васкулит Шенлейна-Геноха; синдром Элерса-Данло, гиповитаминозы С и В и др.
2)вследствие первичного поражения мегакариоцитарно-тромбоцитарного ростка:
1.тромбоцитопении (идиопатическая тромбоцитопеническая пурпура, повышенное потребление тромбоцитов
при ДВС, перераспределение тромбоцитов и их депонирование в селезенке)
2.тромбоцитопатии (тромбастения Глянцмана, болезнь фон Виллебранда)
3)вследствие нарушения свертывания крови (коагулопатии): витамин К-зависимые (при недостаточности функции печени, нарушении всасывания витамина К, алиментарной недостаточности витамина К и др.); печеночная недостаточность с дефицитом факторов свертывания и др.; патологические ингибиторы свертывания («волчаночный антикоагулянт»)
4)вследствие комплексных нарушений различных звеньев свертывающей системы: острые синдромы диссеминированного внутрисосудистого свертывания
Типы кровоточивости:
1)капиллярный (микроциркуляторный, петехиально-пятнистый, синячковый) – петехиальные высыпания, синяки и экхимозы на коже и слизистых; часто сочетается с кровоточивостью слизистых - носовыми кровотечениями, меноррагиями (тромбоцитопении, тромбоцитопатии)
2)гематомный – болезненные, напряженные кровоизлияния в подкожную клетчатку, мышцы, крупные суставы, брюшину и забрюшинное пространство; иногда почечные и желудочно-кишечные кровотечения (гемофилия А и В)
3)смешанный капиллярно-гематомный (синячково-гематомный) – петехиально-синячковые высыпания в сочетании с обширными плотными кровоизлияниями и гематомами; кровоизлияния в суставы не характерны
4)васкулитно-пурпурный – геморрагические или эритематозные (на воспалительной основе) высыпания различной величины; легко возникают в местах сдавления кожи поясом, носками (васкулиты)
5)ангиоматозный – упорные, строго локализованные и привязанные к локальной сосудистой патологии кровотечения (телеангиэктазии, гематомы)
Тромбоцитопеническая пурпура – группа заболеваний, объединяемых по принципу единого патогенеза тромбоцитопении (укорочение продолжительности жизни тромбоцитов, обусловленное действием АТ к ним или другими механизмами их разрушения).
В норме количество тромбоцитов 150-450/мкл, минимальный их уровень – критическая цифра Франка – 30/мкл (ниже нее можно ожидать спонтанных геморрагий). Этиология идиопатической тромбоцитопенической пурпуры неизвестна, в основе патогенеза – фиксация на поверхности тромбоцитов IgG, направленных против АГ собственных тромбоцитов
усиление фагоцитоза тромбоцитов макрофагами селезенки и печениповышенное разрушение тромбоцитов, укорочение продолжительности их жизни (с 7-10 дней в норме до нескольких часов)
87
Различают острую (обычно у детей 2-6 лет, длится не более 6 мес, характерны быстрое, внезапное начало, выраженный геморрагический синдром с последующим спонтанным выздоровлением или ремиссией) и хроническую (у врослых, длится несколько лет) формы заболевания.
Клиника хронической формы идиопатической тромбоцитопенической пурпуры.
-заболевание наиболее характерно для женщин, развивается постепенно, исподволь, носит хронический, рецидивирующий характер со сменой периодов обострения периодами ремиссии различной длительности
-геморрагический синдром:
а) кровоточивость петехиально-пятнистого типа в виде кожных геморрагий, локализующихся чаще всего на передней поверхности туловища, верхних и нижних конечностях, в местах инъекций; цвет геморрагических высыпаний меняется в зависимости от давности их появления: вначале пурпурно-красный, затем голубоватый, зеленоватый, желтый («цветение синяков»)
б) кровотечения из слизистых оболочек: носовые, десневые, полименорея, при тяжелом течении – почечные (макрогематурия), легочные (кровохарканье), желудочно-кишечные (мелена, рвота «кофейной гущей») и др. кровотечения
-могут наблюдаться внутримозговые и субарахноидальные кровоизлияния, кровоизлияния в склеру или сетчатку глаза, тяжелые кровотечения после тонзиллэктомии, экстракции зуба, во время операции и родов
-при частых и обильных кровотечениях - признаки постгеморрагической анемии (бледность кожи и видимых слизистых и др.)
Диагностика тромбоцитопенической пурпуры:
1.ОАК: снижение общего количества тромбоцитов < 100*109/л, их морфологические изменения (анизоцитоз, пойкилоцитоз и шизоцитоз); преобладают тромбоциты больших размеров (3-4 нм в диаметре), встречаются тромбоциты малых размеров и фрагменты тромбоцитов («микрочастицы»); гипохромная анемия; умеренный нейтрофильный лейкоцитоз со сдвигом влево после обильной кровопотери
2.Исследование гемостаза: увеличение времени кровотечения (до 15 мин и более при норме 2,0-7,5 мин); нарушение ретракции кровяного сгустка
3.Иммунограмма: повышенное содержание IgG к АГ тромбоцитов, увеличение циркулирующих иммунных комплексов
Лечение тромбоцитопенической пурпуры:
1. Преднизолон или метилпреднизолон в начальной дозе 1 мг/кг/сут нет эффекта 5-7 дней увеличение дозы до 2-3 мг/кг/сут (возможна пульс-терапия метилпреднизолоном); длительность гормональной терапии от 1-4 ме-
сяцев до полугода, геморрагии купируются в первые дни лечения, а тромбоциты увеличиваются постепенно
2.При неэффективности ГКС в течение полугода – спленэктомия
3.При неэффективности спленэктомии – химиотерапия (винкристин, азатиоприн, циклофосфамид в сочетании с преднизолоном)
4.Возможно применение больших доз человеческого Ig в/в (сандоглобулин 0,25 г/кг, затем поддерживающая доза 0,5 мг/кг каждые 15 дней) – иммуноглобулин закрывает рецепторы макрофагов и те перестают поглощать тромбоциты
5.Плазмаферез для удаления АТ
6.Курсы лечения дициноном (этамзилатом) по 1,5 г/сут внутрь в течение 14 дней
7.Инфузии тромбоцитов не показаны и используются только по жизненным показаниям
63. Геморрагический васкулит: этиология, патогенез, клинические варианты, диагностика, лечение.
Геморрагический васкулит (болезнь Шейлейна-Геноха) – васкулит, характеризующийся отложением в стенках мелких сосудов (артериолах, капиллярах, венулах) IgA-содержащих иммунных комплексов с характерными симметричными геморрагическими высыпаниями, артритом, абдоминальным синдромом и гломерулонефритом.
Эпидемиология: 1-оме место среди системных васкулитов; чаще болеют дети и молодые люди до 20 лет Этиология геморрагического васкулита:
а) лекарственная аллергия б) применение сывороток и вакцин в) укусы насекомых г) холодовая аллергия
д) пищевая идиосинкразия (молоко, яйца, земляника и др.)
Инфекционные агенты (чаще b-гемолитический стрептококк группы А, микоплазмы, вирусы) являются лишь разрешающим факто-
ром, а не причинным.
Патогенез геморрагического васкулита: иммунокомплексное воспаление с образованием циркулирующих иммунных комплексов (ЦИК) с IgA отложение ЦИК в микрососудах кожи и внутренних органов
деструктивные и деструктивно-продуктивные микроваскулиты с множественными микротромбозами, увеличение проницаемости сосудистой стенки с выходом из сосудистого русла белков и эритроцитов
Клиническая картина геморрагического васкулита:
а) начало чаще острое, внезапное, с повышением температуры до субфебрильной, слабостью, недомоганием б) кожный синдром – ведущий клинический синдром, присутствующий у всех больных:
-мелкопятнистая (2-3 мм в диаметре) симметричная склонная к слиянию геморрагическая сыпь, легко определяемая визуально и осязаема
-сыпь чаще расположена на разгибательной поверхности верхних и нижних конечностей, на ягодицах, реже – на туловище и практически никогда – на слизистых, усиливается в вертикальном положении
-элементы сыпи исчезают через 2-3 сут после появления
-обычно наблюдаются 2-4 волны высыпаний, поэтому одновременно на коже присутствуют и старые, и свежие элементы (картина пестрого вида)
-сливная пурпура может приводить к образованию геморрагических пузырей, которые затем вскрываются с образованием глубоких эрозий и язв в) суставной синдром – встречается у 2/3 больных, чаще у взрослых:
-симметричное поражение крупных суставов, преимущественно нижних конечностей (коленный, голеностопный) с периартикулярным отеком, болью, ограничение функции, но без костных изменений
-характерно сочетание артрита с миалгией и отеком нижних конечностей
-длительность суставного синдрома 1-2 недели
г) абдоминальный синдром – более, чем у 50% больных, возникает из-за отека и геморрагий в брюшину, стенку кишки (чаще поражается начальный и конечный отделы тонкой кишки, реже наблюдаются геморрагические и язвенно-некротические изменения в толстой кишке, поражение пищевода и желудка):
-внезапное появление интенсивных болей в животе по типу кишечной колики, локализующихся в мезогастрии, схваткообразных, иногда сопровождающихся тошнотой, рвотой (в том числе и кровавой)
-может развиться типичное желудочно-кишечное кровотечение с дегтеобразным стулом
-осложнения: инвагинация (чаще у детей), кишечная непроходимость, перфорация с перитонитом
-длительность абдоминального синдрома от суток до 10
д) почечный синдром – у 10-50% больных, чаще у взрослых:
- гломерулонефрит обычно присоединяется в первые 4-6 недель после начала заболевания
88
-ведущие проявления – изолированная макрогематурия или ее сочетание с умеренной протеинурией; нефротический синдром и АГ нехарактерны
-при персистирующей гематурии и протеинурии возможно развитие ХПН
е) легочной синдром - капиллярит межальвеолярных перегородок с кровоизлияниями в альвеолы:
-кашель со скудным количеством мокроты, кровохарканье, одышка
-несоответствие скудной аускультативной картины степени рентгенологических изменений (множественные инфильтраты в средних и нижних отделах)
-иногда – геморрагический плеврит
ж) поражение сердца - геморрагический перикардит, кровоизлияния в эндокард, на ЭКГ возможны инфарктные изменения з) поражение ЦНС - приступообразные головные боли, головокружения, плаксивость, раздражительность, при отеке оболочек – менингеальные симптомы, эпилептиформные припадки и др.
Клинические варианты геморрагического васкулита:
а) молниеносная форма – смерть через несколько дней от инсульта или кишечного кровотечения б) острая форма – от нескольких недель до нескольких месяцев; в исходе - выздоровление или рецидивирующее течение
в) рецидивирующее течение – характерны рецидивы с периодами ремиссии различной продолжительности (от нескольких месяцев до года и более)
Диагностика геморрагического васкулита:
1. Лабораторные данные неспецифичны:
а) ОАК: умеренный лейкоцитоз со сдвигом влево, повышение СОЭ (при абдоминальной форме и особенно при ГН); нередко эозинофилия до 10-15%; тромбоциты в норме б) ОАМ: гематурия, протеинурия (при ГН)
в) БАК: диспротеинемия в острый период за счет повышения IgA
г) положительный анализ кала на скрытую кровь при абдоминальном синдроме 2. Инструментальные исследования:
а) биопсия кожи и ее иммуногистохимическое исследование – периваскулярные лейкоцитарные инфильтраты, отложение ІgAсодержащих иммунных комплексов б) ФГДС – выявление эрозий в пищеводе, желудке, ДПК и др.
Лечение:
1.Постельный режим, ограничение приема экстрактивной, соленой, острой пищи
2.Основной метод лечения - гепаринотерапия: 300 ед/кг/сут п/к (дозу равномерно распределить на несколько введений через каждые 4-6 часов); контроль – тромбиновое время (оптимально) или время свертывания (менее чувствительный показатель), необходимо добиться их удлинения в 2 раза
3.При недостатом эффекте гепарина:
а) для восполнения антитромбина III – СЗП по 300-400 мл в/в
б) никотиновая кислота 0,1% - 1 мл (1 амп) в физ. р-ре в/в капельно медленно для стимуляции фибринолиза в) дезагреганты – пентоксифиллин/трентал 2% р-р 5 мл на 200 мл физ. р-ра в/в капельно
г) лечение воспаления – НПВС, короткие курсы ГКС, при быстропрогрессирующем ГН - пульс-терапия метилпреднизолоном по 1000 мг/сут в/в в течение 3 дней д) при высоком уровне ЦИК, длительном упорном течении васкулита – плазмаферез, иммунодепрессанты
64. Гемофилия: этиология, патогенез, клинические проявления, диагностика, лечение.
Наследственные коагулопатии — генетически обусловленные нарушения в системе свертывания крови, связанные с дефицитом или молекулярными аномалиями плазменных факторов свертывания и участвующих в этом процессе компонентов калликреинкининовой системы; 97% всех наследственных коагулопатий – гемофилии.
Структура гемофилий:
а) гемофилия А (85-90%) – коагулопатия, в основе которой лежит дефицит коагуляционной части плазменного фактора свертывания VIII - VIII:C (антигемофильного глобулина А) или его молекулярные изменения
б) гемофилия В / болезнь Кристмаса (6-13%) – коагулопатия, в основе которой лежит дефицит активности фактора IX (плазменного компонента тромбопластина)
в) гемофилия С / болезнь Розенталя (0,3-0,5%) – коагулопатия, в основе которой лежит дефицит свертывающего фактора ХI (участвует во внутреннем пути активации свертывания крови)
Этиология гемофилий: наследственные заболевания (гемофилии А и В наследуются по Х-рецессивному типу – болеют преимущественно мужчины, гемофилия С наследуется аутосомно – болеют и мужчины, и женщины).
Патогенез: дефицит факторов свертывания крови приводит к увеличению времени свертывания цельной крови и развитию геморрагического синдрома (гематомный тип кровоточивости).
Тяжесть гемофилии определяется активностью фактора свертывания в крови: а) легкая форма – активность более 5% б) среднетяжелая форма – активность 3-5% в) тяжелая форма – активность 1-2%
г) крайне тяжелая форма – активность менее 1% Клинические проявления гемофилий:
-заболевание обычно начинается в детском возрасте, болеют преимущественно мальчики (кроме гемофилии С); легкая форма гемофилии может начинаться в юношеском возрасте
-первые симптомы – кровоточивость при мелких травмах слизистых оболочек
-характерно чередование периодов повышенной кровоточивости и относительного благополучия
-кровоточивость по гематомному типу:
а) обильные и длительные кровотечения после любых, даже незначительных, травм и операций (экстракция зуба, прикус губы и языка и др.)
б) гемартрозы крупных суставов конечностей при незначительных травмах (ухудшение общего самочувствия, повышение температуры, сильнейшие боли, гиперемированная, напряженная, горячая на ощупь кожа); рецидивирование острых гемартрозов приводит к хроническим геморрагически-деструктивным остеоартрозам, заканчивающихся деформацией и ограничением подвижности, гипотрофией мышц
в) крупные межмышечные, внутримышечные, поднадкостничные, забрюшинные гематомы, вызывающие деструкцию окружающих тканей (гемофилические псевдоопухоли), приводящие к нарушению подвижности в суставах при сдавлении гематомой нервных стволов, сухожилий, мышц
г) ретробульбарные гематомы при травме глаза с потерей зрения д) кровоизлияния в головной и спинной мозг е) упорные почечные кровотечения (в 30% случаев)
ж) желудочно-кишечные кровотечения и склонность к язвообразованию з) отсроченные (т.е. возникающие через 1-5 часов) кровотечения после травм и операций
89

- анемический синдром (слабость, бледность, головокружение и т.д.) при длительных кровотечениях Диагностика гемофилии:
1.ОАК: при обширных гематомах и кровотечениях – постгеморрагическая анемия различной степени выраженности; нормальное количество тромбоцитов
2.Коагулограмма: длительность кровотечения – в норме (2,0-7,5 мин); ретракция кровяного сгустка не нарушена;
общее время свертывания крови в пробирке удлинено (в норме – 5-7 минут), АЧТВ удлинено (наиболее важный показатель для гемофилии, связанный с VIII, IX и XI факторами, в норме – 35-40 сек), протромбиновое время (характеризует процесс свертывания при запуске его по внешнему механизму) - в норме (11-14 сек) и тромбиновое время (характеризует состояние конечного этапа процесса свертывания) – в норме (14-16 сек).
3. БАК: снижение активности факторов свертывания крови (VIII, IX или XI в зависимости от типа гемофилии) Лечение гемофилии:
1. Первоочередная задача – заместительная терапия гемопрепаратами, однако она сопровождается рядом осложнений: а) перенос инфекции (ВИЧ, гепатит В, С)
б) пирогенные и аллергические реакции в) образование ингибитора к необходимому фактору свертывания (!)
г) перенос невирусных патогенов (прионов – трансмиссионных спонгиформных энцефалопатий: болезнь Крейтцфельда-Якоба и ее варианты, бычий спонгиформный энцефалит).
д) объемная перегрузка (только криопреципитатат и СЗП) е) гемолиз и др.
Выделяют 3 поколения препаратов заместительной терапии: I поколение - криопреципитат и свежезамороженная плазма (СЗП)
II поколение – концентраты плазматических факторов свертывания низкой и средней степени чистоты
III поколение – концентраты плазматических факторов свертывания высокой степени чистоты, рекомбинантные факторы (рекомбинантный и моноклональный очищенный фактор VIII; моноклональный очищенный фактор IX).
Необходимые дозы факторов при кровотечениях у гемофиликов:
Клиническая активность |
|
VIII |
|
IX |
|
Легкие кровоизлияния в суставы или мягкие |
20 |
ед/кг 1 раз в сутки |
40 |
ед/кг 1 раз в сутки |
|
ткани |
|||||
|
|
|
|
||
Тяжелые кровоизлияния в суставы или мяг- |
40 |
ед/кг 1 раз, затем по 20 ед каждые |
80 |
ед/кг 1 раз, затем по 40 ед каждые |
|
кие ткани |
12 |
ч |
12 |
ч |
|
“Compartment”-синдром (синдром повышен- |
40 |
ед/кг 1 раз, затем по 20 ед каждые |
80 |
ед/кг 1 раз, затем по 40 ед каждые |
|
ного внутрифасциального давления при суб- |
|||||
12 |
ч до разрешения |
12 |
ч до разрешения |
||
фасциальных гематомах) |
|||||
|
|
|
|
||
Рваная рана со швами |
20 |
ед/кг 1 раз при наложении швов, |
40 |
ед/кг 1 раз при наложении швов, |
|
затем через день до снятия швов |
затем через день до снятия швов |
||||
|
|||||
Чистка и пломбирование зубов |
20 |
ед/кг 1 раз в день и т.д. |
40 |
ед/кг 1 раз в день и т.д. |
|
Все антигемофильные препараты вводят в/в струйно сразу после их расконсервирования! Период полураспада фактора VIII - 12 ч., при гемофилии А его вводят 2 раза/сут; период полураспада фактора IX – 24 ч, при гемофилии В его вводят 1 раз/сут. Антигемофильные препараты нельзя разводить, вводить в/в капельно с другими кровезаменителями (т.к. снижается их концентрация за счет разведения)!!!
2.Вследствие заместительной терапии возможно образование ингибитора VIII фактора – нейтрализующих IgG (примерно у 15% больных с тяжелой гемофилией А и у 4% – с гемофилией В); уровень ингибитора определяется по уровню VIII фактора, оставшегося в нормальной плазме после 2 часов инкубации с плазмой больного, и измеряется в единицах Бетезды (ЕБ):
- низкий титр ингибитора (10 ЕБ и менее) – показано повышение количества вводимого фактора
- высокий титр ингибитора (40 ЕБ и выше) – показан плазмаферез (для удаления IgG) + большая доза вводимого фактора + ГКС (преднизолон до 4-6 мг/кг/сут)
3.Другие препараты для лечения гемофилий:
а) десмопрессин в/в взрослым 1–4 мкг/сут, детям - 0,4 мкг/сут - увеличивает концентрацию VIII фактора на 300-400% через 5 часов после введения б) препарат протромбинового комплекса (ППСБ, аутоплекс, фейба), активированный протромбиновый комплекс (АППСБ) – содер-
жат несколько плазменных факторов свертывания (II, IX, X).
4. Остановка кровотечений: аминокапроновая кислота по 4-12 г/сут в 6 приемов или другие ингибиторы фибринолиза (памба – аминометилбензойная кислота, трансамча – транексамовая кислота) + местная гемостатическая терапия (аппликации на кровоточащую поверхность гемостатической губки, примочек с раствором тромбина, аминокапроновой кислоты и др.)
5. Лечение гемартрозов:
а) заместительная терапия в остром периоде (начать как можно быстрее) б) постельный режим 5-7 дней
в) при выраженных кровоизлияниях: пункция сустава с аспирацией крови и введением в его полость ГКС г) иммобилизация пораженной конечности на 3-4 дня, затем – ЛФК и физиотерапия (под прикрытием заместительной терапии)
65. Лифмогранулематоз: клинические проявления, диагностика, принципы лечения.
Лифогранулематоз (ЛГМ, лимфома Ходжкина) - злокачественная лимфоидная опухоль, характеризующаяся гиперплазией лимфоидной ткани с образованием в л.у. и внутренних органах лимфогранулем, содержащих многоядерные гигантские клетки Березовского - Штернберга – Рид.
Морфологическая классификация ЛГМ:
1)вариант с лимфоидным преобладанием (7-10%) – в пораженных структурах большое количество неопухолевых лимфоцитов и гистиоцитов и единичные клетки Березовского-Штернберга – Рид (БШР) и Ходжкина; имеет более латентное и благоприятное течение
2)вариант с нодулярным склерозом (30-45%) – в пораженных структурах плотные фиброзные перемычки, разделяющие скопления клеток реактивного воспаления и клеток БШР и Ходжкина, лимфоцитов меньше; чаще развивается у молодых женщин
3)смешанно-клеточный вариант (30-50%) – самый частый вариант, в пораженных структурах обнаруживаются клетки БШР в значительном количестве и клетки гетерогенной популяции реактивного воспаления
4)вариант с лимфоидным истощением (7-10%) – развивается редко, чаще у пожилых, в пораженных структурах много гигантских анаплазированных (т.е. с разными ядрами, множеством ядрышек разной величины и цвета) клеток Ходжкина, количестве лимфоцитов уменьшено, есть диффузный фиброз и очаги некроза
Клинические проявления ЛГМ:
а) поражение л.у. и других лимфоидных органов:
90
-поражение периферических л.у. (90%) – наиболее часто шейно-надключичных (70%), реже подмышечных, паховых и др.; пораженные л.у. множественные, различных размеров (до 5 см в диаметре и более), округлые, плотные, чаще безболезненные, образуют конгломераты, изменяя форму шеи
-часто массивное поражение медиастинальных л.у. (15%) – тень средостения расширяется более, чем на 2/3 от поперечника грудной клетки
-реже – поражения других групп л.у. (забрюшинных и др.)
б) органное поражение: селезенки (25%), легких (20-30%), печени (10-12%), костного мозга (10-12%), костей (14-20%), реже
– кожи, ЦНС, ЖКТ, щитовидной железы, молочной желез, тимуса в) общие симптомы (46%): профузные ночные поты, температура тела свыше 38º С не менее 3 дней подряд при отсутствии
реактивного воспаления, похудание более чем на 10% за последние 6 мес Клиническая классификация ЛГМ:
1 стадияпоражение 1 группы л.у. или 1 экстралимфатического органа 2 стадия - поражение 2 и > групп л.у. по одну сторону от диафрагмы или локальное поражение экстралимфатического органа с наличием или отсутствием поражения л.у. по ту же сторону диафрагмы
3 стадия – поражение л.у. по обе стороны от диафрагмы ± поражение селезенки ±поражение одного экстралимфатического органа 4 стадиядиффузное или диссеминированное поражение экстралимфатических органов или поражение экстралимфатического органа±поражение нерегионарных л\у В каждой стадии выделяют подстадию А – отсутствие общих симптомов и В – наличие одного или нескольких из вышеперечисленных общих симптомов.
Диагностика:
1)первичная диагностика: ОАК (характерны лейкоцитоз, абсолютный нейтрофиллез с сдвигом влево, умеренная эозинофилия, лимфоцитопения, ускоренное СОЭ, могут быть лейкопения, тромбоцитоз или тромбоцитопения, нормохромная анемия), БАК (повышение ЛДГ, гаптоглобина, церуллоплазмина, альфа-2-глобулина, фибриногена, целочной фосфатазы), рентгенография легких в двух проекциях, УЗИ органов брюшной полости, пункционная и эксцизионная биопсия (для морфологической верификации диагноза)
2)уточняющая диагностика: КТ грудной и брюшной полости, стернальная пункция, трепан-биопсия подвздошной кости, скелетография, сцинтиграфия костей с Tс99m, сцинтиграфия лимфоузлов с Ga67, лапаротомия со спленэктомией и др.
Прогностические факторы неблагоприятного исхода:
-стадия заболевания (наиболее неблагоприятны Б-варианты)
-формы лимфоидного истощения и смешанно-клеточный вариант
-массивность поражения (размеры периферических л.у. >10см, увеличение средостения >1/3 диаметра грудной клетки, поражение 3 и более зон л.у., экстранодальные поражения, наличие 4 и более очагов или диффузное поражение селезенки)
-СОЭ >30 мм/ч в В-подстадии и >50 мм/ч в А-подстадии
-возраст старше 60 лет
-мужской пол
-вовлечение костного мозга
Принципы лечения ЛГМ.
- комбинированное химиолучевое лечение в 3 этапа: 1-ый этап: полихимиотерапия (ПХТ)
2- ой этап: лучевая терапия (общая доза 30-40 Гр) 3-ий этап: полихимиотерапия
ПХТ 1-ой линии: схема ABVD (адриамицин / доксорубицин, блеомицин, винбластин, дакарбазин) и др. схемы (DOPP+АБ, MOРР, COPP+АБ), 2-ой линии: CEP, IEP. Лечение проводится 2-х недельными циклами с 2-х недельными перерывами, всего 3-6 курсов, затем – лучевая терапия - при наличии неблагоприятных прогностических факторов лечение интенсифицируется:
а) сокращаются интервалы между кусами лечения или проводится непрерывная ПХТ с облучением в сниженных дозах зон массивного исходного поражения и/или остаточных опухолевых масс б) применяются колониестимулирующие факторы Г-КСФ, ГМ-КСФ
в) используется высокодозная ПХТ под защитой аутотрансплантации костного мозга или стволовых клеток Выживаемость больных при ЛГМ: полная ремиссия 60-90%, 20-летняя выживаемость у больных с полной ремиссией >60% (большинство редицивов возникает на протяжении 3-4 лет).
БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВ И ЭНДОКРИННОЙ СИСТЕМЫ
66. Классификация и диагностика сахарного диабета.
Сахарный диабет (СД) – эндокринное заболевание, характеризующееся синдромом хронической гипергликемии, являющейся следствием недостаточной продукции или действия инсулина, что приводит к нарушению всех видов обмена веществ, прежде всего углеводного, поражению сосудов (ангиопатии), нервной системы (нейропатии), а также других органов и систем.
Классификация сахарного диабета:
А. Этиологическая:
I. Сахарный диабет 1 типа (инсулинзависимый):
1)аутоиммунный
2)идиопатический
II. Сахарный диабет II типа (инсулиннезависимый)
III. Другие специфические типы (вторичный, или симптоматический, сахарный диабет):
1)генетические дефекты b-клеточной функции (MODY-1, 2, 3, митохондриальная мутация ДНК и др.)
2)генетические дефекты в действии инсулина (резистентность к инсулину типа А, лепречаунизм, синдром Рабсона-Мен- денхолла, липоатрофический диабет)
3)болезни экзокринной части поджелудочной железы (панкреатит, травма/панкреатэктомия, неоплазии, кистозный фиброз, гемохроматоз, фиброкалькулезная панкреатопатия)
4)эндокринопатии (акромегалия, синдром Кушинга, глюкагонома, феохромоцитома, тиреотоксикоз, соматостатинома, альдостерома)
5)СД, индуцированный лекарствами и химикатами (никотиновая кислота, ГКС, тиреоидные гормоны, диазоксид, агонисты альфа-адренорецепторов, тиазиды, альфа-интерферон и др.)
6)инфекции (врожденная краснуха, цитомегаловирус)
7)необычные формы иммуноопосредованного диабета (аутоантитела к рецептору инсулина и др.)
8)другие генетические синдромы, иногда сочетающиеся с СД (синдромы Дауна, Клайнфелтера, Тернера, хорея Гентингтона, порфирия и др.)
IV. Гестационный сахарный диабет.
Б.По степени тяжести: 1) легкая (I степень); 2) средняя (II степень); в) тяжелая (III степень)
В. По состоянию компенсации: 1) компенсированный; 2) субкомпенсированный; 3) декомпенсированный
91
Г. Острые осложнения диабета: 1) кетоацидотическая кома; 2) гиперосмолярная кома; 3) лактацидотическая кома; 4) гипогликемическая кома Д. Поздние осложнения диабета: 1) микроангиопатии (ретинопатия, нефропатия); 2) макроангиопатия; 3) нейропатия
Диагностика сахарного диабета:
1)БАК: гликемия капиллярной крови натощак > 6,1 ммоль/л, через 2 часа после нагрузки глюкозой (75 г глюкозы в 200 мл воды) > 11,1 ммоль/л; экспресс-методы определения глюкозы крови (индикаторные полоски – декстростикс, рефлотест с ферментом глюкозооксидазой;1 каплю крови наносят на индикатор, через 2 мин промывают его водой, просушивают фильтровальной бумагой и помещают в рефлектометр, на табло которого регистрируется уровень гликемии в ммоль/л).
При нарушенной толерантности к глюкозе гликемия капиллярной крови натощак > 6,1 ммоль/л, через 2 часа после нагрузки глюкозой 7,8-11,1 ммоль/л
2)тест на толерантность к глюкозе – проводится при неясном или сомнительном диагнозе заболевания; в течение 3 дней обследуемый должен потреблять по 130-150 г/сут углеводов, а до проведения пробы должен голодать в течение 10-14 ч; у обследуемого берут капиллярную кровь из пальца для определения исходного уровня гликемии, после чего он выпивает 75 г глюкозы, растворенной в 250-300 мл воды, в течение 5-15 минут; через 2 ч после приема глюкозы берут вторую пробу
3)ОАМ: уровень глюкозурии (в моче здоровых глюкозы нет, т.к. она реабсорбируется в канальцах почек) – качественные (проба Ниландера – к 2-3 мл фильтрованной мочи прибавляют 2-3 мл реактива, состоящего из висмута нитрата, сегнетовой соли и едкого натра, полученную смесь кипятят 2 мин; при наличии глюкозы вся жидкость окрашивается в черный цвет; глюкозооксидазная проба с использованием индикаторных полосок желтого цвета биофан, клинистикс; при наличии глюкозы бумажка окрашивается в синий цвет) и количественные (определение глюкозурии колориметрически; полоски «Глюкотест» или таблетки «Клинитест», «клинистикс»; в пробирку помещают 5 капель мочи, 10 капель воды и 1 таблетку «Клинитест»; под влиянием содержащихся в таблетке реактивов содержимое пробирки «закипает»; через 15 секунд после прекращения «кипения» оценивают окраску; если глюкозы в моче нет, содержимое пробирки синего цвета, при наличии ее не более 5 г/л - темно-зеленого,10 г/л - салатного, 20 г/л - рыжего, более 20 г/л – коричневого).
4)определение ацетона в моче – проба Ланге (несколько капель свежеприготовленного раствора натрия нитропруссида и 0,5 мл концентрированной уксусной кислоты добавляют в пробирку с 8-10 мл мочи, а затем осторожно по стенке пробирки наслаивают несколько мл концентрированного р-ра аммиака; при наличии ацетона на границе между обоими жидкостями в течение 3 мин возникает фиолетовое кольцо); индикаторные таблетки или полоски;
5)иммунорадиологическое определение С-пептида в крови – С-пептид секретируется и поступает в кровь в эквимолярных соотношениях с инсулином и в отличие от последнего не подвергается разрушению в печени, поэтому по уровню С-пептида в крови можно судить о количестве секретируемого инсулина (норма для мужчин 1,5-5,0 мкг/л, для женщин – 1,4-5,5 мкг/л)
6)определение гликозилированного гемоглобина – показателя содержания глюкозы в эритроцитах, повышение которого свидетельствует о эпизодах гипергликемии за последние 3 мес (норма – 4-6% от общего гемоглобина)
7)определение в крови фруктозамина – гликозилированного белка, отражающего уровень гликемии за последние 1-3 недели (норма 2,0-2,8 ммоль/л, при СД значительно повышается), реже – других гликозилированных белков (гликозилированного альбумина – отражает уровень гликемии за предыдущие 7 дней, гликозилированного фибриногена – отражает уровень гликемии за предыдущие 4 дня и др.)
8)определение содержания ферритина и трансферрина в сыворотке крови – при СД повышен ферритин и снижен трансферрин
67. Этиология, патогенез, диагностика, лечение сахарного диабета 1 типа (ИЗСД).
Инсулинзависимый СД (СД 1 типа) – СД аутоиммунного генеза, развивающийся при наследственной предрасположенности к нему под действием провоцирующих факторов внешней среды (вирусной инфекции, цитотоксических веществ и др.).
Этиология ИЗСД:
1) наследственность: СД 1 типа – полигенное заболевание, в основе которого лежат по меньшей мере 2 мутантных диабетических гена в 6-ой хромосоме, передающихся рецессивно, связанных с HLA-системой (наиболее часто с DR3, DR4, B8, B15) и определяющих предрасположенность к аутоиммуному поражению инсулярного аппарата или повышенную чувствительность b-клеток к вирусным
антигенам.
2) вирусная инфекция (наиболее часто это вирусы краснухи, Коксаки В, гепатита В, эпидемического паротита, инфекционного мононуклеоза, гриппа, цитомегаловирус) – провоцирует развитие ИЗСД, т.к. существуют общие антигенные эпитопы для b-клеток и панкреатогенных вирусов (молекулярная мимикрия), что способствует аутоиммунным повреждениям инсулярного аппарата.
Патогенез ИЗСД.
1) Копенгагенская модель деструкции b-клеток:
а) АГ панкреатотропных факторов (вирусы, цитотоксины и др.), поступающие в организм, повреждают b-клетки, способствуя высвобождению их антигенов, а также связываются с HLA АГ локуса D с образованием комплекса на поверхности макрофагов, которые становятся антиген-презентирующими клетками б) антиген-презентирующие клетки секретируют ИЛ-1, который вызывает:
-пролиферацию Т-хелперов и секрецию ими лимфокинов ( -ИФН, ФНО ), участвующих в деструкции b-клеток
-увеличение проницаемости капилляров
-экспрессию АГ HLA I и II классов на b-клетках с последующим превращением их в аутоантигены
2)Лондонская модель деструкции b-клеток – повреждение b-клеток запускается взаимодействием внешнего АГ с макрофагом
(по механизмам Копенгагенской модели), затем при высокой концентрации ИЛ-1 под влиянием
-ИФН и ФНО на b-клетках индуцируется экспрессия аберрантных (не свойственных норме) АГ DR3 и DR4 с превращением b-кле-
ток в аутоантигены; островки Лангерганса инфильтрируются Т-хелперами, макрофагами, плазматическими клетками, продуцирующими большое количество цитокинов, развивается выраженная иммуновоспалительная реакция с участием цитотоксических Т-лим- фоцитов и натуральных киллеров, что и приводит к деструкции b-клеток.
Стадийность развития СД 1 типа:
1-ая стадия – наличие генетической предрасположенности к ИЗСД благодаря определенным HLA АГ.
2-ая стадия – инициация аутоиммунных процессов в b-клетках островков под влиянием панкреатотропных вирусов и цитотоксинов 3-ая стадия – активные иммунологические процессы с образованием АТ к b-клеткам и инсулину
4-ая стадия – прогрессивное снижение секреции инсулина, стимулированного глюкозой
5-ая стадия – клинически явный диабет (манифестация СД); развивается при деструкции 85-90% b-клеток 6-ая стадия – полная деструкция b-клеток, полное отсутствие секреции инсулина и С-пептида.
Нарушения метаболизма при СД и патофизиология основных клинических проявлений:
а) углеводный обмен – инсулин активирует: поступление глюкозы в клетки; ключевые ферменты аэробного гликолиза и пен- тозо-фосфатного цикла, необходимого для синтеза нуклеиновых кислот; НАДФ*Н2, используемый для синтеза стероидных гормонов, холестерина, жирных кислот, активирования фолиевой кислоты; гликогенсинтетазу; инсулин подавляет: превращение глюкозо-6-фосфата в глюкозу; глюконеогенез; фосфорилазу, сти-
мулирующую распад гликогена; сорбитоловый шунт; глюкуронатный путь обмена углеводов; синтез гликопротеинов; образование гликозилированного гемоглобина и других гликозилированных белков.
Нарушение углеводного обмена:
92
1)поступление глюкозы в клетку инсулинзависимых тканей активности ключевых ферментов аэробного гликолиза нарушение образования энергии гипоксия клеток гликогенолиза, глюконеогенеза, превращения глюкозо-6-фосфата в глюкозу гипергликемия, глюкозурии полиурия (из-за высокой осмолярности мочи) с потерей электролитов, жажда, обезвоживание, мышечная слабость, полифагия (из-за энергетодефицита)
2)активация инсулин-независимых путей метаболизма глюкозы:
а) сорбитолового – глюкоза под влинием альдозредуктазы восстанавливается в сорбитол, который под влиянием сорбитолдегидрогеназы превращается во фруктозу, метаболизирующуюся по пути гликолиза; при дефиците инсулина нарушается работа инсулинзависимой сорбитолдегидрогеназы и избыточное количество высокоосмотического сорбитола накапливается в хрусталике, нервных волокнах, сетчатке
б) глюкуронатного – в норме глюкоза через уридиндифосфаттлюкозу превращается в глюкуроновую кислоту, а также используется для синтеза гликогена; т.к. при СД использование уридиндифосфатглюкозы для синтеза гликогена уменьшено, резко увеличивается синтез глюкуроновой кислоты и гликозаминогликанов (один из механизмов развития ангиопатий)
в) гликопротеинового – при СД интенсивно синтезируются гликопротеины (способствуют ангиопатиям)
б) белковый обмен - инсулин активирует: биосинтез белка, рибонуклеотидов (АТФ, креатинфосфата), транспорт аминокислот внутрь клетки с последующим их включением в белки; синтез циклических нуклеотидов (цАМФ, цГМФ); биосинтез цитоплазматических и ядерных нуклеиновых кислот (ДНК, РНК); инсулин подавляет распад белков (антикатаболический эффект)
Нарушения белкового обмена:
1)снижение активности пентозного цикла метаболизма глюкозы с нарушением синтеза белков
2)усиление катаболизма белка и истощение его запасов из-за интенсивных процессов глюконеогенеза
3)гликозилирование белков, особенно гемоглобина, который очень прочно связывает в этом состоянии кислород и трудно отдает его тканям гипоксия базальных мембран сосудов ангиопатии и др.
в) жировой обмен – инсулин активирует: поступление глюкозы в адипоциты; образование из глюкозы жирных кислот и глицерофосфата; образование глицерина; синтез триглицеридов (липогенез); инсулин подавляет липолиз (антилиполитический эффект)
Нарушения жирового обмена:
нарушение синтеза жиров, увеличение процессов липолиза с образованием большого количества жирных кислот (из-за дефицита инсулина и угнетения пентозного цикла метаболизма глюкозы):
а) жирные кислоты поступают в печень, вызывая ее жировую нифильтрацию б) избыток жирных кислот превращается в кетоновые тела (β-оксимасляная и ацетоуксусная кислоты), не успевающие
сгорать в цикле Кребса кетонемия, кетонурия, запах ацетона изо рта в) жирные кислоты через повышенное образование ацетил-КоА способствует повышенному синтезу ХС
г) обмен электролитов – инсулин активирует поступление калия в клетку и угнетает поглощения натрия клеткой. Диагностика ИЗСД: см. вопрос 74.
Лечение СД 1 типа:
1.Обучение больного в «Школе диабета» соблюдению необходимой диете и методам определения содержания глюкозы в крови с помощью тест-полоски или глюкометра, глюкозы и кетоновых тел в моче; больной обучается самопомощи при гипогликемии, а также получает рекомендации по использованию дозированной физической нагрузки
2.Обучение больного технике введения инсулина и заместительная терапия препаратами инсулина (препараты выбора – инсулин человеческий генноинженерный или рекомбинантный).
Рекомендуемый режим инсулинотерапии – базис-болюсный - инсулин средней продолжительности или продленного действия дважды в день - перед завтраком около 2/3 суточной дозы и перед сном около 1/3 суточной дозы для создания базального уровня инсулина + перед каждым основным приемом пищи инсулин короткого действия для имитации пиковой секреции инсулина в ответ на прием пищи. Режим введения инсулина подбирается индивидуально с целью обеспечения оптимального метаболического контроля.
Могут использоваться следующие режимы инсулинотерапии:
1)инсулин короткого действия и средней продолжительности действия перед завтраком и ужином
2)инсулин короткого действия - перед завтраком, обедом и ужином; инсулин средней продолжительности действия – перед завтраком и ужином
3)инсулин короткого действия - перед завтраком, обедом и ужином; инсулин средней продолжительности действия – перед завтраком и на ночь (в 22 часа)
4)инсулин короткого действия - перед завтраком, обедом и ужином; инсулин средней продолжительности действия – на ночь (в 22 часа)
Доза инсулина подбирается индивидуально под контролем гликемического профиля (средняя суточная потребность в инсулине у взрослых 40-60 ЕД, в среднем 0,6-0,8 ЕД/кг массы тела). Однако в первый год заболевания может развиться ремиссия СД, сопровождающаяся временным резким снижением потребности в экзогенном инсулине («медовый месяц диабетика»)!
Дозу пролонгированного инсулина рассчитывают исходя из потребности в базисном инсулине примерно 1 ЕД в час, что в сутки составляет 24-28 ЕД; это количество пролонгированного инсулина вводят обычно в два приема: около 2/3 указанной суточной дозы перед завтраком и около 1/3 суточной дозы – перед сном. Инсулин короткого действия вводят из расчета уровня гликемии и предполагаемого количества потребленных углеводов (хлебных единиц) в каждый прием пищи; 1 ЕД инсулина снижает уровень гликемии примерно на 2,22 ммоль/л, а 12 г глюкозы (50 ккал) повышают его на 2,77 ммоль/л; при расчете дозы инсулина короткого действия, вводимого перед большими приемами пищи, учитывают, что для усвоения 12 г глюкозы (1 ХЕ) или 50 ккал необходимо 1,4 ЕД инсулина.
Ежедневная коррекция дозы инсулина осуществляется в зависимости от следующих факторов: уровень гликемии в течение суток (профиль); содержание углеводов в каждый прием пищи; уровень и интенсивность физической нагрузки; наличие интеркуррентного заболевания.
Устройства для инъекций инсулина:
а) инъекторы инсулина (шприц-ручки) – необходимы детям, подросткам, беременным, больным с ослабленным зрением и ампутацией нижних конечностей, страдающих сахарным диабетом; концентрация инсулина в картриджах для шприц-ручек 100 ЕД/мл, объем картриджей – 1,5 мл или 3 мл б) одноразовые пластиковые инсулиновые шприцы, калиброванные по концентрации инсулина – у остальных больных
Техника инъекций инсулина:
-инсулин короткого действия вводится за 30 минут до приема пищи, ультракороткого действия – непосредственно перед приемом пищи
-инъекции инсулина короткого действия рекомендуется делать в подкожную клетчатку живота, инсулина средней продолжительности действия – бедер или ягодиц глубоко через широко сжатую кожу под углом 45° (или 90°, если подкожно-жировой слой тол-
ще, чем длина иглы)
- рекомендуется ежедневная смена мест введения инсулина в пределах одной области в целях предупреждения развития липодистрофий.
3. Принципы диеты:
93
-питание должно обеспечивать относительно стабильный гликемический профиль и способствовать хорошему метаболическому контролю
-из повседневного рациона исключаются продукты, содержащие легкоусвояемые углеводы
-суточная калорийность должна покрываться на 55-60% за счет углеводов, на 16-20% – белков и 24-30% – жиров
-в рационе питания должны преобладать продукты с низким содержанием жира, предпочтительнее включать
продукты, содержащие ненасыщенные жирные кислоты (растительные масла)
-оптимально 6 приемов пищи – 3 основных (завтрак, обед, ужин) и 3 дополнительных (второй завтрак, полдник и умеренный прием пищи перед сном)
-необходимо документировать следующие продукты (считать хлебные единицы) – зерновые, жидкие молочные продукты, некоторые сорта овощей (картофель, кукуруза), фрукты 4. Физические нагрузки – строго индивидуальны, необходимо помнить, что:
-физические упражнения повышают чувствительность к инсулину и снижают уровень гликемии, что может приводить к развитию гипогликемий; риск гипогликемий повышается в течение физической нагрузки и в ближайшие 12-40 часов после периода длительных тяжелых физических нагрузок
-при легких и умеренных физических нагрузках продолжительностью не более 1 часа требуется дополнительный прием углеводов до и после занятий спортом (15 г легкоусвояемых углеводов на каждые 40 мин занятий спортом)
-при умеренных физических нагрузках продолжительностью более 1 часа и интенсивном спорте необходимо снижение дозы инсулина, действующего во время и в последующие 6-12 часов после физической нагрузки на 20-50%
-уровень глюкозы в крови нужно измерять до, во время и после физической нагрузки
-при декомпенсированном СД, особенно в состоянии кетоза, физические нагрузки противопоказаны!
68. Этиология, патогенез, клиника, диагностика, лечение, профилактика сахарного диабета 2 типа (ИНСД).
Инсулиннезависимый СД (ИНСД, СД 2 типа) – гетерогенное заболевание, характеризующееся нарушением секреции инсулина и чувствительности периферических тканей к инсулину (инсулинорезистентностью).
Этиология ИНСД:
1)наследственность – дефектные гены (в 11 хромосоме – нарушение секреции инсулина, в 12 хромосоме – нарушение синтеза инсулиновых рецепторов, генетические дефекты в системе узнавания глюкозы β-клетками или периферическими тканями), передающиеся доминантным путем; у обоих однояйцевых близнецов ИНСД развивается в 95-100% случаев.
2)избыточное питание и ожирение – высококалорийная пища с большим количеством легко всасывающихся углеводов, сладостей, алкоголя и дефицитом растительной клетчатки вместе с малоподвижным образом жизни способствуют нарушению секреции инсулина и развитию инсулинорезистентности
Патогенез ИНСД обусловлен нарушениями на трех уровнях:
1.Нарушение секреции инсулина – первый ключевой дефект при ИНСД, выявляемый как на самой ранней, так и на выраженной стадиях заболевания:
а) качественные нарушения – при ИНСД содержание инсулина в крови натощак значительно снижено, преобладает проинсулин
б) кинетические нарушения - у здоровых в ответ на введение глюкозы наблюдается двухфазная секреция инсулина: первый пик секреции начинается сразу после стимуляции глюкозой, заканчивается к 10-ой мин., обусловлен выходом из гранул β- клеток запасенного инсулина; второй пик секреции начинается после 10 мин. при в/в введении или через 30 мин. или позже после перорального приема глюкозы, продолжительный, отражает секрецию вновь синтезированного инсулина в ответ на стимуляцию β- клеток глюкозой; при ИНСД нет первой фазы и сглажена вторая фаза секреции инсулина
в) количественные нарушения – для ИНСД характерна выраженная инсулинопения, обусловленная снижением массы β-клеток островков Лангврганса, отложением в островках депозитов амилоида (синтезируется из амилина, который секретируется β-клетками вместе с инсулином и участвует в превращении проинсулина в инсулин), «глюкозотоксичностью» (хроническая гипергликемия вызывает структурные нарушения островков Лангерганса и снижение секреции инсулина) и др.
2.Инсулинорезистентность периферических тканей:
а) пререцепторная – связана с генетически обусловленной продукцией измененной, неактивной молекулы инсулина или неполной конверсией проинсулина в инсулин
б) рецепторная – связана с уменьшением количества активных инсулиновых рецепторов, синтезом аномально неактивных рецепторов, появлением антирецепторных АТ.
в) пострецепторная – снижение активности тирозинкиназы инсулинового рецептора, уменьшение числа транспортеров глюкозы (белков на внутренней поверхности клеточной мембраны, обеспечивающих транспорт глюкозы внутри клетки), В развитии инсулинорезистентности имеет также значение циркуляция в крови антагонистов инсулина (АТ к инсулину, контринсулярные гормоны: соматотропин, кортизол, тиреоидные гормоны, тиреотропин, пролактин, глюкагон, КА).
3. Повышение продукции глюкозы печенью – обусловлено усилением глюконеогенеза, подавлением продукции глюкозы печенью, нарушение циркадного ритма образования глюкозы (отсутствие снижения продукции глюкозы ночью) и др.
Клинические проявления ИНСД:
1. Субъективно характерны следующие жалобы:
-выраженная общая и мышечная слабость (в связи с дефицитом образования энергии, гликогена и белка в мышцах)
-жажда - в периоде декомпенсации СД больные могут выпивать 3-5 л и больше в сутки; чем выше гипергликемия, тем больше выражена жажда; сухость во рту (из-за обезвоживания и снижения функции слюнных желез)
-частое и обильное мочеиспускание как днем, так и ночью
-ожирение – часто, но не всегда
-повышение аппетита
-зуд кожи – особенно у женщин в области гениталий
2. Объективно состояние органов и систем:
а) кожные покровы:
-сухость кожи, снижение тургора и эластичности
-гнойничковые поражения кожи, рецидивирующий фурункулез, гидроаденит, эпидермофития стоп
-ксантомы кожи (папулы и узелки желтоватого цвета, наполненные липидами, расположенные в области ягодиц, голеней, коленных и локтевых суставов, предплечий) и ксантелазмы (желтые липидные пятна на коже век)
-рубеоз – расширение кожных капилляров с гиперемией кожи в области скул и щек (диабетический румянец)
-липоидный некробиоз кожи – чаще на голенях; вначале появляются плотные красновато-коричневые или желтоватые узелки или пятна, окруженные эритематозной каймой из расширенных капилляров; кожа над ними постепенно атрофируется, становится гладкой, блестящей, с выраженной лихенизацией («пергаментная»); иногда пораженные участки изъязвляются, очень медленно заживают, оставляя после себя зоны пигментации
б) пищеварительная система:
-прогрессирующий кариес
-парадонтоз, расшатывание и выпадение зубов
94
-альвеолярная пиорея, гингивит, язвенный или афтозный стоматит
-хронический гастрит, дуоденит с постепенным развитием атрофии, снижением секреции желудочного сока; снижение моторной функции желудка вплоть до гастропарезов
-нарушение функции кишечника: диарея, стеаторея, синдром мальабсорбции
-жировой гепатоз печени, хронический калькулезный холецистит, дискинезии желчного пузыря и др.
в) сердечно-сосудистая система:
-раннее развитие атеросклероза и ИБС с различными осложнениями (ИМ с СД может протекат без боли – синдром кардиальной гипестезии Прихожана, чаще бывает трансмуральным, тяжело протекает, сопровождается различными осложнениями)
-артериальная гипертензия (часто вторичная из-за нефроангиопатий, атеросклероза почечных артерий и др.)
-«диабетическое сердце» – дисметаболическая миокардиодистрофия
г) дыхательная система:
-предрасположенность к туберкулезу легких с тяжелым течением, частыми обострениями, осложнениями
-частые пневмонии (из-за микроангиопатий легких)
-частые острые бронхиты и предрасположенность к развитию хронического бронхита
д) мочевыделительная система: предрасположенность к инфекционно-воспалительным заболеваниями мочевыводящих путей (циститам, пиелонефритам) и др.
Диагностика ИНСД: см. вопрос 74.
Лечение ИНСД: 1. Диета – должна соответствовать следующим требованиям:
-быть физиологической по составу и соотношению основных ингридиентов (60% углеводов, 24% жиров, 16% белков), покрывающей все энергетические затраты в зависимости от степени физической активности и обеспечивающей поддержание нормальной «идеальной» массы тела; при избытке массы тела показана гипокалорийная диета из расчета 20-25 ккал на 1 кг массы тела/сут
-прием пищи 4-5-кратный со следующим распределением между приемами калорийности суточного рациона: 30% – на завтрак, 40% – на обед, 10% – на полдник, 20% – на ужин
-исключить легкоусвояемые углеводы, прием алкоголя, увеличить содержание растительной клетчатки
-ограничить жиры животного происхождения (40-50% жиров должны быть растительные)
Диета в виде монотерапии проводится до тех пор, пока на фоне ее применения удается поддерживать полную компенсацию сахарного диабета.
2. Снижение массы тела, адекватная физическая нагрузка (при избыточной массе тела возможно применение аноректиков – оптимален препарат центрального действия, угнетающий обратный захват катехоламинов, меридиа (сибутрамин) 10 мг 1 раз/сут, за 1 мес. потеря веса 3-5 кг)
3. Медикаментозная терапия – пероральные сахароснижающие препараты (а у больных с с инсулинопотребной формой СД 2 типа + инсулинотерапия смешанными препаратами комбинированного действия: микстард-30, хумулин профиль-3, инсуман комб-25 ГТ в режиме двухкратного введения перед завтраком и ужином):
а) секретогены - препараты, стимулирующие секрецию готового инсулина b-клетками:
1)производные сульфонилмочевины – хлорпропамид (I генерация) 250 мг/сут в 1 или 2 приема; глибенкламид (манинил) 1,25-20 мг/сут, в том числе микронизированные формы манинила 1,75 и 3,5; глипизид, гликлазид (диабетон) по 80-320 мг/сут, гликвидон, глимепирид (амарил) 1-8 мг/сут
2)производные амминокислот – оптимальны для регуляции постпрандиальной гипергликемии: новонорм (репаглинид) по 0,5-2 мг перед приемом пищи до 6-8 мг/сут, старликс (натеглинид)
б) бигуаниды – увеличивают в присутствии инсулина периферическую утилизацию глюкозы, уменьшают глюконеогенез, повышают утилизацию глюкозы кишечником со снижение уровня гликемии крови, оттекающей от кишечника: N,N-диметилбигуанид (сиофор, метформин, глюкофаж) по 500-850 мг 2 раза/сут в) ингибиторы -глюкозидаз – снижают абсорбцию углеводов в ЖКТ: глюкобай (акарбоза) по 150-300 мг/сут в 3 приема во вре-
мя еды г) глитазоны (тиозалидиндионы, сенситайзеры инсулина) – повышают чувствительность периферических тканей к инсули-
ну: актос (пиоглитазон) 30 мг 1 раз/сут 4. Профилактика и лечение поздних осложнений ИНСД – для успешного решения задачи необходимо:
а) компенсировать нарушения углеводного обмена до нормогликемии, аглюкозурии проведением адекватного и правильного лечения ИНСД
б) компенсировать жировой обмен соответствующей гиполипидемической терапией: диета с ограничением жиров, ЛС (статины, фибраты, препараты никотиновой кислоты и др.)
в) обеспечить нормальный уровень АД (гипотензивные препараты, особенно показаны ИАПФ, которые дополнительно обладают нефропротективным действием)
г) обеспечить равновесие свертывающей и противосвертывающей систем крови Профилактика поздних осложнений включает сохранение стойкой компенсации углеводного обмена на протяжении длительного времени и раннее выявление начальных стадий поздних осложнений диабета:
1)диабетической ретинопатии – необходимо регулярно проводить исследование глазного дна 1 раз в год первые 5 лет, а затем 1 раз в 6 месяцев; при новообразовании сосудов сетчатки показана лазерная коагуляция
2)диабетической нефропатии – необходимо определение микроальбуминурии 1 раз в 6 месяцев; при появлении признаков ХПН - диета с ограничением животного белка (до 40 г в сутки) и поваренной соли (до 5 г в сутки), применение ИАПФ, проведение дезинтоксикационной терапии, а при продолжающемся ухудшении функции почек – гемодиализ и др. осложнений.
Профилактика ИНСД: здоровый образ жизни (избегать гиподинамии и ожирения, не злоупотреблять алкоголем, курением и др., рациональное питание, исключение стрессов) + постоянная адекватная коррекция диетой или медикаментозно впервые возникших эпизодов гипергликемии с последующим периодическим контролем уровня сахара в крови.
69. Поздние (хронические) осложнения сахарного диабета: микроангиопатии (диабетическая ретинопатия, диабетическая нефропатия), макроангиопатия (синдром диабетической стопы), полинейропатия.
Диабетическая ангиопатия – генерализованное поражение сосудов при СД, распространяющееся как на мелкие сосуды (микроангиопатия), так и на артерии крупного и среднего калибра (макроангиопатия).
Диабетическая микроангиопатия – специфическое для СД распространенное поражение мелких сосудов (артериол, капилляров, венул), характеризующееся изменениями их структуры (утолщением базальной мембраны, пролиферацией эндотелия, отложением в стенку сосудов гликозаминогликанов, гиалинозом стенок артериол, микротромбозами, развитием микроаневризм) с резким увеличением проницаемости для ряда веществ:
1. Диабетическая ретинопатия – основная причина слепоты у больных СД; выделяют непролиферативную (наличие в сетчатке микроаневризм, кровоизлияний, отека, твердых экссудатов), препролиферативную (+ изменения вен сетчтаки: четкообразность, извитость, петли, удводения, колебания калибра сосудов) и пролиферативную (+ появление новых сосудов, обширные частые кровоизлияния в сетчатку с ее отслойкой и интенсивным образованием соединительной ткани) формы; клинически жалобы на мелькание перед глазами мушек, пятен, ощущение тумана, нечеткость предметов, прогрессирующее снижение остроты зрения.
Скрининг диабетической ретинопатии.
95
«Золотой стандарт» - стереоскопическое цветное фотографирование глазного дна, флюоресцентная ангиография сетчатки; в настоящее время для скринига наиболее доступна прямая офтальмоскопия.
1-ое обследование через 1,5-2 года с момента установления диагноза СД; при отсутствии диабетической ретинопатии обследование не реже 1 раза в 1-2 года, при наличии – не реже 1 раза в год или чаще; при сочетании диабетической ретинопатии с беременностью, АГ, ХПН – индивидуальный график осмотров; при внезапном снижении остроты зрения – немедленный осмотр офтальмологом.
Принципы лечения диабетической ретинопатии:
1.Медикаментозная терапия: максимальная компенсация углеводного обмена (пероральные сахароснижающие препараты, инсулинотерапия), лечение сопутствующих ослжонений, антиоксиданты (никотинамид) при непролиферативной диабетической ретинопатии с повышенным уровнем липидов в крови, низкомолекулярные гепарины на начальных стадиях процесса
2.Фотокоагуляция сосудов сетчатки в начальных стадии диабетической ретинопатии (локальная - очаги лазерной коагуляции наносят в зоне патологического процесса или преретинального кровоизлияния, фокальная - коагуляты наносят в несколько рядов в парамакулярной и парапапиллярной областях, панретинальная – используют при пролиферативной ретинопатии, от 1200 до 1600 лазерных очагов наносят в шахматном порядке на сетчатку, на всем протяжении от парамакулярной и парапапиллярной областей до экваториальной зоны сетчатки).
3.Криокоагуляция – показана больным с пролиферативной диабетической ретинопатией, осложненной частыми кровоизлияниями в стекловидное тело, грубым ростом неоваскуляризации и пролиферативной ткани; проводится вначале в нижней половине глазного яблока, а через неделю – в верхней половине; позволяет улучшить или стабилизировать остаточное зрение, предупредить полную слепоту.
4.Витрэктомия – показана при рецидивирующих кровоизлияниях в стекловидное тело с последующим развитием фиброзных изменений стекловидного тела и сетчатки
2.Диабетическая нефропатия – обусловлена узелковым или диффузным нефроангиосклерозом почечных клубочков.
Клинико-лабораторные проявления диабетической нефропатии.
1.В начальных стадиях субъективные проявления отсутствуют, в клинически выраженной стадии характерна нарастающая протеинурия, артериальная гипертензия, нефротический синдром, прогрессирующая клиника ХПН.
2.Микроальбуминурия (экскреция альбумина с мочой, превышающая нормальные значения, но не достигающая степени протеинурии: 30-300 мг/сут) – наиболее ранний признак диабетической нефропатии, при появлении постоянной микроальбуминурии клинически выраженная стадия заболевания разовьется через 5-7 лет.
3.Гиперфильтрация (СКФ > 140 мл/мин) – раннее последствие влияния гипергликемии на функцию почек при СД; способствует повреждению почек; с увеличением длительности СД СКФ прогрессивно снижается пропорционально увеличению протеинурии и выраженности степени АГ На поздних стадиях диабетической нефропатии характерна постоянная протеинурия, снижение СКФ, нарастание азотемии (креати-
нина и мочевины крови), усугубление и стабилизация АГ, развитие нефротического синдрома.
Стадии развития диабетической нефропатии:
1)гиперфункция почек – увеличение СКФ > 140 мл/мин, увеличение почечного кровотока, гипертрофия почек, нормоальбуминурия < 30 мг/сут (развитвается в дебюте СД)
2)начальные структурные изменения ткани почек – утолщение базальных мембран капилляров клубочков, расширение мезангиума, высокая СКФ, нормоальбуминурия (2-5 лет от начала СД)
3)начинающаяся нефропатия – микроальбуминурия (30-300 мг/сут), высокая или нормальная СКФ, нестойкое повышение АД (5-15 лет от начала СД)
4)выраженная нефропатия (клинически явная стадия) – протеинурия, нормальная или умеренно сниженная СКФ, АГ (10-25 лет от начала СД)
5)уремия (ХПН) – выраженное снижение СКФ, артериальная гипертензия и др. клинические проявления (более 20 лет от начала СД или 5-7 лет от появления протеинурии).
Скрининг диабетической нефропатии:
а) при отсутствии протеинурии – исследование микроальбуминурии не реже 1 раза в год спустя 5 лет от начала заболевания при ИЗСД и не реже 1 раза в год с момента установления диагноза при ИНСД.
б) при наличии протеинурии – исследование не менее 1 раза в 4-6 мес.: скорости нарастания протеинурии в суточной моче, скорости снижения СКФ, скорости нарастания АГ, содержание в крови креатинина, мочевины, ХС.
Принципы лечения диабетической нефропатии:
1)на стадии микроальбуминурии – ингибиторы АПФ (эналаприл, рамиприл, периндроприл и др.) – обладают нефропротективным действием, их доза определяется уровнем исходного АД; если микроальбуминурия не превышает 100 мг/сут – курсовое лечение (по 2-3 курса в год длительностью 2-3 месяца), если выше - постоянное лечение ИАПФ; препараты из группы гликозаминогликанов (сулодексид по 1 мл в/м 1 раз/сут 20 дней или перорально по 1-2 капсулы 2 раза/сут 6-8 недель)
2)на стадии протеинурии – коррекция сахароснижающей терапии (чаще всего перевод на инсулинотерапию), почечная диета с ограничением животного белка до 40 г/сутки и ограничением соли (при наличии АГ); гипотензивные препараты (особенно ИАПФ, при неэффективности + антагонисты кальция, селективные бета-блокаторы и петлевые диуретики); курсовая терапия препаратами из группы гликозаминогликанов (сулодексид); коррекция гиперлипидемии (препараты из группы статинов).
3)на стадии ХПН – обязательна инсулинотерапия, почечная диета, гипотензивные, корекция гиперлипидемии,
сорбенты (энтеродез, активированный уголь и др.), коррекция кальций-фосфорного гомеостаза (карбонат кальция 3-5 г/сут под контролем уровня кальциемии), коррекция анемии, экстракорпоральная детоксикция (гемодиализ, перитонеальный диализ) Диабетическая макроангиопатия – поражение артерий крупного и среднего калибра у больных СД в виде атеросклероза, реже
– в виде кальцифицирующего склероза Менкеберга или диффузного фиброза интимы.
Особенность патогенеза макроангиопатий: вследствие гликозилирования атерогенные ЛПНП не распознаются соответствующими нормальными рецепторами и период их полужизни в плазме значительно возрастает, а антиатерогенные ЛПВП не обеспечивают достаточный транспорт ХС из пораженных участков артерии.
Классификация диабетических макроангиопатий:
1.Атеросклероз аорты и коронарный артерий (ИБС, ИМ)
2.Атеросклероз церебральных артерий (ОНМК, атеросклеротическая энцефалопатия)
3.Атеросклероз периферических артерий, в том числе и артерий нижних конечностей.
Клиническая картина диабетической макроангиопатии нижних конечностей:
-зябкость ног, слабость в ногах при ходьбе, длительном стоянии; синдром перемежающейся хромоты (боли в области икроножных мышц, появляющиеся или усиливающиеся при ходьбе и уменьшающиеся в покое, что заставляет больного прерывать ходьбу и останавливаться; по мере прогрессирования поражения артерий боли становятся постоянными)
-трофические изменения и сухость кожи голеней и стоп, похолодание стоп; темные сухие ногти, часто пораженные грибковой инфекцией, болезненные глубокие трещины кожи на пятках
-мраморность кожи стоп и голеней, цианоз пальцев
-атрофия мышц голеней, выпадение волос на голенях
-ослабление или отсутствие пульса на a. tibialis posterior и a. dorsalis pedis
96
- при крайней степени нарушения кровообращения в стопах – сухая гангрена в области пальцев - вначале появляется темное пятно, затем развивается сухой некроз кожи, иногда с самоампутацией пальца; часто образуются пузырьки с серозным или геморрагическим содержимым, изъязвление кожи с распространением язвенно-некротического процесса и последующим осложнением бактериальной инфекцией (влажная гангрена)
Синдром диабетической стопы (СДС) – патологическое состояние стоп больного СД, которое возникает на фоне поражения периферических нервов, сосудов, кожи, мягких тканей, костей и суставов и проявляется острыми и хроническими язвами, костносуставными и гнойно-некротическими процессами.
Значимость проблемы: ампутации нижних конечностей у больных СД производятся в 15 раз чаще, чем у остального населения. Основные факторы группы риска синдрома диабетической стопы:
а) периферическая нейропатия - главный фактор риска: сенсорная, моторная, автономная б) периферическая ангиопатия – макроангиопатия или микроангиопатия
в) деформация стопы - использование неподходящей обуви, увеличение гогантарного (подошвенного) давления Группы факторов риска, способствующие действию основных:
1)неадекватный уход за стопами
2)избыточная масса тела, употребление алкоголя, курение.
3)нарушение зрения, тяжелая ретинопатия
4)диабетическая нефропатия
5)инфекционные и грибковые поражения стоп
6)плохо корригируемая гипергликемия
7)спортивные соревнования, интенсивный бег
8)возраст старше 60 лет
9)длительность сахарного диабета
10)предшествующие язвы и ампутации стопы
11)артериальная гипертензия и гиперхолестеринемия.
Клинические формы СДС:
а) нейропатическая форма – поражение соматической и вегетативной нервной системы при достаточной сохранности артериального кровотока нижних конечностей.
1)нейропатический отек – возникает из-за вазомоторных нарушений (повышенного гидродинамического давления в микроциркуляторном русле); клинически стопа и голень отечны, на отечной ткани остаются следы сдавливания; кожа голени и стопы теплая, окраска ее не изменяется, болезненности нет
2)нейропатическая язва – язва в месте повышенного давления и механического раздражения (чаще всего на подошве
ив межпальцевых промежутках, в области головок II-III метатарзальных костей), сопровождающаяся повышенным гиперкератозом, сухостью кожи (атрофией потовых желез), отсутствием или незначительностью болевых ощущений; нейропатические язвы часто инфицируется стафилококками, стрептококками, колибактериями, нередко присоединяется анаэробная инфекция, что приводит к распространению некроза на подкожно-жировую клетчатку, мышечную ткань, костно-связочный аппарат, способствует микротромбированию в системе микро-
циркуляции и вовлечению в язвенно-некротический процесс новых обширных участков мягких тканей стопы с последующим развитием гангрены.
3)остеоартропатия –синдромокомплекс асептической деструкции костей и суставов при СД, проявляющийся характерной клинической и рентгенологической симптоматикой (стопа Шарко).
Наиболее часто страдают плюсне-предплюсневая часть стопы и голеностопный сустав; костные изменения проявляются остеопорозом, остеолизисом, гиперостозом, постепенно прогрессируют и приводят к выраженной деформации стопы. Клинически характерно: покраснение и отечность стопы; выпячивание и деформация костей стопы, стопа становится плоской, отмечаются патологические движения, дезорганизация суставов («мешок, наполненный костями»); нередко стопа приобретает кубическую форму или форму каталки; часто возникают спонтанные переломы костей стопы; рентгенологически выявляется остеопороз, выраженная костная деструкция с секвестрацией и резорбцией костной ткани, нарушение состояния суставных поверхностей, периартикулярные гипертрофические изменения мягких тканей, субхондральный остеосклероз, образование остеофитов, внутрисуставные переломы.
б) нейроишемическая форма – сочетанное взаимодействие диабетической макроангиопатии, микроангиопатии и нейропатии нижних конечностей, клинически характерны:
- выраженные боли в области пораженной стопы, беспокоящие как при ходьбе, так и в покое, несколько уменьшающиеся при свешивании ног с постели, возвышенном положении головного конца кровати - кожа стопы сухая, бледная или цианотичная, холодная
- язвенные дефекты по типу акральных (концевых) некрозов в области кончиков пальцев, краевой поверхности пяток, часто осложняющиеся гангреной (развиваются при наступлении критической ишемии)
- резко ослабленная или отсутствующая пульсация на a.tibialis posteriorа и a. dorsalis pedis - снижение кровотока в области пораженной стопы, оцениваемое следующими методами
1)УЗДГ с измерением лодыжечно-плечевого индекса (отношения САД в лодыжечной области к САД в плечевой артерии, в норме 0,9-1,0, при ишемии снижается; критический показатель индекса < 0,6, прогностически неблагоприятный < 0,3).
2)двойное сканирование с помощью эхографии в В-режиме и допплерографии – выявляет локализацию гемодинамически значимых повреждений (локальное повышение скорости кровотока указывает на стеноз)
3)динамическая капилляроскопия, лазерная допплеровская флоуметрия, измерение транскожного парциального напряжения кислорода для оценки состояния микроциркуляции стопы
4)ангиография артерий нижних конечностей – наиболее информативна, позволяет диагностировать уровень стеноза или
тромбоза артерии и его протяженность в) смешанная форма – сочетание нейропатической и нейроишемической форм.
Диагностика синдрома диабетической стопы:
а) осмотр и пальпация стоп и голеней (обращают внимание на цвет конечностей, деформации, отеки, состояние трофики тканей, пульсацию артерий, наличие язвенных поражений и др.)
б) неврологическое исследование (исследование вибрационной чувствительности с использованием биотезиометра или градуированного камертона; исследование тактильной и температурной чувствительности; исследование сухожильных рефлексов, включая ахиллов)
в) оценка состояния артериального кровотока стопы г) рентгенография костей и суставов стопы в двух проекциях
Принципы лечения синдрома диабетической стопы:
а) ишемической формы СДС:
-вазапростан 60 мкг на 150-250 мл 0,9% раствора NaCl в/в капельно ежедневно в течение 1 мес, при необходимости – повторить через 6 мес
-сулодексид по 600 ЛЕ в/м 1 раз/сут 10-15 дней, затем прием внутрь по 500 ЛЕ 2 мес.
97
-трентал (пентоксифиллин) 300-400 мг на 250 мл 0,9 % раствора NaCl в/в капельно 21 день, затем прием внутрь по 400 мг 3 раза/сут 3 мес, повторить курс через 6 мес б) нейропатической формы (язвенных дефектов стоп и голеней):
-антибиотикотерапия препаратами широкого спектра (цефалоспорины III-IV, фторхинолоны, аминогликозиды в комбинации с метронидазолом или клиндамицином): ципрофлоксацин 1,0 г в/в капельно 2 раза/сут + далацин (клиндамицин) 300 мг 3 раза/сут и др., длительность зависит от тяжести процесса
-полная разгрузка пораженной области от давления (применение специальной лечебной обуви, использование кресла-каталки или костылей)
-местное лечение: обработка растворами антисептиков, не обладающими цитотоксическими свойствами (диоксидин 1%, хлоргексидин 0,05%); перевязочные средства на стадии очищения – пленки Актисорб, Инадин, Гидрокол, Сорбалонг, на стадии грануляции – Гидросорб, Атравман, Бранолид, на стадии эпителизации – Гидрофильм, Биоклюзив При неэффективности консервативного – хирургическое лечение (от некроэктомии до ампутаций).
Периферическая нейропатия при СД включает:
а) полинейропатию черепномозговых нервов: поражение обонятельного нерва (1-ой пары) – снижение обоняния; зрительного нерва (2-ой пары) – медленное падение зрения, центральные скотомы при нормальных границах поля зрения, побледнение височных половин сосков зрительных нервов; группы глазодвигательных нервов (3-я, 4-я, 6-я пары) - парезы глазодвигательных мышц с болями в глазнице и височной области, расстройства зрачковых реакций, неравномерность зрачков; тройничного нерва (5-ой пары) – тригеминальная невралгия; лицевого нерва (7-ой пары) – неврит и паралич лицевого нерва; слухового и вестибулярного нерва (8-ая пара) – снижение слуха, головокружение, нистагм; языкоглоточного (9-ой пары) и блуждающего (10-ой пары) нервов: нарушение глотания, неподвижность мягкого неба, поперхивание, снижение вкусовой чувствительности, гипомоторно-гипотонические нарушения ЖКТ, охриплость, осиплость голоса.
б) дистальную полинейропатию спинномозговых нервов - основной вид поражения периферических нервов, клинически характерны:
-болевой синдром: тупые диффузные тянущие боли в симметричных участках дистальных отделов конечностей; боли вначале возникают ночью или рано утром, не ощущаются при ходьбе и днем, затем становятся постоянными, интенсивными, могут нарушать сон
-парестезии (ощущения покалывания, ползания мурашек, онемения, зябкости, «гудения», «жжения»)
-болезненные тонические судороги в икроножных мышцах, реже - в мышцах стоп, бедер и кистей; обычно они возникают в покое, ночью
-ощущение слабости и тяжести в нижних конечностях, болезненность мышц
-снижение и исчезновение сухожильных и периостальных рефлексов (чаще и раньше – ахилловых, реже – коленных)
-нарушение чувствительности с гипоестезией по типу «носков» и «перчаток» (вначале нарушается вибрационная чувствительность, затем – болевая, тактильная, температурная)
-двигательные нарушения: снижение мышечной силы, гипотрофией мышц дистальной группы
-вегетативно-трофические нарушения: нарушения выделения пота, истончение и шелушение кожи, ухудшение роста волос на ногах, нарушение трофики ногтей.
в) автономную висцеральную нейропатию – возникает из-за поражения вегетативной нервной системы:
1)нейропатия органов кровообращения (постоянная тахиили брадикардия, фиксированный сердечный ритм, ортостатическая артериальная гипотензия, кардиореспираторный синдром Пейджа-Уоткинса – внезапная остановка сердца и дыхания и др.)
2)нейропатия органов пищеварения (дисфагия из-за дисфункции пищевода, гастропарез, диабетическая энтеропатия с обильной водянистой диареей, атония желчного пузыря и др.)
3)нейропатия органов дыхания
4)нейропатия половых и мочевыводящих органов (нейрогенный мочевой пузырь, эректильная дисфункция у мужчин, аноргазмия у женщин)
5)нейропатия периферических эндокринных желез.
Принципы лечения диабетической полиневропатии:
1. Патогенетическая терапия:
а) препараты α-липоевой кислоты (тиоктацид, тиогамма, берлитион, эспа-липон) по 600 мг на 150 мл 0,9% раствора NaCl в/в капельно 3 недели, затем внутрь по 600 мг утром натощак 2 мес, ежегодно 2 курса
б) препараты жирорастворимого витамина В1 (бенфотиамин) и его комбинации с витаминами В6 и В12 (мильгамма 100) – по 1 драже 2 раза/сут 2 мес, ежегодно 2 курса 2. Симптоматическая терапия сенсомоторной диабетической нейропатии:
а) препараты холинэстеразы (прозерин, неостигмин) - способствуют улучшению нервного ипульса: по 1 мл 0,05% р-ра прозерина п/к 1-2 раза в сутки
б) анальгетики, противосудорожные ЛС: карбамазепин 200-600 мг/сут в течение 2-х недель в) антидепрессанты: амитриптилин 25-100 мг/сут г) препараты магния 100-300 мг/сут внутрь для лечения судорог икроножных мышц
3. Симптоматическая терапия автономной нейропатии:
а) гастропарез - мотилиум по 10 мг 3 раза/сут, церукал по 10 мг 4 раза/сут внутрь б) запоры - пиридостигмин 10-60 мг 1 раз/сут внутрь
в) ортостатическая гипотензия – кортинефф (флоринеф) по 0,05 мг 1 раз/сут внутрь и др.
4. Физиотерапия: индуктотермия на нижние конечности, магнитотерапия на нижние конечности, массаж нижних конечностей и др.
70. Метаболический синдром: современные представления о патогенезе, основные клинические проявления, подходы к лечению.
Метаболический синдром (МС, синдром Х) – комплекс метаболических, гормональных и клинических нарушений, имеющих в основе инсулинорезистентность и компенсаторную гиперинсулинемию и являющихся модифицируемыми факторами повышенного риска развития ИБС и ее осложнений, а также сахарного диабета 2 типа.
Клиническое значение метаболического синдрома: при его наличии повышенный риск развития сахарного диабета, сердечно-сосу- дистых заболеваний, инсульта, сердечно-сосудистой и общей смертности.
Современные представления о патогенезе МС:
1. Объединяющая основа всех проявлений МС – первичная инсулинорезистентность (снижение реакции инсулинчувствительных тканей на инсулин при его достаточной концентрации) и сопутствующая системная гиперинсулинемия, которая является с одной стороны компенсаторной (необходимой для преодоления инсулинорезистентности и поддержания нормального транспорта глюкозы в клетки), а с другой стороны – патологической (способствующей возникновению и развитию метаболических, гемодинамических и органных нарушений, приводящих в конечном итоге к развитию СД 2 типа, ИБС и других проявлений атеросклероза)
2. Причины развития инсулинорезистентности:
а) наследственная предрасположенность (полигенное нарушение, имеют значение мутации генов субстрата инсулинового рецептора СИР-1, гликогенсинтетазы, гормончувствительной липазы, b3-адренорецепторов, ФНО , молекулярные дефекты белков,
передающих сигналы инсулина)
98
б) нейрогуморальные нарушения, сопутствующие висцеральному абдоминальному ожирению (повышение кортизола, инсулина, норадреналина, снижение прогестерона, соматотропного гормона, повышение у женщин и снижение у мужчин тестостерона) – способствуют развитию инсулинорезистентности и метаболическим нарушениям
в) висцеральное абдоминальное ожирение - висцеральные адипоциты имеют высокую плотность b3-Ар, рецепторов кортикостероидов и антрогенов и низкую плотность 2-Ар, рецепторов к инсулину, что определяет высокую чувствительность ткани к липолитическому действия КА и низкую – к антилиполитическому действию инсулина интенсивный липолиз в висцеральных адипоцитах выделение большого количества свободных жирных кислот (СЖК) в портальную циркуляцию препятствие СЖК связыванию инсулина гепатоцитами инсулинорезистентность на уровне печени, снижение экстракции инсулина печенью системная гиперинсулинемия усиление периферической инсулинорезистентности; жировая ткань также обладает эндокринной функцией и синтезирует ряд БАВ (ФНО , лептин и др.), которые в свою очередь способствуют инсулинорезистентности
г) гиподинамия - сопровождается снижением транслокации транспортеров глюкозы (ГЛЮТ-4) в мышечных клетках д) избыточное потребление животных жиров, содержащих насыщенные жирные кислоты - приводит к структурным изменениям фосфолипидов мембран клеток и нарушению экспрессии генов, контролирующих
Основные клинические проявления метаболического синдрома: а) висцеральное абдоминальное ожирение
б) инсулинорезистентность и гиперинсулинемия – основные факторы, ведущие к СД 2 типа у лиц с наследственной предрасположенностью; инсулинорезистентность снижение утилизации глюкозы периферическими тканями, повышение продукции глюкозы печенью гипергликемия постоянная стимуляция бета-клеток поджелудочной железы, воздействие повышенной концентрации СЖК на бета-клетки (феномен липотоксичности) секреторная дисфункция бета-клеток с прогрессирующим нарушением секреции инсулина СД 2 типа гипергликемия дальнейшее прогрессирование секреции инсулина бета-клетками (феномен глюкозотоксичности) усугубление периферической инсулинорезистентности в) дислипидемия: липидная триада - сочетание гипертриглицеридемии, низкого уровня ХС ЛПВП и высокого уровня ХС ЛПНП
г) артериальная гипертензия – является чаще всего одним из первых клинических проявлений метаболического синдрома д) нарушение толерантности к глюкозе, сахарный диабет 2 типа е) ранний атеросклероз, ишемическая болезнь сердца
ж) нарушения гемостаза в сторону гиперкоагуляции - обусловлено как повышением уровня фибриногена, так и снижением уровня ингибиторов фибринолиза з) гиперурикемия и подагра и) микроальбуминурия к) гиперандрогения
Критерии диагностики метаболического синдрома:
Основной признак: центральный (абдоминальный) тип ожирения - окружность талии более 80 см у женщин и более 94 см у мужчин.
Дополнительные критерии
1)артериальная гипертензия (АД ≥ 140/90 мм рт. ст.)
2)повышение уровня триглицеридов ( ≥ 1,7 ммоль/л)
3)снижение уровня ХС ЛПВП (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин)
4)повышение уровня ХС ЛПНП > 3,0 ммоль/л
5)гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л)
6)нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥ 7,8 и ≤ 11,1 ммоль/л)
Наличие у пациента центрального ожирения и 2-х из дополнительных критериев является основанием для диагностирования у него метаболического синдрома.
Схема обследования больных с риском метаболического синдрома на стадии доклинических проявлений: - выявление наследственной предрасположенности к ожирению, СД, ИБС, АГ - социальный анамнез (особенности образа жизни, пищевые привычки)
- антропометрические измерения (рост, вес, ИМТ, окружность талии и бедер) - мониторинг артериального давления, ЭКГ
- определение биохимических показателей уровня триглицеридов, холестерина ЛПВП, ЛПНП, апо-В плазмы - определение глюкозы крови натощак и инсулина крови натощак, проведение по показаниям теста толерантности к глюкозе
Подходы к лечению метаболического синдрома Цель лечения: максимальное снижение общего риска сердечно-сосудистой заболеваемости и летальности. 1) мероприятия, направленные на уменьшение массы тела:
-рациональное питание (ограничение потребления жира до 25-30% от суточной нормы калорий, быстроусвояемых углеводов; введение в рацион пищевых волокон; уменьшение потребления соли)
-увеличение физической активности
-снижение потребления алкоголя, отказ от курения
-орлистат (ксеникал) 120 мг 3 раза/сут внутрь во время еды – препятствует всасыванию пищевых жиров, оказывая тормозное влияние на липазы ЖКТ 2) пероральные сахароснижающие лекарственные средства, уменьшающие инсулинорезистентность и гиперинсулинемию (метфор-
мин в таб. 850 мг, вначале по 1 таб./сут с постепенным увеличением дозы до достижения эффекта до 2-3 таб/сут – повышает чувствительно тканей к инсулину, усиливает периферическую утилизацию глюкозы, тормозит глюконеогенез в печени, уменьшает всасывание углеводов из ЖКТ)
3) при выраженной дислипидемии, не поддающейся корекции диетотерапией, - гиполипидемические препараты - статины (ловастатин, симвастатин, правастатин) или фибраты.
4) лечение СД 2 типа (пероральные сахароснижающие ЛС) и артериальной гипертензии (предпочтительнее всего ИАПФ, блокаторы кальциевых каналов, 1-адреноблокаторы, селективные b-блокаторы)
71. Диффузный токсический зоб (болезнь Грейвса-Базедова): этиология, патогенез, клиника, диагностика, принципы лечения, показания к оперативному лечению.
Диффузный токсический зоб (ДТЗ) - аутоиммунное заболевание щитовидной железы, развивающееся у генетически предрасположенных к нему лиц, характеризующееся диффузным увеличением и гиперфункцией щитовидной железы, а также токсическими изменениями органов и систем вследствие гиперпродукции тиреоидных гормонов (тиреотоксикоз).
Этиопатогенез ДТЗ.
1.ДТЗ – наследственное аутоиммунное заболевание, передающееся полигенным путем (сочетается с носительством HLA-B8, DR3, DW3) и возникающее на фоне действия предрасполагающих факторов (психические травмы, инфекционно-воспалительные заболевания, черепно-мозговая травма, заболевания носоглотки и др.)
2.На фоне врожденного дефицита Т-супрессорной функции лимфоцитов возникает аутоиммунная реакция по отношению к АГ щитовидной железы, в результате развития которой В-лимфоцитами продуцируются АТ – тиреостимулирующие иммуноглобулины,
99
приводящие к гипертрофии и гиперфункции щитовидной железы, увеличению продукции Т3 (трийодтиронин) и Т4 (тетрайодтиронин, тироксин), тиреотоксикозу.
3. Т3 и Т4 стимулируют всасывание углеводов в кишечнике, глюконеогенез и гликогенолиз, повышают гликемию, стимулируют липолиз, моторную функцию ЖКТ, повышают чувствительность сердечно-сосудистой системы к катехоламинам, способствуют ускоренному катаболизму ГКС и др.
Клинические проявления ДТЗ:
1. Основные жалобы больных:
-повышенная психическая возбудимость, раздражительность, беспокойство, суетливость, невозможность концентрировать внимание
-чувство давления в области шеи, затруднение при глотании
-ощущение постоянного сердцебиения, перебоев в области сердца
-постоянная диффузная потливость, чувство жара
-появление дрожания рук, что мешает выполнять тонкую работу, писать; часто изменение почерка
-прогрессирующее похудание несмотря на хороший аппетит
-общая мышечная слабость
-появление выпячивания глаз, слезотечение, светобоязнь
-при тяжелых формах: одышка (за счет выраженного поражения миокарда); диарея (за счет поражения кишечника); половая слабость у мужчин и нарушение менструального цикла у женщин 2. При осмотре:
-суетливое поведение больных, они совершают много лишних движений
-эмоциональная лабильность, плаксивость, быстрая смена настроения, торопливая речь
-масса тела снижена у всех больных (в связи с катаболическим и липолитическим эффектами тиреоидных гормонов), мышцы атрофичны, их сила и тонус снижены (тиреотоксическая миопатия)
-кожа мягкая (тонкая, эластичная, бархатистая), горячая, влажная, гиперемированная; кисти и стопы теплые
-диффузное равномерное увеличение щитовидной железы различных степеней; щитовидная железа мягкая, иногда плотноватоэластичная
-у некоторых больных – претибиальная микседема (кожа в области голеней и стоп утолщена, уплотнена, коричневато-оранжевая, волосы на коже голеней грубые («свиная кожа») – обусловлена избыточным накоплением в коже мукополисахаридов)
-характерные изменения со стороны глаз: блеск, расширение глазной щели («удивленный взгляд»); симптом Грефе (при фиксации зрением медленно опускающегося вниз предмета обнажается участок склеры между верхним веком и краем радужки), симптом Кохера (то же при перемещении предмета снизу вверх); симптом Дальримпля (то же при фиксации предмета зрением в горизонтальной плоскости); симптом Розенбаха - тремор век при закрытых глазах; симптом Жофруа = неспособность образовать складки на лбу; симптом Штельвага - редкое мигание; симптом Мебиуса - отхождение глазного яблока кнаружи при фиксации взором предмета, подносимого к области переносицы; симптом Стасинского или «красного креста» - проявляется в виде инъекции сосудов склер (отхождение инъецированных сосудов вверх, вниз, вправо, влево от радужки создает впечатление красного креста, в центре которого расположен зрачок).
-признаки офтальмопатии – серьезного осложнения тиреотоксикоза, ведущего при прогрессировании к потере зрения: экзофтальм, припухлость век со сглаживанием пальпеброорбитальной складки, конъюнктивит (набухание и покраснение конъюнктивы, чувство рези, «песка» в глазах, слезоточивость, светобоязнь), нарушение функции глазодвигательных мышц (нарушение движений глазного яблока в стороны), нарушение смыкания век, сухость роговицы при очень выраженном экзофтальме, развитие в ней трофических нарушений, кератита, присоединение инфекции, повышение внутриглазного давления (глаукома) с дальнейшей атрофией зрительного нерва 3. Изменения со стороны органов и систем:
а) нервная система: повышенная активность симпатического отдела, психическая возбудимость, раздражительность, беспокойство, суетливость, нетерпимость и т. д.; симптом Мари - мелкий симметричный тремор пальцев вытянутых рук, «симптом телеграфного столба» - выраженная дрожь больного, которая ощущается врачом при пальпации грудной клетки больного.
б) сердечно-сосудистая система: постоянная тахикардия даже во время сна; лабильность пульса (вначале ритмичный, при длительном тиреотоксикозе появляется экстрасистолия, а затем МА); приподнимающийся, смещенный влево сердечный толчок; перкуторно расширение левой границы сердца; аускультативно усиление первого тона, систолический шум над всеми отделами сердца, особенно над верхушкой и легочной артерией; ЭКГ: в начальных стадиях увеличение амплитуды зубцов Ρ и Т («возбужденная» ЭКГ), в дальнейшем снижение амплитуды Ρ и Т; склонность к повышению САД и снижению ДАД в) органы дыхания: тахипноэ, иногда дыхание аритмичное
г) органы пищеварения: снижение кислотности желудочного сока, ускорение моторики кишечника с диареей; жировая дистрофия печени д) костная система: остеопороз с болями в костях (из-за катаболического эффекта тироксина и вымывания кальция и фосфора из костей)
Диагностика ДТЗ:
1)ОАК: умеренная нормохромная анемия, склонность к лейкопении, относительный лимфоцитоз
2)БАК: снижение содержания ХС, липопротеинов, общего белка, альбумина, при значительном поражении печени - повышение билирубина и АлАТ; возможно увеличение уровня γ-глобулинов, глюкозы
3)иммунограмма крови: снижение количества и функциональной активности общих Т-лимфоцитов и Т-лимфоцитов-супрессоров, повышение содержания иммуноглобулинов, обнаружение тиреостимулирующих иммуноглобулинов, антител к тиреоглобулину, микросомальному антигену.
4)УЗИ щитовидной железы: диффузное увеличение, возможно неравномерное изменение эхогенности
5)определение степени поглощения 131I щитовидной железой: скорость поглощения резко увеличена через 2-4 и 24 ч.
6)радиоизотопное сканирование щитовидной железы – позволяет выявить функционально активную ткань, определить форму и размеры железы, наличие в ней узлов; характерно увеличенное изображение щитовидной железы с повышенным захватом изотопа
7)радиоиммунное определение содержания в крови Т3 и Т4
8)определение содержания в крови связанного с белками йода, косвенно отражающего функцию щитовидной железы: показатели повышены
9)рефлексометрия – значительное укорочение времени рефлекса ахиллова сухожилия (косвенный метод определения функции щитовидной железы, характеризующий периферическое действие тиреоидных гормонов)
Принципы лечения ДТЗ:
1.Тиреостатические средства: мерказолил / тиамазол 30-60 мг/сут внутрь в 4 приема до уменьшения симптомов тиреотоксикоза, затем доза снижается на 5 мг в неделю до поддерживающей 2,5-10 мг/сут; калия перхлорат 400 мг/сут внутрь (применяется при непереносимости мерказолила), лития карбонат, препараты микройода (р-р Люголя, таблетки «Микройод»)
2.ГКС показаны: 1) при тяжелом течении заболевания с выраженным увеличением щитовидной железы и значительным экзофтальмом; 2) при выраженной лейкопении на фоне лечения мерказолилом и не поддающаяся лечению стимуляторами лейкопоэза (при невозможности отменить мерказолил); 3) при тиреотоксическом кризе, тиреотоксической офтальмопатии; 4) при отсутствии
100
эффекта от лечения тиреостатиками; рекомендуется преднизолон 15-30 мг/сут (2/3 суточной дозы – в 7-8 ч утра, 1/3 – в 11 ч дня); для предупреждения угнетения коры надпочечников возможна альтернирующая (назначение 48-часовой дозы ГКС утром через день) или интермиттирующая (чередование 3-4 дней приема ГКС с 3-4-дневными перерывами) терапия
3.Иммуномодулирующая терапия для нормализации функции иммунной системы: натрия нуклеинат в порошках по 0,1 г 4 раза/сут 3-4 недели, тималин по 10-30 мг/сут в/м 5-20 дней, тактивин по 1 мл п/к 5-6 дней, декарис / левамизол по 150 мг 1 раз/сут в течение 5 дней
4.Бета-адреноблокаторы – показаны при любой форме ДТЗ, особенно тяжелой, а также сочетающейся с АГ и аритмиями: пропранолол по 40 мг 4 раза/сут внутрь или селективные бета-адренолитики (талинолол / корданум)
5.Лечение радиоактивным йодом ( 131I накапливается в щитовидной железе и излучает бета-частицы, которые ее разрушают) – проводится при неэффективности тиреостатической терапии, тяжелых формах тиреотоксикоза с осложнениями, рецидивах ДТЗ после оперативного лечения
6.Хирургическое лечение: субтотальная резекция щитовидной железы по Николаеву – показана при тяжелой форме заболевания, при среднетяжелой форме с отсутствием эффекта от проводимой тиреостатической терапии; в период беременности и лактации; при узловых, смешанных формах зоба; при большой степени увеличения щитовидной железы; при развитии МА
7.Лечение офтальмопатии: рекомендуется носить темные очки, спать с приподнятым изголовьем, периодически принимать диуретики (фуросемид 40 мг внутрь 2 раза/неделю), закапывать в глаза гидрокортизоновые капли и закладывать за веки гидрокортизоновую мазь (уменьшает явления конъюнктивита и кератита); ретробульбарное введение в клетчатку ГКС (дексазон по 4 мг с интервалом 4 дня, курс лечения 6-8 инъекций), лидазы (гиалуронидазы) 1 мл в 1 мл физ. р-ра; парлодел 25 мг 2 раза/сут внутрь (тормозит продукцию тиреотропина, уменьшает экзофтальм, отек и фиброз в ретробульбарной клетчатке).
8.Симптоматическое лечение (седативные, анксиолитики, анаболические средства, гепатопротекторы, гипотензивные препараты и др.)
72.Узловой зоб: этиопатогенез, клиника, диагностика, лечебно-профилактические мероприятия.
Узловой зоб - собирательное клиническое понятие, обозначающие наличие в щитовидной железе узлов – образований любого размера, имеющих капсулу, определяемых пальпаторно или при помощи УЗИ.
Этиопатогенетические причины узлового зоба:
1)дефицит иода (эндемический зоб)
2)длительный и нерациональный прием препаратов йода
3)токсическое повреждение щитовидной железы (бензин, свинец, краски и др.)
4)доброкачественные образования (аденомы) щитовидной железы
5)токсические аденомы щитовидной железы
6)кисты щитовидной железы
7)аутоиммунный тиреоидит
Формы узлового зоба: а. солитарный узловой зоб – единичный пальпируемый узел б. множественный узловой зоб – два и более изолированных узла
в. конгломератный узловой зоб – два и более спаянных между собой узла г. непальпируемый узловой зоб – размеры узла (узлов) менее 1 см, определяется по данным УЗИ щитовидной железы
Клинически пациенты с узловыми образованиями щитовидной железы часто не предъявляют никаких жалоб, а узел находится на профилактическом осмотре или при УЗИ, реже узловой зоб сопровождается чувством дискомфорта и давления в области шеи.
Диагностические исследования при узловом зобе:
1.Ультразвуковое исследование - позволяет выяснить локализацию и размеры узла, его характеристики
2.Гормональное исследование уровней:
а) ТТГ, Т4, Т3 – показано всем больным узловым зобом б) тиреоглобулина – предшественника тиреоидных гормонов (после операции по поводу рака ЩЖ при рецидивы и метастази-
ровании его содержание в крови повышается)
в) кальцитонина – повышенный уровень может служить критерией медуллярного рака
3.Пункционная биопсия ЩЖ – позволяет морфологически установить диагноз
4.Радиоизотопное сканирование ЩЖ - используется для выяснения расположения ЩЖ, ее формы, размеров, функциональной активности узлов («холодный» узел при доброкачественных и злокачественных новоообразованиях, «горячий» узел – при токсической аденоме)
5.КТ или МРТ ЩЖ – позволяет определить локализацию ЩЖ, уточнить ее контуры, размеры, структуру, плотность узлов, увеличение регионарных л.у.
Лечение узлового зоба:
а) консервативное – показано при отсутствии доброкачественной или злокачественной опухоли ЩЖ, размере узла до 3 см (препараты иода, тиреоидные гормоны и др. в зависимости от заболевания)
б) оперативное – показано при: подозрении на рак, фоликулярной аденоме ЩЖ, узле более 3 см, отрицательной динамике за период консервативного лечения пациентов (рост узла), многоузловом токсическом зобе, кисте более 3 см, аденоме ЩЖ, загрудинном узловом зобе.
Эндемический зоб - увеличение ЩЖ вследствие недостаточного поступления йода в организм пациентов, проживающих в определенных географических районах с недостаточностью йода в окружающей среде. РБ – страна с легкой и средней тяжестью по йодной недостаточности.
Предрасполагающие факторы к развитию эндемического зоба:
-генетический дефект ферментных систем щитовидной железы
-загрязнение воды и почвы солями хрома, нитратами, гуминовыми веществами, что затрудняет всасывание йода
-некоторые природные и синтетические вещества, обладающие способностью блокировать захват йодидов железой и ускоряющие высвобождение йода из железы (тиоционаты, изоционаты, цианогенные гликозиды и др.), а также вещества, блокирующие транспорт йода (перйодат, перхлорат калия)
-дефицит ряда микроэлементов, снижающий активность ферментных систем, участвующих в метаболизме йода
Патогенез эндемического зоба: дефицит йода в окружающей среды или дефекты его метаболизма в организме --> снижение концентрации тиреоидных гормонов (Т3, Т4) в крови --> увеличение продукции гипофизарного тиреотропного гормона (ТТГ) по механизму обратной связи --> активизация ТТГ имеющихся тиреоцитов, увеличение их количества с целью повышения продукции тиреоидных гормонов --> компенсаторная гиперплазия ЩЖ.
Классификация эндемического зоба:
а) по степени увеличения: 0 – зоба нет, I – размеры долей больше дистальной фаланги большого пальца, зоб пальпируется, но не виден, II – зоб пальпируется и виден на глаз
б) по форме: диффузный, узловой, смешанный (диффузно-узловой) в) по функции ЩЖ: эутиреоидный (у 70-80%), гипотиреоидный
Клиническая картина эндемического зоба:
101
-жалобы на общую слабость, утомляемость, головную боль, неприятные ощущения в области сердца (из-за функциональных расстройств нервной и сердечно-сосудистой систем даже при эутиреоидном состоянии)
-признаки сдавления прилежащих органов: чувство давления в области шеи, больше выраженное в положении лежа, затрудненное дыхание вплоть до приступов удушья, сухой кашель, затрудненное глотание и др.
-при диффузном зобе пальпируется равномерно уплотненная ЩЖ, при узловом зобе пальпируется узловое образование в ЩЖ, остальные ее отделы не увеличены и не прощупываются Осложнения эндемического зоба: сдавление пищевода, трахеи, прилежащих нервов и сосудов; развитие «зобного сердца» - гипер-
функция и расширение правых отделов сердца вследствие механического затруднения кровообращения из-за сдавления прилежащих сосудов; кровоизлияние в паренхиму щитовидной железы с последующим его обызвествлением; струмит - воспаление зобно измененной щитовидной железы, клинически сходное с подострым тиреоидитом; злокачественное перерождение зобно измененной щитовидной железы (обычно узловых форм)
Диагностика эндемического зоба:
1.Поглощение I131 ЩЖ увеличено через 24 ч более 50% (следствие дефицита йода в ЩЖ)
2.Экскреция йода с мочой снижена (менее 50 мкг/сут, в норме выше 100 мкг/л)
3.Определение уровня ТТГ, Т3, Т4 в периферической крови (в эутиреоидном состоянии Т3, Т4 в норме или повышен Т3 при тенденции к снижению Т4, ТТГ в норме, в гипотиреоидном состоянии Т3 и Т4 снижены, ТТГ повышен)
4.Определение содержания в крови тиреоглобулина (чем больше йодный дефицит, тем выше содержание тиреоглобулина в крови)
5.УЗИ ЩЖ (диффузное или узловое увеличение ЩЖ, определение размеров узлов и железы в целом; верхние границы объема ЩЖ 25 мл у мужчин и 18 мл у женщин)
7.Радиоизотопное сканирование ЩЖ (в эутиреоидном состоянии выявляет равномерное распределение изотопа и диффузное увеличение размеров ЩЖ различных степеней при диффузной форме или наличие «холодных» или «теплых» узлов при узловой форме; при развитии гипотиреоза накопление изотопа железой резко снижено)
8.Прицельная пункционная биопсия ЩЖ под контролем УЗИ
Лечение эндемического зоба:
1.Применение тиреоидных препаратов – тормозят выброс ТТГ по принципу обратной связи, уменьшая размеры ЩЖ, уменьшают аутоиммунные реакции в ЩЖ, являются средством профилактики гипотиреоза и малигнизации в эутиреоидном состоянии и средством заместительной терапии в гипотиреоидном состоянии (L-тироксин вначале по 50 мкг/сут утром до еды с постепенным повышением дозы каждые 4-5 дней до суммарной 100-200 мкг/сут, трийодтиронин вначале по 20 мкг 1-2 раза/сут с постепенным повы-
шением дозы каждые 5-7 дней до суммарной 100 мкг/сут, тиреотом – в 1 таб. 10 мкг Т3 и 40 мкг Т4, вначале по ½ таб. утром, затем дозу повышают каждую неделю до суммарной 2 таб/сут, тиреотом форте и др.). При эутиреоидном состоянии лечение длится 6-12 мес., при гипотиреоидном – пожизненно.
2.Хирургическое лечение показано при: подозрении на малигнизация, узле более 3 см, отрицательной динамике за период консервативного лечения (рост узла), загрудинном узловом зобе.
Профилактика эндемического зоба:
1.Массовая популяционная иодная профилактика путем продажи населению иодированной соли, иодированных продуктов (хлеб, кондитерские изделия и др.)
2.Групповая (лицам, перенесшим операции по поводу эндемического зоба, но находящимся в эутиреоидном состоянии, лицам, временно проживающим в районах зобной эндемии) и индивидуальная (в организованных детских коллективах, беременным и кормящим женщинам) профилактика антиструмином (1 таб. – 1 мг калия иодида, дошкольникам – по ½ таб в неделю, школьникам до 7 класса включительно – по 1 таб. в нед., старшим школьникам, беременным и кормящим матерям – по 2 таб. в неделю).
73.Гипотиреоз: классификация, этиология, патогенез, клиника, диагностика, принципы заместительной терапии.
Гипотиреоз - гетерогенный синдром, характеризующийся снижением или полным выпадением функции щитовидной железы и изменениями различных органов и систем, обусловленными недостаточным содержанием в организме тиреоидных гормонов.
Этиология гипотиреоза: 1. Первичного –обусловлен поражением самой щитовидной железы:
а) врожденного: гипоплазия или аплазия щитовидной железы; наследственно обусловленные дефекты биосинтеза тиреоидных гормонов (врожденные дефекты ферментных систем, дефекты биосинтеза тиреоглобулина)
б) приобретенного: послеоперационный (струмэктомия); лечение радиоактивным йодом и ионизирующее облучение щитовидной железы (пострадиационный гипотиреоз); воспалительные заболевания щитовидной железы (тиреоидиты, особенно аутоиммунный); недостаточное поступление йода в организм (эндемический зоб и кретинизм); воздействие лекарственных препаратов (тиреостатиков, амиодорона); неопластические процессы в щитовидной железе
2.Вторичного – обусловлен поражением гипофизарной зоны и снижением секреции тиреотропина: а) ишемия аденогипофиза вследствие обильной кровопотери во время родов или травмы б) воспалительные процессы в области гипофиза в) опухоль, исходящая из тиреотропинпродуцирующих клеток гипофиза
г) лекарственные воздействия (длительное лечение большими дозами резерпина, леводопы, парлодела) д) аутоиммунное поражение гипофиза
3.Третичного – обусловлен поражением гипоталамуса и снижением секреции тиреолиберина:
а) воспалительные процессы в области гипоталамуса б) черепно-мозговые травмы в) опухоли головного мозга
г) лекарственные воздействия (лечение препаратами серотонина)
4. Периферического – обусловлен инактивацией тиреоидных гормонов в процессе циркуляции или снижением чувствительности периферических тканей к тиреоидным гормонам (семейное снижение чувствительности рецепторов тиреоидзависимых периферических тканей к тиреоидным гормонам; избирательная резистентность к Т4 и др.)
У 95% больных – первичный гипотиреоз, в 5% случаев – остальные этиологические формы. Патогенез гипотиреоза:
Дефицит тиреоидных гормонов а) замедление синтеза и распада белка, накоплению в тканях гликопротеина муцина, гиалуроновой и хондроитинсерной кислот,
задерживающих воду и вызывающих слизистый отек тканей и органов б) замедление распада и снижение утилизации липидов гиперхолестеринемия, гипертриглицеридемия быстрое развитие и про-
грессирование атеросклероза в) уменьшение всасывания глюкозы в кишечнике, замедление утилизации глюкозы клетками снижение процессов окислительно-
го фосфорилирования и обмена глюкозы по пути гликолиза.
Все вышеперечисленное приводит к нарушению энергообразования, выраженным дистрофическим изменениям во всех органах и тканях, значительным изменениям функционального состояния нервной и эндокринной систем, изменениям электролитного обмена (гипокалиемии, гипернатриемии).
102
Патоморфология первичного гипотиреоза: атрофия железистой ткани щитовидной железы, значительное уменьшение фолликулов, разрастание фиброзной ткани, плоский фолликулярный эпителий
Клиническая картина гипотиреоза:
1. Больные предъявляют следующие жалобы:
-прогрессирующая общая и мышечная слабость, повышенная утомляемость, сонливость,
-ощущение постоянной зябкости
-увеличение массы тела, отечность лица, рук
-снижение памяти, затруднение речи
-запоры
-сухость кожи, выпадение волос
-нарушение половых функций
-изменение тембра голоса на низкий, грубый, снижение слуха (в связи с отеком евстахиевой трубы и структур среднего уха)
2.Объективно при осмотре:
-больные адинамичны, апатичны, заторможены, сонливы, медлительны
-речь замедлена, больные с трудом произносят слова; голос низкий, грубый
-кожа бледно-желтоватая (бледная из-за анемии, желтоватая из-за снижения образования витамина А из провитамина А каротина), холодная (особенно кисти, стопы), выраженное шелушение и гиперкератоз в области локтевых, коленных суставов, пяточной области
-волосы тусклые, ломкие, выпадают на голове, бровях (симптом Хертога), конечностях, растут очень медленно; ногти тонкие, легко ломаются, тусклые с продольной или поперечной исчерченностью
-лицо одутловато, с выраженным периорбитальным отеком, веки припухшие, губы утолщены
-температура тела снижена
-руки и ноги отечны (после надавливания углубления не остается)
-часто признаки гипотиреоидной миопатии – синдром Хоффмана: 1. гипертрофия проксимальных мышц; 2. мышечная слабость, болезненные мышечные спазмы; 3. скованность мышц после физической нагрузки; 4. замедленное расслабление мышц после физической нагрузки; 5. брадикардия 3. Исследование органов и систем:
а) сердечно-сосудистая система: кардиалгия вплоть до типичных приступов стенокардии; аритмии (характерна брадикардия, экстрасистолия); увеличение границ сердца (из-за миокардиодистрофии); гидроперикард (15-100 мл и более); глухость тонов сердца, интенсивный систолический шум в области верхушки сердца; ЭКГ: брадикардия, низкий вольтаж зубцов, снижение сегмента ST книзу от изолинии; нормальное или пониженное АД
б) дыхательная система: затруднение носового дыхания, вазомоторный ринит (из-за отека слизистой носа); предрасположенность к ОРВИ и пневмониям в) пищеварительная система: хроническим гастрит (снижение аппетита, чувство тяжести в эпигастрии после еды, отрыжка возду-
хом, снижение кислотности и объема желудочного сока), нарушение всасывательной способности кишечника, нарушение моторной функции ЖКТ (тошнота, рвота, выраженные запоры, в тяжелых случаях – мегаколон и паралитическая кишечная непроходимость) г) мочевыделительная система: снижение диуреза, задержка в организме жидкости и натрия (из-за уменьшения СКФ); предрасположенность к хроническому пиелонефриту д) нервная система: мононейропатии (парестезии, онемение рук, ног, снижение сухожильных рефлексов); снижение памяти, ум-
ственной работоспособности, критичности к себе и окружающим, необщительность, заторможенность, сонливость; в тяжелых случаях – депрессия, галлюцинации, бред е) эндокринная система: снижение образования кортизола и уменьшение его метаболизма; аменорея, бесплодие у женщин, отсут-
ствие полового влечения, импотенция у мужчин; инсулинзависимый СД с частыми гипогликемическими состояниями ж) система кроветворения: гипохромная анемия (из-за снижения всасывания железа в кишечнике и отсутствия стимулирующего влияния тиреоидных гормонов на эритропоэз)
Диагностика гипотиреоза:
1)OAK: гипохромная анемия, тенденция к лейкопении, лимфоцитоз, увеличение СОЭ
2)ОАМ: уменьшение диуреза, возможна протеинурия
3)БАК: увеличение содержания в крови холестерина, триглицеридов, пребета- и беталипопротеинов, снижено содержание общего белка и альбуминов
4)ЭКГ: брадикардия, низкий вольтаж зубцов, снижение интервала ST книзу от изолинии
5)ЭхоКГ: увеличение размеров сердца, признаки снижения сократительной способности миокарда, наличие гидроперикарда.
6)УЗИ щитовидной железы: уменьшение размеров при первичном гипотиреозе
7)рефлексометрия: удлинение рефлекса ахиллова сухожилия более 300 мс
8)исследование функционального состояния щитовидной железы: снижение в крови общего и свободного Т3 и Т4, снижение захвата 131I щитовидной железой, повышение тироксин-связывающей способности сыворотки; тесты со стимуляцией тиреотропином (при первичном гипотиреозе уровень тиреоидных гормонов не повышается, при вторичном и третичном – повышается) и тиреолиберином (при первичном и третичном гипотиреозе уровень тиреоидных гормонов повышается, при вторичном – не повышается). Лечение первичного гипотиреоза - заместительная терапия тиреоидными препаратами: L-тироксин / эутирокс таб. 50 и 100 мкг; трийодтиронин таб. 20 и 50 мкг; тиреотом (в 1 таб. 40 мкг Т4 и 10 мкг Т3) и тиреотом форте (в 1 таб. 120 мкг Т4 и 30 мкг Т3).
Основные принципы заместительной терапии:
-заместительная терапия проводится в течение всей жизни
-подбор доз тиреоидных препаратов должен производиться постепенно и осторожно с учетом возраста больного, сопутствующих заболеваний, степени тяжести гипотиреоза и длительности его без лечения; чем тяжелее гипотиреоз и чем дольше больные находились без заместительной терапии, тем чувствительнее организм к действию тиреоидных препаратов
-при сопутствующей ИБС начальные дозы гормонов должны быть минимальными, а их повышение должно производиться медленно под контролем ЭКГ
-назначение следующей дозы производиться лишь после проявления полного эффекта от предыдущей (для проявления полного эффекта Т3 необходимо 2,0-2,5 недели, Т4 – 4-6 недель)
-препаратом выбора для заместительной терапии является L-тироксин (среди всех препаратов обладает наименьшим кардиодепрессивным действием); начальная доза 1,6 мкг/кг 1 раз/сут (в среднем 100-125 мкг/сут, при ИБС лучше 25-50 мкг/сут), затем доза увеличивается на 25-50 мкг каждые 4 недели до полной компенсации недостаточности щитовидной железы (обычно до 100200 мкг/сут); лечение проводится под контролем Т4 и тиреотропного гормона в крови и динамики клинических проявлений
74. Гиперальдостеронизм (синдром Кона): этиология, патогенез, клиника, диагностика, лечение.
Гиперальдостеронизм - синдром, наблюдающийся при близких по клинико-биохимическим признакам, но различных по патогенезу заболеваниях, в основе которых лежит чрезмерная и независимая от ренин-ангиотензиновой системы продукция альдостерона корой надпочечников.
Этиология гиперальдостеронизма:
103
а) первичного – гиперальдостеронизм, вызванный изменениями в корковом веществе надпочечников:
-альдостеронпродуцирующая аденома коры надпочечников - альдостерома (синдром Конна)
-двусторонняя гиперплазия коры надпочечников: идиопатический гиперальдостеронизм (с неподавляемой продукцией альдостерона) и дексаметазон-подавляемый гиперальдостеронизм
б) вторичного - гиперальдостеронизм, вызванный вненадпочечниковыми опухолями: рак яичников, кишечника, щитовидной железы.
Патогенез гиперальдостеронизма:
избыточная секреция альдостерона клубочковой зоной коры надпочечников или вненадпочечниковыми образованиями избыточная секреция альдостерона усиление реабсорбции натрия в почечных канальцах, экскреция калия
1)гипернатриемия увеличение задержки воды, повышение ОЦК АГ
2)гипокалиемия гипокалиемическая нефропатия, дистрофия миокарда и скелетных мышц
Клиническая картина гиперальдостеронизма:
1. Сердечно-сосудистый синдром:
-постоянная артериальная гипертензия с сильными головными болями, болями в области сердца, снижением зрения (АД достигает высоких цифр - 220-260/120-140 мм рт. ст., но гипертонические кризы редки)
-дистрофические изменения в миокарде (аритмии, нередко брадикардия, возможно развитие ХСН), гипертрофия левого желудочка
2. Нервно-мышечный синдром:
-жалобы на быструю утомляемость, снижение работоспособности, мышечную слабость, иногда мышечные боли, параличи
-парестезии (ощущение покалывания, чувства ползания мурашек и т.д.), реже судороги
3. Синдрой калийпенической нефропатии (возникает из-за дистрофии клеток канальцев почек в результате потери калия и накопления натрия):
-выраженная жажда (полидипсия)
-полиурия, никтурия (преобладание ночного диуреза над дневным)
-развитие хронического пиелонефрита (из-за щелочной реакции мочи и снижения сопротивления почечной ткани инфекции)
Диагностика гиперальдостеронизма:
1)ОАМ: гипоизостенурия, щелочная реакция, иногда протеинурия
2)БАК: гипернатриемия, гипокалиемия; высокое содержание альдостерона в крови и снижение уровня ренина
3)ЭКГ: брадикардия, аритмии, замедление АВ проводимости, снижение интервала ST книзу от изолинии, инверсия зубца Т, удлинение интервала Q-T, патологический зубец U (гипокалиемические проявления)
4)УЗИ, КТ, МРТ надпочечников для выявления аденомы или гиперплазии надпочечников
5)сцинциграфия надпочечников с 19-йодхолестеролом, меченным 131I: ассиметрия накопления изотопа в надпочечниках при наличии опухоли
6)нагрузочные диагностические пробы - основаны на стимуляции или подавлении системы ренин-ангиотензин-альдостерон; за 10 дней до исследования отменяется вся медикаментозная терапия, в первую очередь гипотензивные (можно применять лишь клофелин и дибазол), мочегонные ЛС (верошпирон отменяют за 2-4 недели до обследования); обследуемые находятся на диете № 10 с содержанием натрия 160-180 ммоль/сут, жидкости - до 1.5 л/сут
а) проба с 1-часовой ходьбой: на фоне этой пробы у большинства здоровых и больных с АГ и вторичным гиперальдостеронизмом происходит стимуляция выработки ренина: рост его содержания в плазме крови 1 мг/мл/ч и выше; на основании этого выделяют больных со вторичным гиперальдостеронизмом Для разграничения больных первичным (опухолевым) и идиопатическим (гиперпластическим) гиперальдостеронизмом, у которых
рост содержания ренина в крови после 1 ч ходьбы остается ниже 1 мг/мл/ч, проводят дополнительные пробы:
б) проба с 4-часовой ходьбой - основана на стимулирующем воздействии ходьбы на РААС; активация РААС на фоне 4-ча- совой ходьбы приводит к возрастанию концентрации альдостерона плазмы в 1,5-2 раза у всех больных с первичным гиперальдостеронизмом за исключением лиц с альдостеромой, у которых содержание альдостерона в крови остается неизменным или снижается, так как в опухолевых клетках секреция альдостерона не зависит от РААС и АКТГ; методика: кровь на альдостерон берут в 8 ч утра натощак (больной находится в постели), затем в 12 ч после 4-х часовой ходьбы в прогулочном темпе; базальный уровень альдостерона в крови считается повышенным при величинах более 120-140 пг/мл.
в) проба с приемом натрия хлорида внутрь – у больных с первичным гиперальдостеронизмом прием натрия хлорида по 10 г/сут в течение 5 сут приводит к резкому уменьшению содержания калия в крови (применяется для выявления нормокалиемических форм заболевания)
Лечение гиперальдостеронизма:
1. Хирургическое лечение: при аденоме коры надпочечников - удаление альдостеромы или односторонняя адреналэктомия; при двусторонней гиперплазии коры надпочечников – двусторонняя адреналэктомия с пожизненной заместительной терапией кортикостероидами. Предоперационная подготовка включает:
-диета с повышенным содержанием калия и ограничением поваренной соли
-прием 10% р-ра калия хлорида по 2 столовые ложки 4 раза/сут с фруктовым соком 10 дней или 4% р-р 100 мл калия хлорида в 500 мл 5% глюкозы в/в капельно
-конкурентные антагонисты альдостерона: спиронолактон / верошпирон / альдактон 200-400 мг/сут внутрь или неконкурентные антагонисты: триамтерен 40 мг/сут внутрь
-лечение АГ: при неэффективности спиронолактона – каптоприл 12,5-75 мг/сут (потенцирует действие спиронолактона); при неэффективности ИАПФ - нифедипин 10-20 мг/сут внутрь или клофелин 0,075 мг 3 раза/сут внутрь
-с целью предупреждения острой надпочечниковой недостаточности – гидрокортизон 100-150 мг в/м накануне и в день операции; после операции вводят гидрокортизона ацетат по 30 мг в/м каждые 4-6 часов с постепенным уменьшением дозы 2. Консервативное лечение показано в случае:
-двусторонней гиперплазии коры надпочечников (как альтернатива хирургическому лечению, т.к. оно имеет успех только у 4060% пациентов с данной патологией)
-альдостеронпродуцирующей глюкокортикоидподавляемой аденомы коры надпочечников
-неоперабельной, метастазирующей карциномы надпочечника
а) калиевая диета, ограничение приема соли б) спиронолактон 200-400 мг/сут внутрь пожизненно
в) при альдостеронпродуцирующей глюкокортикоидподавляемой форме гиперальдостеронизма – дексаметазон 0,75-1 мг/сут до стойкой нормализации АД, обмена калия и секреции альдостерона
75. Хроническая надпочечниковая недостаточность: этиология, патогенез, клиника, диагностика, осложнения, течение, лечение.
Первичная хроническая надпочечниковая недостаточность (болезнь Адиссона) - недостаточность или полное прекращение функции коры надпочечников вследствие первичного их поражения патологическим процессом.
Вторичная надпочечниковая недостаточность – снижение функции коры надпочечников вследствие первичного патологического процесса в гипоталамо-гипофизарной зоне.
Классификация хронической надпочечниковой недостаточности:
104
1)по степени тяжести: легкая, средней тяжести, тяжелая
2)по состоянию компенсации: компенсированная, субкомпенсированная, декомпенсированная
3)по наличию осложнений: осложненная и неосложненная
Этиология хронической надпочечниковой недостаточности:
1.Первичная идиопатическая атрофия коры надпочечников (обусловлена продукцией IgM к коре надпочечников)
2.Туберкулезное поражение надпочечников
3.Поражение надпочечников при гемохроматозе, склеродермии, кокцидиомикозе, бластомикозе, сифилисе, бруцелезе
4.Метастазы злокачественной опухоли (рак легких, молочных желез и других органов) и лейкемическая инфильтрация надпочечников
5.Адреналэктомия (при опухолях надпочечников, при болезни Иценко-Кушинга)
6.Лечение цитостатиками с последующим токсическим поражением надпочечников
7.Длительная ГКС терапия (вызывает угнетение функции коры надпочечников по механизму обратной связи)
8.Некроз надпочечников при СПИДе.
В основе патогенеза заболевания – выпадения продукции ГКС и альдостерона, возникающее при разрушении 95% коры надпочечников (поражение мозгового вещества компенсируется продукцией катехоламинов вне надпочечников).
Клиническая картина хронической надпочечниковой недостаточности:
1. Субъективно - жалобы на:
-выраженную, постоянно прогрессирующую слабость, усталость, снижение аппетита, нарастающее похудание, пристрастие к соленой пище
-тошноту, рвоту, боли в животе различной локализации, иногда – диарею
-снижение полового чувства и потенции у мужчин, расстройство менструального цикла у женщин
2. Объективно:
-похудание различной степени, атрофия мышц, снижение мышечного тонуса и мышечной силы
-пигментация кожи и видимых слизистых оболочек:
-резко усиливается в период обострения заболевания и особенно в период криза
-цвет: от цвета загара до интенсивно-коричневого с бронзовым оттенком («бронзовая болезнь»)
-в первую очередь появляется на открытых участках тела (руки, лицо, шея), затем – и на закрытых
-может быть диффузной, однако особенно ярко выражена в местах естественной пигментации (в области половых органов, мошонки, заднепроходного отверстия, сосков молочных желез), а также в местах соприкосновения и трения кожи и одежды (в месте давления резинки от трусов, ремня, пояся), в местах кожных складок (на ладонях, животе)
-иногда может сочетаться с витилиго (обесцвеченными участками на руках, ногах, туловище, лице, спине)
-темные, коричневые пятна на слизистой щек, губ, десен, задней стенки глотки, языке («пятна легавой собаки») Сердечно-сосудистая система: артериальная гипотензия (при нарастании надпочечниковой недостаточности АД (особенно диастолическое) резко падает вплоть до неопределяемых цифр при кризе) с частыми ортостатическими обмороками; брадикардия (следствие гиперкалиемии); приглушенные тоны сердца, неинтенсивный систолический шум на верхушке и основании сердца; на ЭКГ: низкий вольтаж всех зубцов; зубец Т высокий и заостренный, с узким основанием (ширина равна ½ высоты) – проявления гиперкалиемии; признаки АВ-блокады Желудочно-кишечный тракт: в период обострения - атония желудка, неукротимая рвота, поносы; увеличение печени (из-за развития хронической дистрофии)
Мочевыделительная система: снижение клубочковой фильтрации (следствие гиповолемии и гипотензии) Половая система: атрофия половых органов, уменьшение вторичных половых признаков.
Нервно-психический статус: апатия, раздражительность, негативизм, различные парестезии, судороги (как проявление гиперкалиемии и гипогликемии).
По течению выделяют молниеносную, острую, подострую и хроническую формы болезни Адиссона.
Диагностика болезни Адиссона:
1)ОАК – проявления недостаточности ГКС (вторичная нормоцитарная анемия, лейкопения, лимфоцитоз, эозинофилия, в периоде обострения заболевания – увеличение СОЭ)
2)ОАМ: альбуминурия, цилиндрурия, увеличение выделения натрия и хлоридов, уменьшение выделения калия
3)БАК: скрытое нарушение углеводного обмена (выявляются в тесте на толерантность к глюкозе) или гипогликемия вплоть до выраженной (проявление недостаточности ГКС); гипонатриемия, гипохлоремия, гиперкалиемия (проявление дефицита альдостерона); может быть повышение креатинина и мочевины (из-за снижения СКФ)
4)исследование гормональной активности надпочечников: снижены 17-оксикортикостероиды в крови, уменьшена экскреция 17кетостероидов и 17-оксикортикостероидов мочи (показатели ГКС функции); снижен альдостерон крови
5)УЗИ и КТ надпочечников: атрофия органов, включения кальцификатов (особенно характерны при туберкулезе надпочечников) Наиболее грозное осложнение хронической надпочечниковой недостаточности – надпочечниковый криз, возникающий при резком обострении заболевания вследствие выраженного несоответствия между низким уровнем кортикостероидов в организме и повышенной потребностью в них.
Различают три варианта клинического течения надпочечникового криза:
а) сердечно-сосудистая форма – доминируют явления острой недостаточности кровообращения (бледность лица с акроцианозом, похолодание конечностей, выраженная артериальная гипотензия, нитевидный пульс, анурия, потеря сознания)
б) желудочно-кишечная форма – близка по симптоматике к острому животу (боли в животе спастического характера, постоянная тошнота, неукротимая рвота, иногда с примесью крови, диарея)
в) нервно-психическая форма – доминируют головная боль, менингеальные симптомы, судороги, очаговая симптоматика, характерны заторможенность, ступор, бред
Лечение хронической надпочечниковой недостаточности:
1.Этиотропная терапия: лечение основного заболевания, приведшего к болезни Адиссона (противотуберкулезные препараты, ГКС при системных заболеваниях соединительной ткани и т.д.)
2.Щадящий режим, исключение стрессовых ситуаций, диета: общая калорийность на 20-25% выше обычной, количество белка 1,5-2,0 г/кг; обязательно обогащение пищи витаминами; рекомендуются продукты, богатые натрием (сельдь, сыр, колбасные изделия + ежедневно 10-15 г поваренной соли дополнительно к пище), ограничиваются продукты, богатые калием (чернослив, абрикосы, апельсины, изюм, инжир, курага).
3.Заместительная терапия:
- суточная доза распределяется на отдельные приемы с учетом биологического ритма секреции ГКС надпочечниками (при трехкратном приеме утром 50% суточной дозы, в 13-14 ч – 30%, в 18-19 ч – 20%; при двукратном приеме утром 2/3, вечером 1/3 суточной дозы)
- кортизон и гидрокортизон – препараты выбора, т.к. обладают не только глюкокортикоидным, но и минералкортикоидным действием (кортизон в таб. по 0,025 г, в суспензии для в/м введения 2,5% р-р – 10 мл; для перорального приема назначают кортизон от 1,5 до 3 таб/сут, постепенно снижая дозу до поддерживающей 1-2 таб/сут; в/м по 1 мл 2-3 раза/сут)
105
- при отсутствии кортизона и гидрокортизона возможно применение других ГКС (преднизолон, метилпреднизолон, триамцинолон, дексаметазон) в сочетании с препаратами минералкортикоидного действия (масляный раствор ДОКСА 0,5% - 1 мл, в/м или п/к по 1 мл 1-2 раза/сут, таблетки ДОКСА 5 мг по 1 таб 1 раз/сут, фторгидрокортизон таб. 0,1 мг по 0,5-2 таб 1 раз/сут, альдостерон таб. 1 мг по 1 таб. 3 раза/сут)
4.Анаболические средства для компенсации недостаточности секреции андрогенов: метандростенолон (неробол) по 5 мг 3 раза/сут внутрь 1 мес., затем по 5 мг 1 раз/сут; ретаболил 5% - 1 мл в/м по 1 мл 1 раз в 2-3 недели; метиландростендиол и др.
5.Адаптогены: настойка женьщеня по 20-30 капель 3 раза/сут 1-2 мес., настойка китайского лимонника, пантокрин, настойка аралии, настойка заманихи и др.
6.Ферментная терапия для улучшения процессов пищеварения: панзинорм по 1-2 таб 3 раза/сут, фестал по 1-2 таб 3 раза/сут во время еды в течение месяца
Лечение надпочечникового криза:
1.Заместительная терапия: гидрокортизона гемисукцинат или гидрокортизона фосфат 100 мг в/в, затем в течении суток 300-400 мг в/в капельно
2.Борьба с дегидратацией и гипогликемией: 5% р-р глюкозы, раствор Рингера, изотонический раствор натрия хлорида в/в капельно (в первые сутки вводится 3-4 л жидкости, причем 2 л – в первые 2 часа)
3.Восстановление нарушенного электролитного баланса: устранение гипонатриемии путем добавления к вводимому изотоническому раствору натрия хлорида 20-30 мл 10% р-ра натрия хлорида, питья подсоленной воды (10 г натрия хлорида на 1 л кипяченой воды); устранение гиперкалиемии: 30-40 мл 40% глюкозы в/в или 20 мл 10% р-ра кальция глюконата в/в
4.Коррекция нарушений белкового обмена: 200 мл 20% р-ра альбумина, 400 мл свежезамороженной плазмы в/в капельно
5.Коррекция гемодинамики: если эффект от заместительной терапии, инфузий кристаллоидов и коллоидов недостаточный – допмин в/в капельно (80 мг в 400 мл 5% р-ра глюкозы в/в капельно со скоростью 15-30 капель/мин)
76.Болезнь и синдром Иценко-Кушинга: этиология, патогенез, клиника, диагностика, осложнения, течение, лечение.
Болезнь Иценко-Кушинга – гипоталамо-гипофизарное заболевание, характеризующееся избыточной секрецией кортикотропина с последующей двусторонней гиперплазией надпочечников и их гиперфункцией (гиперкортицизмом).
Синдром Иценко-Кушинга – ряд заболеваний коры надпочечников, сопровождающихся их гиперфункцией.
Этиология болезни Иценко-Кушинга окончательно не установлена, в большинстве случаев выявляется базофильная аденома гипофиза (в 90% - микроаденома, в 10% - макроаденома) или гиперплазия базофильных клеток гипофиза, продуцирующих кортикотропин, возникающие на фоне действия предрасполагающих факторов: ЧМТ, энцефалитов, арахноидитов, родов и беременности. В основе синдрома Иценко-Кушинга – опухоль коры надпочечников (кортикостерома, кортикобластома, юношеская дисплазия коры надпочечников).
Патогенез болезни Иценко-Кушинга:
Ослабление нейромедиаторного гипоталамического контроля за секрецией кортиколиберина нарушение суточного ритма секреции кортиколиберина и механизма обратной регуляции его продукции постоянно повышенная секреция кортиколиберина аденома или гиперплазия гипофиза гиперсекреция кортикотропина двусторонняя гиперплазия коры надпочечников повышение секреции кортикостероидных гормонов гиперкортицизм, сопровождающийся развитием следующих синдромов: а) диспластическое ожирение б) энцефалопатия в) вторичный иммунодефицит г) трофические нарушения кожи д) симптоматический сахарный диабет е) системный остеопороз ж) нарушения половой функции з) миопатия и) артериальная гипертензия
Клиническая картина болезни (синдрома) Иценко-Кушинга:
1. Субъективно жалобы на:
-развитие ожирения
-нарушение сна, головные боли, выраженную общую слабость, слабость мышц
-появление красных полос растяжения на коже живота, груди, бедер
-сухость кожи, выпадение волос на голове, избыточное оволосение на лице и теле
-снижение либидо и потенции у мужчин, нарушение менструального цикла у женщин
-боли в костях позвоночника
-жажду (при развитии сахарного диабета) 2. Объективно при осмотре:
-диспластическое перераспределение подкожной жировой клетчатки с избыточным отложением в области плечевого пояса, груди, живота, шейного отдела позвоночника («климактерический горбик»), лица («лунообразное» круглое лицо), при этом руки и ноги остаются относительно тонкими, ягодицы уплощенными
-сухость, истонченность, «мраморность» кожи, гнойничковые высыпания различной локализации
-лицо багрово-красное, у женщин избыточный рост волос на лице («усы», «борода», «бакенбарды»), угревая и гнойничковая сыпь
-стрии (широкие полосы растяжения красновато-фиолетового, багрового цвета) в подмышечных впадинах, в области грудных желез, бедер, нижних и боковых отделов живота
-петехии и кровоподтеки на коже плеч, предплечий, на передней поверхности голеней
-выпадение волос на голове у женщин и мужчин; избыточный рост волос у женщин в области бедер, голеней
-уменьшение выраженности вторичных половых признаков у мужчин, гинекомастия
-снижение тонуса и силы мышц, их атрофия
Сердечно-сосудистая система: артериальная гипертензия (из-за избытка ГКС + гипернатриемии из-за гиперальдостеронизма) с головными болями, головокружениями, зрительными нарушениями; признаки стероидной кардиопатии (ослабление I тона на верхушке, негромкий систолический шум над всеми точками аускультации)
Дыхательная система: предрасположенность к бронхитам, пневмониям (из-за вторичного иммунодефицита)
Пищеварительная система: частые гингивиты, кариес, хронический гастрит с повышением секреторной функции, иногда – «стероидные» язвы желудка и ДПК Мочевыделительная система: возможно развитие мочекаменной болезни (из-за гиперкальциемии и гиперкальциурии), хронического пиелонефрита.
Половая система: у женщин – частые кольпиты, гипоплазия матки, аменорея; у мужчин – гинекомастия, изменение консистенции и уменьшение размеров яичек, предстательной железы, импотенция.
Костно-суставная система: стероидный остеопороз с поражением в первую очередь позвоночника (боли, патологические переломы, снижение роста).
Выделяют быстро прогрессирующее течение заболевания (стремительное нарастание синдромов гиперкортицизма от 3 до 6 мес) и торпидное течение (сравнительно медленное развитие гиперфункции коры надпочечников).
Осложнения болезни (синдрома) Иценко-Кушинга: декомпенсация сердечной деятельности, остеопороз с множественными компрессионными переломами тел позвонков и переломами ребер, нагноительные процессы с возможным развитием септикопиемии, тяжелые пиелонефрит с развитием ХПН, стероидный психоз и др.
Диагностика болезни (синдрома) Иценко-Кушинга:
1. Лабораторные данные:
106
а) OAK: повышение уровня гемоглобина, эритроцитоз, лейкоцитоз со сдвигом влево, нейтрофиллез, лимфопения, эозинопения, увеличение СОЭ.
б) ОАМ: глюкозурия, протеинурия, лейкоцитурия в) БАК: гипокалиемия, гипернатриемия, гиперфосфатемия, повышение уровня общего и ионизированного кальция, активности ще-
лочной фосфатазы, умеренная гиперхолестеринемия, повышение содержания β-липопротеинов, триглицеридов, снижение общего количества белка, высокий протромбиновый индекс
г) иммунограмма крови: уменьшение концентрации IgM и IgG, снижение фагоцитарной активности нейтрофилов, абсолютного числа Т-лимфоцитов, содержания сывороточного и лейкоцитарного интерферона д) исследование уровня гормонов в крови: гипоталамо-гипофизарная система - повышение секреции кортиколиберина, кортико-
тропина; гипофизарно-надпочечниковая система – повышение в крови кортизола, кортикостерона утром (в 7-9 ч) и вечером (в 2224 ч), т.е. извращение суточного ритма секреции ГКС, повышение суточной экскреции с мочой 17-ОКС, 17-КС, дегидроэпиандростерона; гипофизарно-гонадная система: снижение содержания в крови гонадотропинов, тестостерона у мужчин, снижение эстрадиола, повышение тестостерона - у женщин; кальцийрегулирующие гормоны - повышение содержания в крови паратгормона, снижение кальцитонина е) функциональные тесты:
1)большая проба с дексаметазоном: препарат принимают по 2 мг через 6 часов двое суток, затем определяют суточную экскрецию с мочой свободного кортизола и 17-ОКС и сравнивают результаты с величинами до пробы; при болезни ИценкоКушинга экскреция свободного кортизола и 17-ОКС с мочой снижается по сравнению с исходной на 50% и более (по принципу обратной связи); при синдроме Иценко-Кушинга экскреция сво-
бодного кортизола и 17-ОКС не снижается (т.к. кортикостерома способна автономно секретировать кортизол)
2)проба со стимуляцией коры надпочечников синактеном-депо (АКТГ):
-малый тест: в 8 ч утра вводят 250 мкг синактена в/м и через 30 и 60 мин определяют содержание кортизола и 17-ОКС в крови; в норме и при болезни Иценко-Кушинга содержание в крови кортизола и 17-ОКС возрастает в 2 и более раз, при синдроме
–нет
-большой тест – проводится при отсутствии ответа на малый тест: в 8 ч утра вводят 1 мг синактена в/м внутримышечно и определяют содержание в крови кортизола и 17-ОКС через 1, 4, 6, 8, 24 ч; при болезни Иценко-Кушинга величины этих показателей увеличиваются, при синдроме - нет.
2. Инструментальные исследования:
а) ЭКГ: признаки гипокалиемии, гипертрофии миокарда левого желудочка б) УЗИ, КТ или МРТ надпочечников: диффузное или диффузно-узелковое увеличение надпочечников (более 3 см по высоте).
в) УЗИ почек и органов брюшной полости: признаки хронического пиелонефрита, жирового гепатоза, липоматоза поджелудочной железы, конкременты в почках.
г) визуализация гипофиза с помощью краниографии (остеопороз костей черепа и спинки турецкого седла, признаки внутричерепной гипертензии, увеличение размеров турецкого седла), КТ / МРТ (аденома гипофиза)
д) нейрофтальмологическое исследование: сужение полей зрения (при наличии аденомы гипофиза), явления застоя на глазном дне, гипертоническая ангиопатия е) рентгенологическое исследование костей: остеопороз костей аксиального скелета, периферических отделов, асептический не-
кроз головок бедренных костей у отдельных больных; при тяжелой форме болезни - компрессионные переломы тел позвонков грудного и поясничного отделов позвоночника
Лечение болезни Иценко-Кушинга:
1. Патогенетическая терапия с целью нормализации нарушенных гипофизарно-надпочечниковых взаимоотношений:
а) лучевая терапия: гамма-терапия (фракционная методика облучения в дозе 1,5-1,8 Гр 5-6 раз в неделю до суммарной дозы 4050 Гр) и протонное облучение гипофиза (суммарная доза 80-100 Гр)
б) хирургическое лечение: трансфеноидальная (при наличии микроаденомы гипофиза) или трансфронтальная (при наличии макроаденомы гипофиза) аденомэктомия; двусторонняя адреналэктомия (показана при тяжелой форме болезни и прогрессировании осложнений гиперкортицизма); деструкция надпочечников путем введения в них контрастного вещества или этанола + последующая пожизненная заместительная терапия кортикостероидами в) медикаментозная терапия:
1.препараты, подавляющие секрецию кортикотропина: парлодел (бромэргокриптин) - начальная доза 0,5-1,0 мг/сут, постепенно ее повышают до 5,0-7,5 мг/сут в течение 10-15 дней, затем поддерживающая доза 2,5-5,0 мг 6-24 мес; перитол (ципрогептадин) 8-24 мг/сут; ГАМК; аминалон (гамма-аминомасляная кислота)
2.блокаторы стероидогенеза в надпочечниках: хлодитан 2-4 г/сут до нормализации функции надпочечников, затем поддерживающая доза 1-2 г/сут в течение 6-12 мес (блокирует биосинтез кортикостероидов и вызывает деструкцию коры надпочечников); аминоглютетимид 0,75-1,5 г/сут (блокирует биосинтез кортикостероидов)
2.Симптоматическая терапия: гипотензивные препараты (оптимально адельфан – резерпин + апрессин; адельфан-эзидрекс – адельфан + гипотиазид, трирезид К – резерпин + апрессин + гипотиазид + калия хлорид); лечение стероидной кардиопатии и гипокалиемии (препараты калия, калиевая диета, анаболические стероидные средства); лечение стероидного сахарного диабета (диета № 9, пероральные гипогликемизирующие средства); лечение остеопороза (препараты кальция с кальцитонином, препараты витамина D)
При синдроме Иценко-Кушинга показано оперативное удаление пораженного надпочечника с последующей временной заместительной терапией до восстановления функции другого надпочечника.
77.Феохромоцитома: патогенез основных клинических проявлений, симптоматика, диагностика, лечение.
Феохромоцитома (ФХЦ) - гормонально-активная опухоль из мозгового слоя надпочечников и вненадпочечниковой хромаффинной ткани, секретирующая катехоламины.
Локализация феохромоцитомы: в 85-90% случаев – в надпочечниках (чаще в правом); вненадпочечниковые ФХЦ расположены в симпатической цепочке по ходу брюшной аорты, в органе Цукеркандля (хромаффинная ткань впереди брюшной аорты), в области нижней мезентериальной артерии, в грудной полости, в области мочевого пузыря, головы, шеи и др.
Патогенез: ФХЦ секретирует катехоламины (преимущественно норадреналин, в меньшей степени адреналин и дофамин), в редких случаях вырабатываются серотонин, соматостатин, кортикотропин и др. гормонально-активные вещества. Адреналин секретируется только ФХЦ надпочечников, норадреналин – ФХЦ надпочечников и вненадпочечниковой хромаффинной тканью.
Основные клинические проявления феохромоцитомы обусловлены воздействием КА (норадреналина, адреналина, дофамина) на рецепторы органов-мишеней:
1.увеличение силы и частоты сердечных сокращений (b1-Ар), сужение сосудов кожи и внутренних органов ( -Ар) синдром арте-
риальной гипертензии, кардиальный синдром (одышка, сердцебиения, явления сердечной астмы)
2.влияние КА на рецепторы головного мозга нейропсихический синдром (нервная возбудимость, повышенная утомляемость, головные боли, парестезии)
3.раслабление цилиарной мышцы (b-Ар), активация апокриновых потовых желез ( -Ар) нейровегетативный синдром (наруше-
ние потоотделения, ознобоподобный тремор, расширение зрачков)
107
4.раслабление ГМК стенок ЖКТ ( 2, b2-Ар), сокращение ГМК сфинктеров ( 1-Ар) желудочнокишечный синдром (боли в животе, тошнота, рвота)
5.стимуляция в печени глюконеогенеза и глюкогенолиза ( /b2-Ар), липолиза в жировых клетках (b3-Ар), выделение ренина в клет-
ках юкста-гломерулярного аппарата почек (b1-Ар) эндокриннообменный синдром (симптоматический сахарный диабет, снижение
половой функции)
Классификация феохромоцитомы:
а) бессимптомная ФХЦ:
1)немая форма – клинически при жизни больного не проявляется
2)скрытая (шокогенная) форма – проявляется в виде шока или гипертонического криза при чрезвычайном физическом или психоэмоциональном напряжении больного
б) клинически выраженная ФХЦ:
1)с характерной клинической симптоматикой: пароксизмальная форма; постоянная форма; смешанная форма
2)с нехарактерной клинической картиной (замаскированная форма)
По нарушению функций других органов: с нарушением функции (с осложнениями) и без нарушения функции других органов.
Характеристика основных клинических форм ФХЦ:
1) пароксизмальная форма – проявляется феохромацитомовыми (адреналовыми) кризами – резким утяжелением течения феохромоцитомы, обусловленного массивным и быстрым выделением опухолью КА и поступлением их в кровь. Развитие криза провоцируют: переохлаждение; физическое и эмоциональное перенапряжение; резкие движения с чрезмерным разгибанием спины или наклоном туловища в сторону опухоли; травма поясничной области; глубокая пальпация живота в проекции феохромоцитомы; курение и прием алкоголя; прием инсулина, гистамина, симпатомиметиков; обильная еда; смех, чихание. Частота кризов различна: от 5-15 в день до одного в течение нескольких месяцев, продолжительность – чаще всего несколько минут (хотя может быть и несколько часов-дней)
Клинически характерно:
-внезапное начало (реже бывают предвестники – чувство жара, онемение рук и ног, головокружение)
-общее беспокойство больных, чувство страха, раздражительность, тремор, потливость, сердцебиения
-бледность кожи лица или выраженное покраснение, блеск глаз, расширение зрачков
-интенсивная головная боль, боли в области сердца сжимающего характера, нередко боли в области живота неопределенной локализации, боли в поясничной области
-снижение зрения или даже временная его потеря
-поллакиурия (учащенное мочеиспускание)
-судорожное сведение мышц верхних конечностей
-частый пульс (до 160-170 ударов в минуту), реже - брадикардия, иногда экстрасистолы
-АД значительно повышено (систолическое до 200-300, диастолическое – до 180 мм рт.ст.)
-возможно значительное повышение температуры тела (иногда до 40 °С)
-гипергликемия, лейкоцитоз крови, увеличение содержания в крови КА и повышенная экскреция КА с мочой
Возможные осложнения криза: фибрилляция желудочков, геморрагический инсульт, ОЛЖН с отеком легких и др.
Криз заканчивается так же внезапно, как и начинается, нормализацией АД. По окончанию криза - профузное потоотделение, гиперсаливация, полиурия до 3-5 л светлой мочи с низкой относительной плотностью, общая слабость, разбитость.
2)постоянная форма – постоянная стойкая АГ без кризов, трудно отличимая от эссенциальной АГ (однако при ФХЦ больные, как правило, худеют, эффект от проводимой гипотензивной терапии отсутствует).
3)смешанная форма – на фоне постоянно повышенного АД возникают типичные кризы.
Диагностика феохромоцитомы:
1. Диагностические тесты для выявления ФХЦ:
а) новые методики: определение содержания КА в тромбоцитах; определение количества β-рецепторов лейкоцитов; определение нейропептида I в сыворотке; определение хромогранинов А и А+В в сыворотке; определение простагландина 6-кето-PgF1 в сыворотке и др.
б) проба с клофелином – проводится при подозрении на ФХЦ, если содержание КА в крови и их экскреция с мочой нормальные; больной принимает внутрь 0,3 мг клофелина, до и через 3 ч после приема ЛС берут венозную кровь и определяют в ней содержание КА; при зссенциальной гипертензии оно снижается, при ФХЦ — нет (т.к. клофелин, действуя на центральные 2-адреноре- цепторы, снижает содержание КА в крови; феохромацитома функционирует автономно и снижения КА не происходит)
в) проба с гистамином – проводится только на фоне нормального АД; у больного в положении лежа измеряется АД и вводится в/в 0,5 мг гистамина в 2 мл физ. р-ра; АД измеряется каждые 30 с в первые 5 минут и каждую минуту еще в течение 5 минут; в норме на 30-й секунде после введения гистамина отмечается снижение САД и ДАД на на 5-15 мм рт. ст.; при повышении цифр САД на 80 мм, ДАД на 50 мм рт. ст. в течение первых 2 минут указывает на ФХЦ.
г) проба с тропафеном – проводится при исходно повышенном АД; больному в/в вводят 1 мл 1% или 2% р-ра тропафена; снижение АД на 25-40 мм рт. ст. в течение 5 минут указывает на ФХЦ.
2. Лабораторные данные:
а) OAK: лейкоцитоз, лимфоцитоз, эозинофилия, эритроцитоз, увеличение СОЭ б) ОАМ: возможны глюкозурия, протеинурия в) БАК: гипергликемия, увеличение содержания свободных жирных кислот
г) повышение содержания в крови КА (адреналина, норадреналина), увеличение экскреции с мочой КА и их метаболитов (гомованилиновой и ванилилминдальной кислот), особенно во время криза и вскоре после него.
3. Инструментальные данные:
а) ЭКГ: укорочение интервала PQ, признаки гипертрофии миокарда ЛЖ, возможны явления ишемии миокарда, экстрасистолическая аритмия, пароксизмальная тахикардия б) УЗИ, КТ, МРТ надпочечников: опухолевидное образование в одном (чаще) или в обоих (реже) надпочечниках.
в) сцинциграфия надпочечников с метилйодбензилгуанидином (веществом, напоминающим по молекулярной структуре норадреналин) – выявляет множественные и метастатические ФХЦ различной локализации
Лечение ФХЦ:
1. Хирургическое лечение: удаление опухоли вместе с остатками ткани надпочечников; при двустороннем поражении показана двусторонняя адреналэктомия с последующей пожизненной заместительной терапией кортикостероидами; в предоперационном периоде больному обеспечивается психоэмоциональный покой, исключаются все провоцирующие кризы факторы, назначаются -ад-
ренолитики (фентоламин по 25-50 мг внутрь 3 раза/сут после еды).
2. При наличии стабильной ФХЦ – постсинаптические 1-адренолитики (празозин начальная доза 0,5-1,0 мг 3 раза/сут, оптималь-
ная 6-15 мг/сут)
3. Купирование адреналового криза: а) поднять головной конец кровати
108

б) в/в -адренолитик (фентоламин 2-4 мг в 10 мл физ. р-а в/в струйно или 1-2 мл 2% р-ра тропафенона в 10 мл физ. р-ра каждые 5 мин до снижения АД), затем переходят на пероральный прием препарата (празозин 6-15 мг/сут, пирроксан 15-30 мг 3 раза/сут) в) при выраженной тахикардии – b-адреноблокаторы (анаприлин / обзидан 1-2 мл 0,1% р-ра в 10 мл физ. р-ра в/в с последующим пероральным приемом препарата по 20-40 мг 3 раза/сут)
г) если криз не купируется в течение 2-3 часов – показана экстренная операция – удаление ФХЦ (в связи с опасностью возникновения «катехоламинового шока» с неуправляемой гемодинамикой и гибелью больного)
РЕВМАТИЧЕСКИЕ БОЛЕЗНИ
78. Острая ревматическая лихорадка: этиология, патогенез, клиника, диагностика, лечение. Медико-социальная экспертиза. Реабилитация. Первичная, вторичная и текущая профилактика.
Острая ревматическая лихорадка (ОРЛ) – токсико-иммунологическое системное воспалительное заболевание с преимущественной локализацией процесса в различных оболочках сердца, развивающееся у предрасположенных к нему лиц (чаще в возрасте 7-15 лет) в срок от 2 до 6 недель после перенесенной острой инфекции, вызванной b-гемолитическим стрептококком группы А.
Эпидемиология: пороки сердца вследствие хронической ревматической болезни – наиболее частая причина болезней сердца до 40 лет; заболеваемость в РБ в 2002 г. – 210, в 2003 г. – 69 случаев, в общей популяции – 0,1-0,3%; смертность 100-150 на 100 000.
Этиология ОРЛ.
β-гемолитический стрептококк группы А – различают более 100 серотипов по М-протеину клеточной стенки, ревматогенными яв - ляются штаммы М5, 6, 18, 19, 24.
Патогенез ОРЛ.
В развитии ОРЛ играют роль внешний фактор (перенесенный тонзиллит, фарингит, стрептококковый шейный лимфаденит) и внутренние (предрасполагающие) факторы: недостаточность питания, переохлаждение, молодой возраст, наследственная предрасположенность (антигены HLA B5, DR2, DR4). При ОРЛ различают:
1.Латентный период (2-4 недели) – характеризуется токсическим повреждением органов и тканей; стрептококк вырабатывает вещества, способные подавлять фагоцитоз, поражать лизосомальные мембраны, повреждать основное вещество соединительной ткани (М-протеин, пептидогликан, стрептолизин О- и S-, гиалуронидаза, стрептокиназа, дезоксирибонуклеаза и др.).
2.Иммунная фаза – между антигенами стрептококка (М-протеином) и тканями суставов и сердца существует антигенная общность (явление молекулярной мимикрии), вследствие чего запускается выработка аутоантител к сердечному тропомиозину и миозину, к гликопротеинам и протеогликанам соединительной ткани. Иммунный воспалительный процесс вызывает дезорганизацию соединительной ткани, морфологически протекающую в несколько стадий: мукоидное набухание, фибриноидное набухание, фибриноидный некроз и формирование вокруг его очагов специфических ашофф-талалаевский гранулем, склероз.
Клинические
варианты
ОРЛ Повторная ОРЛ
|
Классификация ОРЛ (Минск, 2003): |
|
|
|||
Клинические проявления |
Степень активности |
Исход |
ФК ХСН |
|||
Основные |
Дополнительные |
по NYHA |
||||
|
|
|
||||
Кардит |
Лихорадка |
1 |
– минимальная |
Выздоровление |
0 |
|
Артрит |
Артралгии |
2 |
– умеренная |
ХРБС: |
1 |
|
Хорея |
Серозиты |
3 |
– высокая |
- без порока сердца |
2 |
|
Кольцевидная эритема |
Абдоминальный син- |
|
|
- порок сердца |
3 |
|
Ревматические узелки |
дром |
|
|
|
4 |
|
Клиника ОРЛ (“ревматизм лижет суставы и кусает сердце”).
1.Начинается спустя 1-2 недели чаще в детском или подростковом возрасте после перенесенного стрептококкового фарингита или ангины. Характерен 1-3-х недельный латентный период с бессимптомным течением или легким недомоганием, субфебриллитетом, артралгиями, после которого появляется выраженная клиническая картина заболевания.
2.Ревмокардит – воспаление всех или отдельных слоев стенки сердца; чаще протекает в виде эндомиокардита, реже – панкардита; признаки миокардита доминируют, затушевывая признаки эндокардита.
а) диффузный миокардит:
- тяжелое общее состояние, акроцианоз, выраженная одышка, сердцебиения, перебои, боли в области сердца, появление кашля при физической нагрузке, в тяжелых случаях – сердечная астма и отек легких - пульс частый, нередко аритмичный
- границы сердца расширены, преимущественно влево, тоны приглушены, возможны ритм галопа, систолический шум в области верхушки сердца - в нижних отделах легких – мелкопузырчатые хрипы, крепитация (при застое в малом круге кровообращения)
- увеличение и болезненность печени, асцит, отеки на ногах (при застое в большом круге кровообращения) б) очаговый миокардит:
- удовлетворительное общее состояние, неинтенсивные боли в области сердца, иногда ощущение перебоев - границы сердца нормальные, тоны несколько приглушены, на верхушке – неинтенсивный систолический шум - признаки недостаточности кровообращения отсутствуют в) эндокардит:
- более выраженная потливость, длительное повышение температуры тела - признаки тромбоэмболического синдрома
- аускультативно особый бархатный тембр I тона, усиление систолического шума в области верхушки сердца и появление диастолического шума в области верхушки сердца или аорты (признак формирования порока сердца: «порок сердца есть памятник уга-
сшему эндокардиту»).
Первичный ревмокардит характеризуется следующими диагностическими признаками:
1)молодой возраст больного (чаще детский или подростковый)
2)хронологическая связь с стрептококковой инфекцией глотки (фарингит, ангина)
3)латентный период 2-4 недели между окончанием последнего эпизода носоглоточной инфекции и началом ОРЛ
4)преимущественно острое или подострое начало с повышением температуры тела, полиартритом или острыми артралгиями в дебюте заболевания
5)аускультативные и функциональные признаки кардита
6)сдвиги острофазовых воспалительных и иммунологических тестов
7)положительная динамика клинических и параклинических показателей под влиянием противоревматического лечения
8)наличие вальвулита в сочетании с миокардитом или перикардитом
9)коррелляция лабораторных и клинических признаков активности болезни
Исход ревмокардита определяется частотой формирования пороков сердца (20-25% всех случаев ОРЛ).
Возвратный ревмокардит проявляется симптомами первичного на фоне уже сформировавшихся пороков сердца, о чем клинически свидетельствует появление новых шумов в сердце.
Диагностика ревмокардита.
а) диагностические критерии:
1.Боли или неприятные ощущения в области сердца.
2.Одышка.
109

3.Сердцебиения.
4.Тахикардия.
5.Ослабление I тона на верхушке сердца.
6.Шум на верхушке сердца: • систолический (слабый, умеренный или сильный) • диастолический.
7.Симптомы перикардита.
8.Увеличение размеров сердца.
8.Ревматические и системные заболевания соединительной ткани
9.ЭКГ-данные: удлинение интервала P-Q; экстрасистолия, ритм атриовентрикулярного соединения; другие нарушения ритма.
10.Симптомы недостаточности кровообращения.
11.Снижение или потеря трудоспособности.
При наличии у больного 7 из 11 критериев диагноз кардита считается достоверным.
б) лабораторные данные: OAK: увеличение СОЭ, лейкоцитоз, сдвиг лейкоцитарной формулы влево; БАК: повышение уровня 2- и
γ-глобулинов, серомукоида, гаптоглобина, фибрина, аспарагиновой трансаминазы; ОА мочи: нормальный или небольшая протеинурия, микрогематурия; ИИ крови: снижено количество Т-лимфоцитов, снижена функция Т-супрессоров, повышен уровень иммуноглобулинов и титров антистрептококковых антител, появляются ЦИК и СРП.
в) инструментальные данные:
1) ЭКГ: замедление AV-проводимости, снижение амплитуды зубца Т и интервала S-T в прекордиальных отведениях, арит-
мии.
2)Эхо-КГ: при вальвулите митрального клапана - утолщение и «лохматость» эхо-сигнала от створок и хорд клапана, ограничение подвижности задней створки клапана, уменьшение систолической экскурсии сомкнутых митральных створок, небольшое пролабирование створок в конце систолы; при вальвулите аортального клапана - мелкоамплитудное дрожание митральных створок, утолщение эхо-сигнала от створок аортального клапана.
3)ФКГ: при миокардите - снижение амплитуды I тона, его деформация, патологические III и IV тоны, систолический шум, занимающий 1/2-2/3 систолы, убывающий и примыкающий к I тону; при эндокардите - высокочастотный систолический шум, который усиливается в ходе динамического наблюдения, протодиастолический или пресистолический шум на верхушке при формировании митрального стеноза, протодиастолический шум на аорте при формировании недостаточности клапана аорты, ромбовидный систолический шум на аорте при формировании сужения устья аорты.
3.Ревматический полиартрит – в его основе лежит острый синовит; проявляется симметричными болями в крупных и средних суставах (чаще коленных и голеностопных) летучего характера, припухлостью и гиперемией кожи в области суставов, резким ограничением движений. Характерен быстрый купирующий эффект НПВС и отсутствие остаточных суставных явлений.
4.Ревматическое поражение легких – проявляется клиникой легочного васкулита и пневмонита: крепитация и мелкопузырчатые хрипы в легких, множественные очаги уплотнения на фоне усиления легочного рисунка; характерен положительный эффект от терапии ГКС, АБ не помогают
5.Ревматический плеврит – проявляется клиникой типичного плеврита, характерен быстрый положительный эффект от антиревматической терапии.
6.Ревматическое поражение почек – проявляется картиной нефрита с изолированным мочевым синдромом.
7.Ревматический перитонит – боли в животе различной локализации и интенсивности, тошнота, рвота, иногда напряжение мышц живота; быстро купируется при антиревматическом лечении
8.Нейроревматизм – проявляется церебральным ревмоваскулитом, энцефалопатией (снижение памяти, головная боль, эмоциональная лабильность, преходящие нарушения черепномозговых нервов), гипоталамическим синдромом (вегетососудистая дистония, длительная субфебрильная температура тела, сонливость, жажда, вагоинсулярные или симпатоадреналовые кризы), малой хореей.
Малая хорея чаще развивается у девочек 6-15 лет, характерно постепенное начало, ребенок становится плаксивым, вялым, раздражительным, затем развивается характерная пентада признаков:
1)гиперкинезы – беспорядочные, насильственные движения различных мышечных групп (мышц лица, шеи, конечностей, туловища), что сопровождается гримасничаньем, вычурными движениями, нарушением почерка, невнятностью речи; ребенку трудно есть, пить (он роняет кружку, не может донести ложку ко рту, не расплескав суп). Гиперкинезы чаще двусторонние, усиливаются при волнениях, исчезают во время сна. Ребенок не может выполнить координационнуюпальценосовую пробу.
2)мышечная дистония с выраженным преобладанием гипотонии вплоть до дряблости мышц (при ослаблении гиперкинезов). Резкая мышечная гипотония может привести даже к ликвидации гиперкинезов и развитию «паралитической» формы хореи. Характерен симптом «дряблых плеч» - при поднимании больного за подмышки голова глубоко погружается в плечи.
3)нарушение статики и координации при движениях (пошатывание при ходьбе, неустойчивость в позе Ромберга).
4)выраженная сосудистая дистония
5)психопатологические проявления.
9.Ревматизм кожи и подкожной клетчатки - проявляется кольцевидной эритемой (бледно-розовые, кольцевидные высыпания в области туловища, голеней), подкожными ревматическими узелками (округлые,плотные, безболезненные узелки в области разгибательной поверхности коленных, локтевых, плюснефаланговых, пястно-фаланговых суставов), которые не беспокоят больных и быстро исчезают при лечении
Диагностика. 1. Доказательства предшествовавшей А-стрептококковой инфекции:
а) позитивная культура из зева – берутся 3 последовательные культуры до начала антибиотикотерапии б) серологические реакции: антитела к антистрептолизину-О – образцы сывороток забираются в течение острой фазы и
через 2 недели; титры антигиалуронидазы, дезоксирибонуклеазы β, стрептозана.
2.ОАК: признаки воспалительного процесса
3.БАК: реактанты острой фазы воспаления (С-реактивный протеин, серомукоид, общий белок и белковые фракции), повышение КФК, КФК-МВ, АсАТ, АлАТ
4.Рентгенография органов грудной клетки: позволяет выявить кардиомегалию
5.ЭКГ в динамике
6.Эхо-КГ
|
Модифицированные критерии Джонса для диагностики ОРЛ: |
Большие критерии |
Малые критерии |
Кардит |
Клинические: |
Артрит |
Артралгия |
Хорея |
Лихорадка |
Кольцевидная эритема |
Абдоминальный синдром и др. серозиты |
Подкожные ревматические узелки |
Лабораторные: |
|
Ускоренная СОЭ |
|
Повышенный СРБ |
110

Инструментальные: Удлиненный PR на ЭКГ
Признаки митральной или аортальной регургитации на ЭХО-КГ Данные, подтверждающие предшествующую А-стрептококковую инфекцию:
повышенные или повышающиеся титры противострептококковых антител (АСЛ-О > 250)
позитивная А-стрептококковая культура, выделенная из зева или положительный тест быстрого определения А-стрепто- коккового антигена Наличие 2 больших или 1 большого и 2 малых критериев в сочетании с данными, подтверждающими инфекцию β-гемолитическим
стрептококком группы А, свидетельствует о высокой вероятности ОРЛ.
(!)Необходимо помнить:
-позитивная А-стрептококковая культура, выделенная из зева больного, может быть как доказательством активной инфекции, так и свидетельством бессимптомного носительства данного микроба
-негативные результаты микробиологического исследования, как и отрицательные данные теста быстрого определения антигена, не исключает активную А-стрептококковую инфекцию
-диагностическая значимость исследования противострептококкового иммунитета повышается при одновременном определении нескольких типов антител (АСЛ-О, АСК, АСГ, АДРН-В);
-при вялотекущем ревмокардите или «изолированной» хорее титры противострептококковых антител могут быть нормальными;
-повышение уровня перечисленных антител может наблюдаться после глоточных инфекций, вызванных β-гемолитическими стрептококками групп C или G, не имеющими отношения к ОРЛ.
Лечение ОРЛ.
1.Постельный режим при остром процессе на 2-3 недели
2.Диета: ограничение соли, увеличение доли белка, уменьшение доли легкоусваиваемых углеводов.
3.Этиотропная терапия: препараты выбора – пенициллин 500 000 ЕД в/м 4 раза в сутки 10 дней; бензил-пенициллин G 2,4 млн. ЕД в/м 1 раз в сутки 3-4 нед.; альтернативные препараты - эритромицин 250 мг 4 раза в день внутрь 10 дней. В дальнейшем вводится бициллин-5 или экстенциллин 1,5 млн. ЕД в/м 1 раз в 3 недели.
4.Патогенетическая терапия:
а) противовоспалительная терапия: аспирин 4-6 г/сут внутрь или другие НПВС (при непереносимости аспирина или затяжном течении): индометацин0 100-150 мг/сут; диклофенак 100-150 мг/сут; ибупрофен 1200-1500 мг/сут (при беременности) в течение 6-12 недель
б) при тяжелом кардите – ГКС: преднизолон 20-30 мг/сут или медрол 12-16 мг/сут внутрь 10-14 дней, постепенно снижая дозу на 2,5 мг в неделю
в) при затяжном течении – антихинолиновые препараты: делагил 250 мг/сут или плаквенил 200 мг/сут внутрь 6-12 месяцев. 5. Симптоматическая терапия.
Профилактика ОРЛ.
а) первичная – предупреждения развития ОРЛ: бензил-пенициллин G 600.000 ЕД (при массе менее 60 кг) или 1.200.000 ЕД (при массе больше 60 кг) в/м однократно или феноксиметилпенициллин 250 мг 3 раза/сут внутрь 10 дней или при аллергии к пенициллинам – эритромицин 20-40 мг/кг 2-4 раза в день (максимально до 1 г/сут) внутрь 10 дней.
б) вторичная – профилактика ревмоатак: бензил-пенициллин G 2.400.000 ЕД в/м каждые 3 недели или пенициллин V 250 мг 2 раза в день внутрь или сульфадиазин 0,5 г (при массе меньше 60 кг), 1,0 г (при массе больше 60 кг) внутрь или эритромицин 250 мг 2 раза в день внутрь в) текущая – назначение пенициллинов при интеркуррентных заболеваниях (ОРЗ, хирургические вмешательства и др.) для
предупреждения ревмоатак.
Принципы профилактики:
-проводится круглогодично до 20-летнего (ВОЗ – до 25) возраста и в течение 5 лет после последней ревмоатаки; при наличии порока сердца профилактика проводится пожизненно
-обязательна при определенных эпидемиологических факторах риска: школьники, студенты, солдаты и т.д.
-разрабатывается вакцинация очищенным М-протеином клеточной стенки стрептококка.
-профилактика инфекционного эндокардита должна обязательно проводится при дентальных вмешательствах у больных с ревматическими пороками сердца.
-обязательно продолжение профилактики после хирургического лечения ревматических пороков сердца
МСЭ: сроки общей ВН при ОРЛ без вовлечения сердца 20-25 дней, при вовлечении сердца от 20-30 дней до 50-60 дней в зависимости от степени активности процесса.
Реабилитация: ЛФК, специализированные ревматологические санатории (в РБ – «Бобруйск», «Нарочь», «Несвиж», «Приднепровский», основные лечебные факторы: хлоридно-натриевые, углекислые, кислородные, жемчужные, радоновые ванны, ЛФК) и др.
79. Инфекционный эндокардит: этиология, патогенез, клиника, диагностика, принципы лечения, профилактика.
Инфекционный эндокардит (ИЭ) – воспалительное заболевание инфекционной природы, при котором на клапанах, пристеночном эндокарде или на эндотелии крупных сосудов формируется патологический процесс в виде вегетаций, представляющих собой конгломерат из фибрина, тромбоцитов и микробных тел.
Эпидемиология: заболеваемость 1-6 случаев на 100 тыс. населения; мужчины болеют в 2-3 раза чаще женщин; имеется тенденция к «постарению» ИЭ.
Классификация ИЭ: а) по этиологии: стрептококковый, стафилококковый, грибковый и др.
б) по клиническому течению: острый (симптомы более выражены, прогноз плохой) и подострый, или затяжной (симптомы резко не выражены, прогноз лучше).
в) по наличию предрасполагающего морфологического субстрата:
1)первичный (30-40%) – на неизмененных клапанах сердца или пристеночном эндокарде
2)вторичный (на эндокарде, измененном вследствие врожденных или приобретенных нарушений, в т.ч. при кардиохирургических вмешательствах – протезировании клапанов): ранний ИЭ протезированного клапана (1-2 месяца после операции) и поздний ИЭ протезированного клапана.
Этиология ИЭ:
1.Streptococcus (65% случаев): viridans (35%, широко представлен в полости рта и глотки, длительно персистируют), bovis (15%), faecalis – 10%
2.Staphylococcus (25% случаев): aureus (23%, широко представлен на коже, слизистой носа; высоковирулентен, плохой прогноз, вызывает ранний ИЭ протезированных клапанов, а также у наркоманов), epidermidis (< 5%)
3.Грам– бактерии (Pseudomonas aeruginosae, Klebsiella, Escherichia coli, Proteus - < 5% случаев)
4.Грибы рода Candida, Aspergillus, Hystoplasma (чаще при иммунодефицитных состояниях: прием цитостатиков, ГКС, злокачественные опухоли, в/в наркотики, протезы, длительно стоящий в/в катетер - < 5% случаев).
5.Полимикробная флора (< 1% случаев).
111
Патогенез ИЭ.
1.Повреждение эндокарда или эндотелия сосудов с обнажением соединительной ткани, содержащей коллаген, выделения фибронектина и других соединений, стимулирующих адгезию тромбоцитов и образование тромбов (лейкоциты с фибрином образуют небактериальные вегетации, свойственные эндокардиту Либмана-Сакса).
2.Проникновение возбудителя в кровь при нарушении целостности кожных покровов или слизистых (зачастую в организме бывает транзиторная бактериемия – при удалении зуба, повреждении десны при чистке зубов и т.д., при этом механизм прилипания микроорганизмов к вегетациям связан с фибронектином и коллагеном 4-ого типа, которые способствуют адгезии).
3.Микроорганизмы, попавшие в вегетации, не доступны для клеток иммунной системы, т.к. покрыты фибрином и тромбоцитами; бактерии в глубине вегетаций переходят в метаболически неактивное состояние.
4.По мере роста вегетаций происходит разрушение клапана (чаще аортального или митрального), развиваются пороки сердца (чаще недостаточность клапана).
5.Инфекция может распространяться на кольцо клапана и на миокард, вызывая его абсцессы; вегетации могут разрушаться, их фрагменты попадают в кровоток, вызывая эмболии.
6.Вследствие длительного персистирования инфекции и воспалительного процесса истончаются стенки сосудов, начинаются аутоиммунные воспалительные процессы (при повреждении эндокарда обнажаются молекулы, к которым образуются аутоантитела, соединяющиеся с антигенами и образующие иммунные комплексы, которые откладываются с субэндотелиальном слое сосудов вместе с комплементом, приводя к васкулитам, гломерулонефритам, миокардитам, перикардитам, артриту).
Причины вторичного ИЭ (факторы риска, предрасполагающие к повреждению эндотелия):
1.врожденные или приобретенные аномалии сердца, наиболее часто: ДМЖП (дефект межжелудочковой перегородки), ОАП (открытый артериальный проток), тетрада Фалло, корригированный ВПС, ревматический порок сердца;
2.дегенеративные поражения сердца (в первую очередь атеросклеротическое - чаще поражается аортальный клапан; изменения эндокарда в месте крупноочагового ИМ или аневризмы)
3.имплантация инородных тел (искусственные клапаны)
Клиника инфекционного эндокардита.
1. Общеинфекционный синдром:
- повышение температуры, носящей персистирующий характер; чаще субфебриллитет, реже - лихорадка с ознобом и потоотделением - симптомы интоксикации: слабость, утомляемость, снижение работоспособности, потеря массы тела, ухудшение аппетита, голов-
ная боль - артралгии и миалгии (у 40-50%)
- спленомегалия - генерализованная лимфаденопатия: л/у незначительно увеличены, безболезненны
2. Синдром поражения сердца: включает прямые и косвенные признаки формирующегося порока сердца а) прямые – в первую очередь шумы, при этом аускультацию необходимо производить внимательно, несколько раз в сутки, в
течение несколько дней; играет роль не столько изменение старого шума, сколько появление новых шумов; шумы лабильные (при митральной недостаточности – систолический шум, максимальный на верхушке; при аортальной недостаточности – диастолический, по левому краю грудины; при слипании стенок клапана из-за воспаления могут выслушиваться шумы относительных стенозов); симптомы сердечной недостаточности (обычно левожелудочковой).
NB! В течение первого месяца ИЭ при отсутствии вегетаций на ЭхоКГ доверяем только аускультации.
б) косвенные - дилятация различных камер сердца вследствие перегрузки; расширение левых границ сердца; приглушение I тона; снижение диастолического давления при аортальной недостаточности; «пляска каротид» - симптом Мюссе (ритмическое толчкообразное подергивание головы, синхронное с пульсом – при недостаточности аортального клапана)
3. Синдром поражения кожи и слизистых оболочек (10-20%):
а) групповые петехии, бледнеющие и исчезающие в течение 2-3 дней на конъюнктиве - пятна Лукина-Либмана, слизистой щеки, мягкого неба, коже дистальных отделов конечностей (из-за микроэмболии сосудов)
б) групповые линейные геморрагии, длиной 1-2 мм, исчезающие через 2-3 дня, расположенные под ногтевой пластинкой, не доходя до ее конца (из-за микроэмболии сосудов)
в) подкожные болезненные узелки в области подушечек пальцев, реже – тенара, гипотенара (узелки Ослера), длиной 2-3 мм, исчезающие через неделю (из-за продуктивного воспаления мягких тканей вокруг эмбола в сосуде)
г) макулярная сыпь на подушечках пальцев, безболезненная, быстро проходящая (пятна Дженуэя)
4.Тромбоэмболический синдром (35-40% и более): эмболии сосудов головного мозга (инфаркт мозга), почек (транзиторная гематурия), селезенки, печени, брыжейки, сетчатки; при этом болевой синдром не выражен.
5.Синдром аутоиммунной патологии: гломерулонефрит (как правило, с изолированным мочевым синдромом, протеинурия не очень высокая, эритроцитурия, цилиндрурия, транзиторные нарушения выделительной функции почек); миокардит; экссудатив-
ный перикардит; артрит с синовиитами крупных суставов.
Диагностика ИЭ.
1. Эхо-КГ (трансторакальная): наличие вегетаций – внутрисердечных образований, которые на ножке прикрепляются к верхушке клапана, имеют различные размеры, производят самостоятельные вращательные движения (помимо совместных движений со створками); наименьший размер вегетаций, который можно обнаружить – 2 мм; чреспищеводная Эхо-КГ позволяет увидеть параклапанную недостаточность (при протезах), внутрисердечные абсцессы. Непрямые Эхо-КГ-признаки ИЭ: очаговые утолщения и уплотнения створок клапанов, пролабирование клапанов, внутрисердечные тромбы.
NB! Отсутствие вегетаций не исключает ИЭ (особенно в первые 4-6 недель). И наоборот – могут быть вегетации при абактериальном эндокардите Либмана-Сакса, папиллярная фибробластома также напоминает вегетации.
2. Рентгенография органов грудной клетки – для определения наличия и выраженности венозного застоя в легких, изменения формы и размеров сердца, диагностики ТЭЛА.
3. ЭКГ: появление разнообразных нарушений ритма, признаков гипертрофии и перегрузки левого желудочка. 4. Лабораторные данные:
а) ОАК: лейкоцитоз с нейтрофилией (при высоковирулентных штаммах, при абсцессах – гиперлейкоцитоз); токсическая зернистость нейтрофилов; анемия токсического генеза, нормоцитарная, нормоили гипохромная; длительно сохраняющееся даже после эрадикации инфекции повышение СОЭ б) БАК: повышены острофазовые белки – СРБ, серомукоид, церулоплазмин, гаптоглобин; диспротеинемия, общий белок не изменен.
в) ОАМ: изменен при гломерулонефрите, токсическом действии ЛС (интерстициальный нефрит)
г) иммунологический анализ крови: повышены ЦИК, IgG, IgM, снижена общая гемолитическая активность комплемента, положительный ревматоидный фактор (у 60-70%) в невысоких титрах.
д) посев крови – делается не менее 3 исследований, максимально – 6; для каждого анализа - отдельная венепункция; забор крови производиться либо до назначения АБ (если позволяет состояние пациента) либо после временной их отмены минимум на сутки; если отменить АБ сложно, то сделать это хотя бы на 3-4 часа с забором крови 1 раз в час (3 гемокультуры); за 1 раз нужно брать не менее 5 мл крови (лучше – 10-15 мл); при каждом заборе посев необходимо производить на 2 среды – для аэробов и анаэробов.
112
Ложноотрицательный результат может быть связан с 1) предшествующей антибактериальной терапией, 2) интермиттирующей бактериемией (редко), тогда кровь нужно брать многократно в разное время суток, 3) микроорганизмом, который растет на особых средах либо длительно культивируется (7-20 суток), в то время как посевы обычно оценивают через 4-5 суток.
Диагностические критерии ИЭ DUKE UNIVERSITY:
I. Патоморфологические критерии:
А.Обнаружение микроорганизмов при бактериальном или гистологическом исследовании вегетаций, их фрагментов в материале, полученном при эмболэктомии, или содержимого внутрисердечного абсцесса ИЛИ Б. Характерные патологоанатомические данные: наличие вегетаций или внутрисердечных абсцессов с гистологическими признаками активного эндокардита.
II. Клинические критерии:
А.2 больших критерия ИЛИ
Б. 1 большой и 3 малых ИЛИ В. 5 малых критериев
А. Большие критерии:
-положительные результаты посева крови (с характерными микроорганизмами)
-характерные ЭХО-КГ признаки ИЭ: признаки вегетаций л и б о признаки внутрисердечного абсцесса л и б о появление потока регургитации крови через клапан (т.е. его недостаточность).
Б. Малые критерии:
-предрасположенность к ИЭ (ВПС, наличие чужеродного материала и др.)
-лихорадка (> 38С)
-характерное поражение сосудов: эмболии, септические инфаркты легких, микотические аневризмы, внутричерепные кровотечения и т.д.
-иммунные феномены: ГН, обнаружение ревматоидного фактора в сыворотке крови, ложноположительная RW (синтез антикардиолипиновых антител)
-Эхо-КГ признаки «вероятного» ИЭ
-данные микробиологического исследования: положительный результат посева крови с выделением возбудителя, способного вызвать ИЭ
Лечение ИЭ.
1. Медикаментозная терапия:
а) антибактериальная терапия – основополагающее направление, основные принципы: применение АБ с бактерицидным действием; парентеральное введение (лучше всего в/в) препаратов с соблюдением рекомендуемых интервалов между инъекциями с целью поддержания оптимальной концентрации препарата в крови; использование комбинаций препаратов, обладающих аддитивным эффектом; достаточная длительность лечения (зависит от возбудителя, но не менее 4 недель); назначение антибиотиков с учетом чувствительности к ним возбудителей.
Эмпирическая терапия:
1-ая схема - наиболее вероятный возбудитель – Streptococcus (например, после стоматологических манипуляций): бензилпенициллин 16-18 млн. ЕД/сут в/в (или ампициллин 2 г в/в через 4 часа) + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
2-ая схема – наиболее вероятный возбудитель - Staphylococcus: оксациллина натриевая соль (или ампициллин) 2 г в/в через 4 часа + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
3-ая схема (резерва): ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
Этиотропная терапия:
1)ИЭ стрептококковой этиологии: либо схема №1, либо №3, либо цефалоспорин III поколения (цефтриаксон 2 г в/в 1 раз в сутки) + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов (клинический эффект должен быть в течении 3-5 суток, если нет – препараты заменить)
2)ИЭ стафилококковой этиологии:
а) эндокардит собственных клапанов: оксациллина натриевая соль 2 г в/в через 4 часа (цефазолин 2 г в/в через 8 часов или цефтриаксон 2 г в/в 1 раз в сутки) или ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов
б) эндокардит протезированных клапанов: оксациллина натриевая соль 2 г в/в через 4 часа (цефазолин 2 г в/в через 8 часов или цефтриаксон 2 г в/в 1 раз в сутки) или ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов + рифампицин 300 мг внутрь 3 раза в сутки.
б) противовоспалительная терапия: в начальной стадии ГКС не применяются, позже, когда уже включаются иммунные механизмы (не инфекционный артрит, экссудативный васкулит) – по 1 мг/кг/сут. Назначение НПВС считается нецелесообразным.
в) симптоматическая терапия: лечение сердечной недостаточности (ИАПФ, диуретики и др.), антиаритмики. 2. Хирургическое лечение – показания:
а) абсолютные: выраженная сердечная недостаточность; неконтролируемая инфекция (безуспешное лечение в течение 10-14 дней); наличие внутрисердечного абсцесса и/или фистулы.
б) относительные: рецидивирующие эмболии (из-за крупных вегетаций); наличие гнойного перикардита (необходимо дренировать).
в) при эндокардите протезированных клапанов: нарушение функции и/или фиксации протеза. Профилактика ИЭ проводится:
-больным с протезами клапанов
-больным с ревматическими и неревматическими поражениями сердца
-при пролапсе митрального клапана с регургитацией
-при гипертрофический кардиомиопатии с обструкцией
вследующих ситуациях:
-все стоматологические манипуляции, способные вызвать травматизацию слизистой
-тонзиллэктомия и аденоидэктомия;
-хирургические операции связанные с травматизацией слизистой пищеварительной трубки, мочеполового тракта
-вскрытие и дренирование любых инфицированных тканей
-роды в случае наличия инфекции.
Применяемые схемы:
1.амоксициллин 2 г внутрь за 1 час до манипуляции и затем через 6 часов после нее или
2.ампициллин в/м или в/в в дозе 2 г за 30 мин до манипуляции и 1 г через 6 часов после нее или
3.клиндамицин 600 мг за 1 час до манипуляции или
4.азитромицин 500 мг за 1 час до манипуляции и др.
80. Митральные пороки сердца: этиология, нарушения гемодинамики, клиника, тактика ведения больных.
113

Недостаточность митрального клапана.
Этиология недостаточности митрального клапана (НМК):
1. Органическая форма НМК: а) ревматический эндокардит (до 75% всех случаев порока) б) инфекционный эндокардит в) атеросклероз г) диффузные заболевания соединительной ткани д) травматическая НМК 2. Относительная форма НМК в результате расширения левого желудочка и фиброзного кольца без органического поражения клапана:
а) поражение миокарда при миокардитах, дилатационной кардиомиопатии, аневризме левого желудочка б) гемодинамическая перегрузка левого желудочка (АГ, коарктация аорты, «митрализация» аортальных пороков) в) синдром пролабирования створок митрального клапана г) дисфункция папиллярных мышц из-за ишемии и др.
3. Функциональная форма НМК (при АГ, аортальной недостаточности, миокардитах и др.) Гемодинамические нарушения при НМК.
1.Во время систолы желудочков происходит неполное смыкание створок митрального клапана, что приводит к регургитации крови из левого желудочка в левое предсердие.
2.В левом предсердии накапливается большее, чем в норме, количество крови; избыточный объем поступает в левый желудочек, вызывая постепенно его дилатацию и гипертрофию. При этом НМК долгое время компенсируется мощной работой левого желудочка (поступление в него большего объема крови дает возможность повысить давление в левом желудочке в такой степени, чтобы открывались аортальные клапаны, а систолический объем не изменялся).
3.Перегрузка левого предсердия (объемом крови из левого желудочка + объемом крови из малого круга кровообращения) приводит к его гипертрофии, повышении давления крови в его полости, ретроградно – в легочных венах. Повышение давления в легочных венах и левом предсердии приводит к спазму легочных артериол (рефлекс Китаева) и нарастанию явлений легочной гипертензии, при этом усиливается работа правого желудочка, возникает его гипертрофия и дилатация полости; в последующем увеличивается правое предсердие
Клинические проявления НМК.
1. Субъективно – в стадии компенсации жалобы отсутствуют, при снижении сократительной функции левого желудочка и повышении давления в малом круге кровообращения появляются жалобы на:
-одышку вначале при физической нагрузке, а затем и в покое
-сердцебиение
-боли в области сердца ишемического характера (из-за отставаний развития коронарных коллатералей при гипертрофии миокарда)
-сухой кашель
При нарастании симптомов правожелудочковой недостаточности появляются отеки на ногах, боли в правом подреберье (из-за увеличения печени и растяжения ее капсулы).
2. Объективно:
а) осмотр: акроцианоз, набухание шейных вен
б) пальпация: усиленный разлитой верхушечный толчок, смещенный влево и нередко вниз в V или в VI межреберье; сердечный горб (при гипертрофии и дилатации правого желудочка)
в) перкуссия: расширение относительной тупости сердца вначале влево, вверх, а затем и вправо.
г) аускультация: I тон на верхушке сердца ослаблен или отсутствует (т.к. нет «периода замкнутых клапанов»); систолический шум на верхушке, распространяющийся вдоль V и VI ребер в подмышечную впадину и в точку Боткина и убывающий в конце систолы (возникает из-за прохождения крови из левого желудочка в левое предсердие через узкую щель между створками клапана); акцент II тона над легочной артерией и его расщепление (из-за быстрого захлопывания клапанов при повышении давления).
д) характеристики пульса и АД: характерных изменений не имеют.
Диагностика митральной недостаточности.
1. Эхо-КГ: увеличение амплитуды движения передней створки митрального клапана; отсутствие систолического смыкания митрального клапана; расширение полости левого предсердия и левого желудочка; при допплер-эхокардиографии турбулентый систолический поток крови в левое предсердие.
Выделяют 4 степени НМК по длине струи регургитации от основания створок МК в ЛП: I – незначительная – до 4 мм; II – умеренная – 4-6 мм; III – средневыраженная – 6-9 мм; IV - выраженная > 9 мм
2. Рентгенография органов грудной клетки: расширение сердца влево; увеличена 4 дуга гипертрофированного и расширенного левого желудочка, его пульсация усилена; талия сердца сглажена из-за расширения левого ушка (3 дуга) и легочной артерии (2 дуга); в I косом положении ретрокардиальное пространство сужено в результате расширения левого предсердия, тень правого желудочка увеличена; контрастированный пищевод смещен по дуге большого радиуса (больше 6 см); симптомы легочной гипертензии в легких: расширение корней легких, нечеткость их контура, сосудистый рисунок прослеживается до периферии легочных полей.
3. ЭКГ: признаки гипертрофии левого предсердия (уширение зубца Р больше 0,12 сек, его двугорбость), гипертрофии левого желудочка (увеличение RI, aVL, V5, V6; левограмма; смещение переходной зоны в V1/V2; полная/неполная блокада левой ножки пучка Гиса; увеличение интервала внутреннего отклонения J>0,05 сек в V5, V6; смещение интервала ST ниже изолинии, инверсия или двухфазность зубца Т в I, aVL, V5, V6).
4. ФКГ: верификация изменений I и II тона, выявление систолического шума. Тактика ведения больных.
1.Ограничение физической нагрузки, профилактика рецидивов ревматизма по показаниям и инфекционного эндокардита во всех случаях; лечение сердечной недостаточности.
2.Хирургическая коррекция – протезирование клапана – показана лишь при выраженной митральной регургитации в случаях значительного нарушения функционального состояния больных, когда они не переносят даже легкой физической нагрузки из-за развития бивентрикулярной сердечной недостаточности.
Митральный стеноз.
Этиология митрального стеноза:
1.Ревматический эндокардит
2.Атеросклеротическое изменение митрального клапана
3.Врожденные пороки сердца (в том числе синдром Лютембаше – сочетание митрального стеноза с дефектом межпредсердной перегородки).
Гемодинамические нарушения при митральном стенозе.
В норме площадь левого атриовентрикулярного отверстия 4-6 см2, гемодинамические изменения наблюдаются при ее изменении более, чем на половину (критическая площадь – 1,0-1,5 см2).
1.Из-за наличия препятствия току крови в левый желудочек левое предсердие гипертрофируется и дилатируется.
2.Рост давления в левом предсердии приводит к ретроградному повышению давления в легочных венах и капиллярах; раздражение барорецепторов легочных вен вызывает рефлекторное сужение артериол (рефлекс Китаева).
114
3. Функциональные, а затем и анатомические (склеротические) изменения сосудов малого круга кровообращения повышают нагрузку на правый желудочек, вызывая его гипертрофию и дилатацию. В результате дистрофических и склеротических изменений миокарда правого желудочка возникает декомпенсация по большому кругу кровообращения.
Клинические проявления митрального стеноза.
1. Субъективно – жалобы на:
-одышку вначале при физической нагрузке, затем и в покое; при резком подъеме давления в малом круге кровообращения возможно появления сердечной астмы
-кашель сухой или с небольшим количеством слизистой мокроты
-охриплость голоса (симптом Ортнера)
-кровохарканье (в мокроте появляются сидерофаги – «клетки сердечных пороков»)
-боли в области сердца, сердцебиения, перебои; часто развивается мерцательная аритмия
-слабость, повышенная утомляемость (т.к. характерна фиксация минутного объема – отсутствие адекватного увеличения минутного объема сердца при физической нагрузке)
2. Объективно:
а) осмотр: на фоне бледной кожи выявляется резко очерченный лиловый «митральный» румянец щек с цианозом губ и кончика носа (facies mitralis); усиленная эпигастральная пульсация правого желудочка («сердечный толчок»); отсутствие или ослабление верхушечного толчка (т.к. левый желудочек не увеличен в объеме и смещен гипертрофированным правым желудочком)
б) пальпация: при пальпации верхушки сердце, особенно после физической нагрузке в положении на левом боку на выдохе – диастолическое дрожание («кошачье мурлыканье» - из-за колебаний крови при прохождении ее через суженное митральное отверстие); симптом двух молоточков Нестерова – если положить руку ладонью на верхушку, а пальцами на область II межреберья слева от грудины, то хлопающий I тон ощущается ладонью как первый «молоточек», а акцентированный II тон ощущается пальцами как второй «молоточек»; сердечный горб.
в) перкуссия: смещение границ относительной тупости сердца вверх (за счет гипертрофии левого предсердия) и вправо (за счет расширения правого желудочка), при этом границы абсолютной сердечной тупости увеличиваются больше, чем относительной (т.к. за счет расширения правого желудочка сердце, раздвинув края легких, прижимается к грудной стенке своей правой увеличенной половиной).
г) аускультация: усиленный (хлопающий) I тон над верхушкой сердца (в диастолу левый желудочек не наполняется кровью в достаточной мере и быстро сокращается); дополнительный III тон на верхушке (тон открытия митрального клапана; связан с резким движением створок митрального клапана в начале диастолы); I тон + II тон + щелчок открытия митрального клапана – трехчленный ритм на верхушке сердца – ритм «перепела»; диастолический шум на верхушке сердца, возникающий в различные периоды диастолы:
1)протодиастолический шум – возникает в начале диастолы, связан с движением крови через суженное отверстие из-за разности давления в предсердии и желудочке; убывающий, низкого рокочущего тембра (пальпаторный эквивалент – «кошачье мурлыканье»), выслушивается на ограниченном пространстве, лучше после физической нагрузки, на левом боку, на выдохе, не проводится.
2)пресистолический шум – возникает в конце диастолы за счет активной систолы предсердий; имеет нарастающий характер, исчезает при мерцательной аритмии д) характеристика пульса и АД: различный пульс (симптом Попова) – пульс на левой лучевой артерии слабее, чем на правой из-за
сдавления левой подключичной артерии увеличенным левым предсердием; АД имеет тенденцию к снижению из-за уменьшения сердечного выброса.
Диагностика митрального стеноза.
1. Эхо-КГ: однонаправленное движение передней и задней створок митрального клапана вперед (в норме задняя створка смещается кзади); снижение скорости раннего диастолического закрытия передней створки и амплитуды ее движения; утолщение клапана; расширение полости правого желудочка и левого предсердия
Выделяют 4 степени митрального стеноза по диаметру митрального отверстия: I – незначительный стеноз – 4,0-3,0 см2, II – умеренный стеноз – 2,9-2,0 см2, III – выраженный стеноз – 1,9-1,1 см2, IV – критический стеноз - < 1 см2.
2. Рентгенография органов грудной клетки: гипертрофия левого предсердия (3 дуга), расширение легочного ствола (2 дуга) и правых отделов сердца – митральная конфигурация; пищевод отклоняется по дуге малого радиуса (менее 6 см); сужение ретростернального пространства в косых проекциях (за счет увеличения правого желудочка); признаки легочной гипертензии: широкие корни, резкое выбухание легочной артерии, внезапный обрыв ее расширенных ветвей.
3. ЭКГ: признаки гипертрофии левого предсердия (уширение зубца Р больше 0,12 сек, его двугорбость), гипертрофии правого желудочка (увеличение RIII, aVF, V1, V2; правограмма; смещение переходной зоны в V4/V5; полная/неполная блокада правой ножки пучка Гиса; увеличение интервала внутреннего отклонения J>0,03 сек в V1, V2; смещение интервала ST ниже изолинии, инверсия или двухфазность зубца Т в III, aVF, V1, V2).
4. ФКГ: верификация изменений I, II, III тонов, выявление диастолического шума. Тактика ведения больных.
1.При отсутствии симптомом – медикаментозная профилактика инфекционного эндокардита (у больных моложе 25-30 лет), по показаниям – бициллинопрофилактика рецидивов ревматизма (при перенесенном активном ревматизме давностью до 5 лет), избегание значительной физической нагрузки.
2.При наличии симптомов – ограничение соли, прием диуретиков (осторожно из-за опасности гиповолемии и снижения МОС), сердечные гликозиды (только при мерцательной аритмии или выраженной правожелудочковой недостаточности) и др.
3.Хирургическое лечение: митральная вальвулотомия (показана при митральном стенозе без кальциноза клапанов, при наличии симптомов заболевания и площади митрального отверстия менее 1,2 см2, противопоказана при резком кальцинозе и значительной сопутствующей митральной регургитации) или протезирование митрального клапана (показано в случае значительной сопутствующей митральной регургитации, при грубом кальцинозе и резкой деформации клапана, после предшествующей вальвулотомии при ее неудовлетворительном результате).
81.Аортальные пороки сердца: этиология, гемодинамические нарушения, клинические проявления, тактика ведения больных.
Стеноз устья аорты.
Этиология стеноза устья аорты.
1) ревматическое поражение клапанного аппарата 2) атеросклероз 3) инфекционный эндокардит 4) ревматоидный артрит, системная красная волчанка 5) врожденные аномалии клапана и устья аорты.
У пожилых лиц наиболее часто встречается изолированный клапанный стеноз с обызвествлением клапанов (порок Менкеберга), который развивается на фоне предшествующего атеросклеротического поражения.
Гемодинамические нарушения.
1. При уменьшении площади аортального отверстия на 50 % и более (в норме 2,6–3,5 см2) возникают существенные изменения градиента давления между левым желудочком и аортой - нарастает давление в левом желудочке при сохранении нормального давления в аорте, в результате этого нарастает напряжение стенки левого желудочка с последующей ее гипертрофией по концентрическому типу (гипертрофия с увеличением толщины стенки левого желудочка, но с уменьшением объема его полости).
115
2.При прогрессировании стеноза систола желудочков удлиняется, так как необходимо большее время для изгнания крови из левого желудочка через суженное отверстие в аорту. Нарушается диастолическая функция левого желудочка, что приводит к увеличению конечного диастолического давления в левом желудочке, увеличению давления в левом предсердии, застою крови в малом круге кровообращения с клиникой диастолической сердечной недостаточности (ортопноэ, сердечная астма, отек легких).
3.Выраженный стеноз устья аорты увеличивается потребность миокарда в кислороде из-за увеличения мышечной массы левого желудочка (гипертрофия) и повышения внутрижелудочкового давления, удлинения систолы. Одновременно уменьшается кровоток в венечных артериях из-за снижения перфузионного давления в артериях и сдавления гипертрофированным миокардом артерий, идущих к эндокарду. Все это приводит к возникновению загрудинных болей (типичной стенокардии напряжения) при отсутствии признаков окклюзии артерий сердца (относительная недостаточность коронарного кровообращения).
Классификация аортальных стенозов в зависимости от локализации места сужения:
а) подклапанный (субаортальный) стеноз – препятствие кровотоку создается за счет выраженной гипертрофии выходного тракта левого желудочка.
б) клапанный стеноз - сужение устья аорты обусловлено сращением створок аортального клапана в) надклапанный стеноз - сужение обусловлено циркулярным тяжем или мембраной, располагающимися дистальнее устья коронарных артерий.
Клиническая картина аортального стеноза.
1. Субъективно – длительно протекает бессимптомно, основные жалобы появляются при сужении аортального отверстия на 2/3 нормы (менее 0,75 см2):
-сжимающие боли за грудиной при физической нагрузке (снижение коронарного кровообращения).
-головокружение, обмороки (ухудшение мозгового кровообращения);
В дальнейшем при снижении сократительной функции левого желудочка появляются: приступы сердечной астмы; одышка в покое; повышенная утомляемость (обусловлена отсутствием адекватного возрастания минутного объема сердца при физической нагрузке).
При появлении застойных явлений в большом круге кровообращения больные жалуются на: отеки нижних конечностей; боли в правом подреберье (связаны с увеличением печени и растяжением капсулы).
2. Объективно:
а) осмотр: бледность кожных покровов (из-за спазма сосудов кожи как реакции на малый сердечный выброс), акроцианоз (при декомпенсации), отеки нижних конечностей, набухание шейных вен, выраженный верхушечный толчок.
б) пальпация: пальпируется разлитой «высокий» резистентный верхушечный толчок, смещенный вниз (VI межреберье) и влево (до передней подмышечной линии); в точке Боткина и особенно во втором межреберье справа от грудины (над аортой) часто определяется систолическое дрожание («кошачье мурлыканье»), возникающее из-за завихрения крови при прохождении через суженное аортальное отверстие.
в) перкуссия: расширение левой границы относительной тупости сердца, увеличение размеров поперечника сердца (аортальная конфигурация сердца).
г) аускультация: первый тон ослаблен (за счет медленного сокращения левого желудочка и удлинения систолы), второй тон ослаблен над аортой (а при неподвижности сросшихся створок аортального клапана он может совсем исчезать); грубый, нарастающеубывающий систолический шум с эпицентром над аортой, проводится на сонные артерии, усиливается при выслушивании больного на правом боку с задержкой дыхания во время выдоха.
д) характеристика пульса и АД: пульс малый, медленный и редкий (кровь в аорту проходит медленно и в меньшем количестве); систолическое АД снижено, диастолическое нормальное или повышено, пульсовое давление уменьшено.
Диагностика аортального стеноза.
1.Эхокардиограмма - в двухмерном режиме регистрируют уплотнение и утолщение створок аортального клапана, систолическое выбухание его створок по току крови, концентрическую гипертрофию левого желудочка, в доплеровском режиме определяют степень стеноза:
а) незначительный – среднее значение градиента давления между левым желудочком и аортой менее 30 мм рт.ст., площадь аортального отверстия 1,3-2,0 см2.
б) умеренный – среднее значение градиента давления 30-50 мм рт.ст., площадь аортального отверстия 0,75-1,3 см2.
в) выраженный – среднее значение градиента давления более 50 мм рт.ст., площадь аортального отверстия менее 0,75 см2.
2.Рентгенография органов грудной клетки: в период компенсации – незначительное увеличение левого желудочка, при выраженном пороке – прогрессирующее увеличение левого желудочка, затем и левого предсердия; выраженная талия сердца за счет гипертрофии и дилатации левого желудочка (аортальная конфигурация сердца); постепенно присоединяется увеличение правого желудочка, постстенотическое расширение аорты и обызвествление клапана аорты; симптомы легочной гипертензии (расширение корней легких, нечеткость их контура, сосудистый рисунок прослеживается до периферии легочных полей).
3.ЭКГ: признаки гипертрофии левого желудочка: увеличение зубца RV5,V6, I, aVL, признаки блокады левой ножки пучка Гиса, увеличение интервала внутреннего отклонения (от начала зубца Q до вершины зубца R) J > 0,05 сек в V5, V6, левограмма, смещение
переходной зоны в V1/V2; признаки коронарной недостаточности: смещение вниз интервала S-T и инверсия или двухфазность зубца Т I, aVL, V5, V6; признаки гипертрофии и дилатации левого предсердия: Р-mitrale (уширение зубца Р>0,12 сек, двугорбость зубца Р), внутрипредсердная блокада.
4.Фонокардиография: уменьшение амплитуды I тона у верхушки сердца и II тона над аортой; систолический шум ромбовидной формы, начинающийся через небольшой интервал после I тона и заканчивающийся не доходя до II тона.
5.Катетеризация сердца и ангиокардиография – показаны всем больным, у которых решается вопрос хирургического лечения, определяют 1) градиент систолического давления между левым желудочком и аортой (единственно надеждый способ оценки степени стеноза) 2) функциональное состояние левого желудочка (КДД, КДО, ФВ, УО, МОС) 3) точную локализацию препятствия изгнанию крови.
Тактика ведения больных с аортальным стенозом.
1.При значительном стенозе – ограничение тяжелой физической нагрузки.
2.Медикаментозная терапия в легких случаях не требуется, в тяжелых случаях – малоэффективна, проводится профилактика инфекционного эндокардита и лечение сердечной недостаточности (ингибиторы АПФ назначаются очень осторожно, что лимитируется наличием гипотензии).
3.Хирургическое лечение показано при градиенте систолического давления на клапане свыше 50 мм рт.ст. при нормальном МОС (оперативная вальвулотомия, чрезкожная балонная аортальная вальвулопластика, протезирование аортального клапана).
Недостаточность аортального клапана.
Этиология аортального клапана.
1) ревматическое поражение клапана аорты – примерно 2/3 всех больных аортальной недостаточностью 2) инфекционный эндокардит 3) сифилис 4) аневризма аорты 5) тупая травма грудной клетки 6) артериальная гипертензия 7) атеросклероз аорты 8) аортит 9) врожденные аномалии (обычно сочетаются с поражением других клапанов, синдром Марфана) 10) системная красная волчанка, ревматоидный артрит (вызывают асептический эндокардит)
Гемодинамические нарушения.
116
1.Из-за недостаточности аортального клапана происходит обратный ток крови из аорты в левый желудочек во время его диастолы, что вызывает его расширение. Во время систолы левый желудочек сокращается с большей силой (необходимо выбросить увеличенный ударный объем крови), что вызывает его гипертрофию, а в аорте – дилатацию.
2.При исчерпании возможностей компенсации и ухудшении функции перерастянутого миокарда УО (ударный объем) и ФВ (фракция выброса) снижаются, а КДД (конечно-диастолическое давление) и КДО (конечно-диастолический объем) в левом желудочке повышаются, что приводит к увеличению давления в левом предсердии, легочных венах, капилларах и легочной артерии.
3.Расширение левого желудочка приводит к относительной недостаточности митрального клапана, что увеличивает связанный с декомпенсацией аортального порока венозный застой в малом круге кровообращения и создает дополнительную нагрузку для правого желудочка (митрализация аортальной недостаточности).
Клиническая картина аортальной недостаточности.
1. Субъективно – в стадии компенсации порока общее самочувствие удовлетворительное, лишь иногда больные ощущают сердцебиение (из-за компенсаторной тахикардии) и пульсацию за грудиной (из-за перемещения увеличенного объема крови из левого желудочка в аорту и обратно), при декомпенсации жалобы на:
-боль в области сердца стенокардитического характера, плохо или некупирующиеся нитроглицерином (обусловлены относительной коронарной недостаточностью за счет гипертрофии миокарда, ухудшением кровенаполнения коронарных артерий при низком диастолическом давлении в аорте и из-за сдавления субэндокардиальных слоев избыточным объемом крови)
-головокружение, наклонность к обморокам (связаны с нарушением питания мозга)
-одышку вначале при физической нагрузке, а затем и в покое (появляется при снижении сократительной функции левого желудочка)
-отеки, тяжесть и боль в правом подреберье (при развитии правожелудочковой недостаточности)
2. Объективно:
а) осмотр: бледность кожных покровов (вызвана малым кровенаполнением артериальной системы во время диастолы); пульсация переферических артерий — сонных («пляска каротид»), подключичных, плечевых, височных; ритмичное, синхронное с пульсом покачивание головы (симптом Мюссе); ритмичное изменение цвета ногтевого ложа и губ при легком надавливании прозрачным стеклом на слизистую губ, на конец ногтя, так называемый капиллярный пульс (симптом Квинке).
б) пальпация: верхушечный толчок определяется в шестом, иногда в седьмом межреберье, кнаружи от среднеключичной линии, разлитой, усиленный, приподнимающий, куполообразный.
в) перкуссия: граница относительной сердечной тупости смещена вниз и влево, увеличены размеры поперечника сердца и ширина сосудистого пучка (аортальная конфигурация).
г) аускультация: I тон на верхушке сердца ослаблен (створки митрального клапана захлопываются с меньшей амплитудой вследствие переполнения левого желудочка кровью, давление в полости левого желудочка нарастает медленно при отсутствии периодов замкнутых клапанов); II тон на аорте при ревматическом пороке ослаблен, при сифилитическом и атеросклеротическом - звучный, иногда усилен и даже с металлическим оттенком; шумы:
1)органический шум - мягкий, дующий протодиастолический шум над аортой, проводящийся к верхушке сердца; при ревматическом пороке данный шум не грубый, лучше выслушивается в точке Боткина-Эрба, при сифилитическом пороке - шум более грубый, лучше выслушивается во втором межреберье справа
2)функциональные шумы: систолический шум на верхушке (относительная недостаточность митрального клапана при большом расширении левого желудочка); диастолический, пресистолический шум Флинта (обратный ток крови во время диастолы из аорты в желудочек происходит со значительной силой и оттесняет створку митрального клапана, что создает функциональный стеноз митрального отверстия, и во время диастолы создается препятствие току крови из левого предсердия в желудочек).
На бедренной артерии выслушивается двойной тон Траубе (как результат колебаний стенки сосуда во время систолы и во время диастолы) и двойной шум Виноградова-Дюрозье (первый шум стенотический — обусловлен током крови через суженный стетоскопом сосуд; второй — ускорением обратного кровотока по направлению к сердцу во время диастолы).
д) характеристика пульса и АД: пульс скорый, высокий, большой (из-за большого пульсового давления и увеличенного объема крови, поступающего в аорту во время систолы); систолическое АД повышается, дистолическое понижается, пулсовое давление повышается.
Диагностика аортальной недостаточности.
1.Эхокардиография - в двухмерном режиме признаки гипертрофии левого желудочка; в одномерном режиме - трепетания передней створки митрального клапана из-за попадания на нее струи регургитации из аорты (эхокардиографический аналог шума Флинта); при допплерографии - струя регургитации из аорты в левый желудочек (прямой признак недостаточности аортального клапана), определение степени аортальной недостаточности:
а) I степень – длина струи регургитации не более 5 мм от створок аортального клапана б) II степень – длина струи регургитации 5-10 мм от створок аортального клапана
в) III степень - длина струи регургитации более 10 мм от створок аортального клапана
2.Рентгенография органов грудной клетки – аортальная конфигурация сердца (гипертрофия и дилатация полости левого желудочка); тень аорты расширена, амплитуда ее пульсации и пульсация левого желудочка увеличена; при развитии сердечной недостаточности - признаки венозной легочной гипертензии, контрастированный пищевод отклоняется по дуге большого радиуса вследствие увеличения левого предсердия.
3.ЭКГ: признаки гипертрофии левого желудочка; признаки относительной коронарной недостаточности; при «митрализации» порока - признаки гипертрофии левого предсердия (уширение зубца Р больше 0,12 сек, его двугорбость); нарушения ритма и проводимости (фибрилляция предсердий, АВ-блокада, блокада ножек пучка Гиса).
4.Фонокардиография: ослабление тонов сердца, убывающий диастолический шум.
Тактика ведения больных с аортальной недостаточностью.
1.Ограничение тяжелых физических нагрузок во избежание усугубления дилатации левого желудочка.
2.Медикаментозная терапия проводится по поводу застойной сердечной недостаточности (при этом особенно эффективны ингибиторы АПФ, уменьшающие регургитацию); рекомендуется профилактика инфекционного эндокардита.
3.Хирургическое лечение (чаще протезирование биологическим или механическим протезом) показано при:
-появлении клинических признаков порока (ангинозной боли, признаков левожелудочковой сердечной недостаточности)
-при наличии выраженной регургитации и прогрессирующей дилатации левого желудочка, увеличении конечно-систолического объема и уменьшении фракции выброса даже без клинических проявлений порока
-при значительном снижении физической работоспособности по данным нагрузочного тестирования.
82. Остеоартроз: этиология, патогенез, классификация, клиника, диагностика, течение, лечение. Медико-социальная экспертиза. Реабилитация.
Остеоартроз (ОА) – хроническое прогрессирующее невоспалительное заболевание суставов, в основе которого лежит дегенерация суставного хряща с последующим изменением костных суставных поверхностей, развитием краевых остеофитов, деформацией сустава, а также развитием умеренно выраженного синовита.
а) первичный ОА – развивается в здоровом до этого хряще б) вторичный ОА – развивается в уже предварительно изменненном хряще из-за ряда заболеваний
117
Эпидемиология: ОА страдает около 10% населения; 80% старше 75 лет имеет клинические симптомы и все 100% - после 80 лет. Этиология окончательно не выяснена, предполагаемые факторы первичного ОА:
1)несоответствие между механической нагрузкой на суставной хрящ и его возможностью сопротивляться этому воздействию
2)наследственная предрасположенность к сниженной способности хряща противостоять повышенным нагрузкам (тип наследования – аутосомно-доминантный, часто обнаруживают мутацию гена COL2A1)
В развитие ОА большую роль играет взаимодействие предрасполагающих факторов:
а) эндогенных: пожилой возраст; женский пол; эндокринные нарушения; избыточный вес; пороки развития костей и суставов (плоскостопие, дисплазия головки бедренной кости); оперативные вмешательства (менискэктомия)
б) экзогенных: профессиональная деятельность (шахтеры, танцоры), профессиональный спорт (футбол, атлетика, бокс, дзюдо); травмы и микротравматизации сустава; несбалансированное питание; интоксикация и профессиональные вредности; злоупотребление алкоголем
Патогенез ОА:
Влияние этиологических факторов быстрое и «раннее» постарение хряща, нарушение его метаболизма (деполимеризация и убыль хондроитинсульфатов, гиалуроновой кислоты, гибель части хондроцитов, синтез не свойственных нормальному хрящу протеогликанов и коллагена) потеря эластичности хряща, шероховатость, разволокненность, уменьшение толщины, появление в нем трещин, эрозий, обнажение подлежащей кости («оголенные кости») отсутствие амортизации при давлении на суставную поверхность костей уплотнение суставной поверхности костей (субхондральный остеосклероз) с образованием участков ишемии, склероза, кист компенсаторное разрастание хряща по краям суставных поверхностей эпифизов с последующим их окостенением (краевые остеофиты) инородные части внутри сустава («суставная мышь»: отломки хряща, фагоцитируемые лейкоцитами с высвобождением лизосомальных ферментов, цитокинов) периодические синовиты фиброзные изменения синовии и капсулы сустава потеря функции сустава.
Клиника остеоартроза:
- болевой синдром в крупных суставах (коленных, тазобедренных, голеностопных – т.е. тех, которые несут большую нагрузку): а) боли механического типа - возникают при нагрузке на сустав, усиливаются к вечеру, затихают в покое и ночью б) «стартовые» боли – появляются при первых шагах больного, затем исчезают и вновь возникают при продолжающейся
нагрузке в) «блокадные» боли (периодическое «заклинивание» сустава) – внезапные резкие боли в суставе при малейшем движе-
нии (из-за ущемления кусочка некротизированного хряща между суставными поверхностями); исчезают при определенном движении, ведущем к удалению «суставной мыши» с поверхности хряща
-болезненность при пальпации пораженных суставов
-ограничение объема движений, снижение функциональных способностей сустава
-крепитация при движениях в суставе
-стойкая деформация суставов, обусловленная костными изменениями
-утренняя скованность менее 30 мин
-могут быть нерезко выраженные признаки синовита (отечность, локальная гиперемия, усиление боли)
Клинические особенности поражения отдельных суставов:
а) коксартроз – наиболее частая и самая тяжелая форма ОА, приводящая к инвалидности; клинически обычно больной начинает прихрамывать на больную ногу, затем появляются и постепенно усиливаются боли в паховой области с иррадиацией в колено, хромота, ограничение ротации бедра кнутри и его отведения, позже – ограничение ротации бедра кнаружи и его приведение, сгибание и разгибание, развивается атрофия мышц бедра и ягодицы, сгибательная контрактура, укорочение конечности, изменение походки и нарушение осанки б) гонартроз – более благоприятное течение, чем у коксартроза; распространен у женщин (при ожирении характерен первичный
билатеральный ОА); клинически: боль с внутренней или передней стороны сустава при ходьбе, особенно по лестнице, проходящая в покое; нестабильность сустава, хруст при активных движениях, утренняя скованность в пределах 30 мин в) ОА мелких суставов кистей – чаще поражаются дистальные (70%), чем проксимальные (30%) межфаланговые суставы и за- пястно-пястный сустав большого пальца, клинически характерны:
-наличие твердых узелков (за счет остеофитов) на боковых поверхностях дистальных межфаланговых суставов (узелки Гебердена) и на тыльно-боковой поверхности проксимальных межфаланговых суставов (узелки Бушара); в период формирования узелков ощущается жжение, покалывание, онемение, исчезающие после их образования
-боль и скованность в мелких суставах кисти, ограничение движений
-признаки синовита (отечность, локальная гиперемия, усиление болей)
Течение ОА:
а) малосимптомное - чаще в молодом возрасте, больных беспокоят редкие, слабо интенсивные кратковременные боли или хруст в 1-3 суставах после значительной нагрузки; функции суставов не нарушены б) манифестное медленно прогрессирующее – существенные клинико-функциональные проявления ОА во многих суставах
развиваются в течении 5 лет и более после начала заболевания; рентгенологические изменения преимущественно I-II стадии
в) манифестное быстро прогрессирующее – существенные клинико-функциональные проявления ОА во многих суставах развиваются в срок до 5 лет и менее от начала заболевания; рентгенологические изменения преимущественно II-III стадии
Диагностика ОА:
1) рентгенологическое исследование суставов – стадии ОА по Kellgren и Lawrence: 0 - отсутствие рентгенологических признаков
I - кистевидная перестройка костной структуры, минимальный линейный остеосклероз в субхондральных отделах + появление маленьких краевых остеофитов; суставная щель не изменена
II - умеренный остеосклероз + маленькие краевые остеофиты + умеренное сужение суставной щели III - выраженный остеосклероз + большие краевые остеофиты + значительное сужение суставной щели
IV – резкое уплотнение и деформация эпифизов костей, образующих сустав + грубые массивные остеофиты + суставная щель прослеживается с трудом или отсутствует
2)артроскопия – прямое визуальное исследование полости сустава
3)биопсия синовиальной оболочки: покровные клетки расположены в один ряд, ворсины атрофичны, сосудов мало, значительные поля фиброза, жирового перерождения
4)исследование синовиальной жидкости: прозрачная или слабомутная, высокой или средней вязкости, муциновый сгусток плотный; количество клеток в 1 мкл синовиальной жидкости от 500 до 5000, нейтрофилы составляют менее 50%, могут обнаруживаться фрагменты хрящевой ткани.
Лечение ОА:
1.Нормализация массы тела с помощью диеты и спефиальных комплексов физических упражнений
2.Противовоспалительные препараты (НПВС) курсами – для уменьшения болей:
- при умеренных непостоянных болях без признаков воспаления – ненаркотические анальгетики центрального действия (парацетамол до 4 г/сут)
118
-при выраженных болях и признаках воспаления – НПВС в половинных дозах от максимальных: диклофенак 75 мг/сут, ибупрофен 1,2 г/сут и др.
-при наличии заболеваний ЖКТ, АГ – селективные ингибиторы ЦОГ-2 (мовалис, нимесулид, целебрекс)
NB! Не назначают НПВС, которые негативно влияют на синтез гликозаминогликанов (индометацин)
3.Хондропротекторы: хондроитин сульфат (структум) 1000-1500 мг/сут в 2-3 приема, глюкозамина сульфат (дона –200S) 1500 мг/сут однократно, препараты гиалуроновой кислоты (гиалган, синвиск), неомыляющиеся вещества авакадо и сои (пиаскледин), диацереин (АРТ-50)– блокатор ИЛ-1, алфлутол и др.
4.Хирургическое лечение – протезирование пораженного сустава.
5.Физиотерапия: кинезотерапия, массаж, санитарно-курортное лечение, для купирования явлений синовита – УФО пораженного сустава в эритемных дозах, УВЧ, магнитотерапия, фонофорез гидрокортизона.
6.Реабилитация: образовательные программы; использование трости при ходьбе; ношение подколенников, супинаторов, подпяточных клиньев, стелек.
МСЭ: при первичном ОА общие сроки ВН для лечения в стационаре 10-25 дней.
Реабилитация: ЛФК по щадящей методике, щадящий массаж околосуставной области и регионарных мышц, санаторно-курортное лечение (только при ОА I и II степени без синовита, показаны грязевые курорты с хлоридными, натриевыми, радоновыми водами, в РБ – курорты «Ждановичи», «Нарочь»), ортопедическое лечение (в начальной стадии – фиксация области прикрепления связок и сухожилий пораженного сустава эластическим бинтом, в запущенных случаях – разгрузочные ортопедические приспособления: палки, костыли, эндопротезирование сустава)
83.Ревматоидный артрит: этиология, патогенез, классификация, клиника, диагностика, течение, исходы, лечение.
Ревматоидный артрит (РА) – хроническое системное аутоиммунное заболевание соединительной ткани с преимущественным поражением суставов по типу эрозивно-деструктивного прогрессирующего полиартрита.
Синдром Фелти – вариант РА, включающий хронический полиартрит, спленомегалию, лейкопению.
Эпидемиология: заболеваемость 0,5-1 % населения, пик заболеваемости – 5-ое десятилетие жизни; самое инвалидизирующее поражение суставов – через 10 лет от начала болезни инвалидами являются 50% больных, через 20 лет – все 100%.
Этиология неизвестна, обсуждают участие следующих факторов: а) генетическая предрасположенность (коррелирует с HLA DR4, Dw4 и др. антигенами HLA)
б) инфекционные агенты (на роль этиологического фактора предендуют вирус Эпстайна-Барра (повышенные титры к нему выявляются у 80% больных), ретровирусы, вирусы краснухи, герпеса, микоплазмы, микобактерии)
Патогенез РА:
1. В основе – генетически детерминированные аутоиммунные процессы, возникающие из-за дефицита Т-супрессорной функции лимфоцитов под влиянием неизвестного этиологического фактора. В дебюте процесса характерна АГ-специфическая активация Т- хелперов с гиперпродукцией провоспалительных (ФНО - важнейший фактор, ИЛ-1, ИЛ-8 и др.) и относительным дефицитом про-
тивовоспалительных (ИЛ-4 и др.) медиаторов, стимуляция В-лимфоцитов синовии с синтезом ревматоидного фактора – измененного IgМ, иногда IgG или IgA к фрагменту IgG собственных тканей (является аутоантигеном)
2.Повреждение сустава начинается с воспаления синовиальной оболочки (синовита), продуцирующей синовиальную жидкость, затем из-за аутоиммунного воспаления формируется панус – грануляционная ткань, происходящая из воспаленной синовиальной оболочки, состоящая из активно пролиферирующих фибробластов, макрофагов, лимфоцитов и очень богатая сосудами; панус интенсивно растет, прорастает в хрящ и разрушает его с помощью ряда ферментов
3.Хрящ постепенно разрушается и исчезает, происходит его замена грануляционной тканью с развитием анкилоза, деформации сустава, формированием эрозий костей (узур), воспалением околосуставных тканей.
Классификация РА: а) по степени серопозитивности: серопозитивный и серонегативный б) по степени активности: минимальной, средней, высокой
в) по данным рентгенографии суставов: I – околосуставной остеопороз, II – остеопороз + незначительное сужение суставной щели, могут быть единичные узуры, III – остеопороз + резкое сужение суставной щели + множественные узуры, IV – остеопороз + сужение суставной щели + множественные узуры + могут быть костные анкилозы
г) в зависимости от функциональной недостаточности сустава: 0 – отсутствует, I – ограничение профессиональной трудоспособности, II – утрата профессиональной трудоспособности, III – утрата способности к самообслуживанию
Клиника РА:
-за несколько недель-месяцев РА может предшествовать продромальный период (недомогание, усталость, депрессия и др.)
а) суставной синдром
-заболевание начинается чаще всего подостро с постепенного нарастания боли и скованности в мелких периферических суставах (лучезапястных, пястнофаланговых, проксимальных межфаланговых, голеностопных, плюснефаланговых); практически никогда не поражаются суставы позвоночника, дистальные межфаланговые суставы и суставы большого пальца стопы, проксимального межфалангового сустава мизинца (суставы-исключения)
-поражение суставов двустороннее, симметричное (воспалительный синовит)
-боль в области суставов длительная, усиливающаяся при нагрузках и уменьшающаяся ночью, утром выражена сильнее, чем вечером
-утренняя скованность суставов более 1 часа (причины: смещение в дневную сторону пика секреции ГКС и индукция воспаления ИЛ-6, пик синтеза которого происходит в ночное время)
-характерны воспалительные изменения мелких периферических суставов: повышение температуры кожи, отек, однако кожа над суставами не гиперемирована
-атрофии межкостных мышц тыла кистей, амиотрофии других мышц вблизи пораженных суставов
-в конечном итоге процесс деструкции в суставах ведет к анкилозу, деформации, контрактурам и затуханию воспаления («ревматоидная кисть»: отклонение пальцев в локтевую сторону – «плавник моржа»; сгибание пальцев в пястно-фаланговых и переразгибание в дистальных межфаланговых суставах –«бутоньеркя»; сгибание пальцев в пястно-фаланговых и дистальных межфаланговых и переразгибание в проксимальных межфаланговых суставах – «шея лебедя»; сгибательная и вальгусная деформация коленного сустава и др.)
б) внесуставные проявления РА:
-конституциональные: слабость, недомогание, похудание, субфебрильная температура
-ревматоидные узелки – скопления иммунных комплексов над пораженными суставами или в области разгибательной поверхности локтевой кости; размеры узелков от 2-3 мм до 4-5 см, безболезненные, могут быть как подвижными (располагаются в подкожной клетчатке), так и неподвижными (располагаются под подкожной клетчаткой)
-сердечно-сосудистые: перикардит, «ранний атеросклероз», дигитальный артериит (вплоть до синдрома Рейно)
-легочные: сухой плеврит, интерстициальный фиброз легких
-поражения НС: компрессионная нейропатия (сдавление нервных стволов из-за деформации суставов), симметричная нейропатия, множественный мононеврит (поражение vasa nervorum), цервикальный миелит
-почечные: амилоидоз, почечный канальцевый ацидоз, интерстициальный нефрит (чаще из-за ЛС)
-гематологические: анемия, умеренный лейкоцитоз, тромбоцитоз; нейтропения при синдроме Фелти
119
Варианты течения РА:
а) медленно прогрессирующий – даже многолетнее существование РА не приводит к тяжелым нарушениям суставов, повреждение суставных поверхностей развивается медленно, долго сохраняется функция суставов б) быстро прогрессирующий – высокая активность процесса с образованием костных эрозий, деформаций суставов или вовлечением внутренних органов в течение первого года болезни
в) без заметного прогрессирования – слабо выраженный полиартрит с незначительной, но стойкой деформацией мелких суставов кистей; лабораторные признаки активности практически не выражены В исходе РА: потеря функции пораженных суставов (из-за деформации, анкилозов, контрактур).
Диагностика РА:
1. Лабораторные исследования:
а) ОАК: умеренная нормохромная анемия, умеренный лейкоцитоз, тромбоцитоз, повышенная СОЭ в период активности заболевания б) БАК: повышение общего белка, диспротеинемия (умеренная гипоальбуминемия, гипергаммаглобулинемия), увеличение СРБ в
периода активности заболевания в) иммунограмма: ревматоидный фактор (у 80% больных, однако он неспецифичен, выявляется у пожилых и в норме, при при
аутоиммунном гепатите и тиреоидите, СКВ, СС, ДМ, при вирусных и бактериальных инфекциях, инфекционном эндокардите, саркоидозе), антинуклеарные антитела (у 40-80%, более специфичны для СКВ); снижение количества Т-лимфоцитов, Т-супрессорной функции, дисиммуноглобулинемия; ЦИК (у 30-50%)
2. Инструментальные исследования:
а) рентгенография суставов – околосуставной эпифизарный остеопороз (крупнопетлистая костная структура, истончение и подчеркнутость контуров кортикального слоя, исчезновение постепенного перехода от серого тона губчатого вещества к более светлому контуру кортикального слоя, «размытость» трабекулярного рисунка эпифиза), сужение суставной щели, краевые эрозии (узуры)
б) радиоизотопное исследование суставов с 99Тс (незначительно включается в неизмененную синовию, при развитии в ней воспаления концентрация изотопа значительно возрастает)
в) биопсия синовиальной оболочки (гипертрофия и увеличение количества ворсинок, пролиферация покровных синовиальных клеток, отложение фибрина на поверхности синовии, очаги некроза)
г) исследование синовиальной жидкости (при РА – мутная, вязкость снижена, количество клеток в мкл 5-25 тыс., нейтрофилов > 75%, мононуклеаров < 25%, присутствуют рагоциты – нейтрофилы с включением в цитоплазме РФ, по форме напоминают тутовую ягоду, общий белок 40-60 г/л, глюкоза 0,5-3,5 ммоль/л, ЛДГ > 300 ЕД, выявляется РФ)
Диагностические критерии РА:
Для постановки диагноза РА необходимо наличие по крайне мере 4-х критериев из следующих:
1.утренняя скованность более 1 часа
2.артрит ≥ 3 суставов (полиартрит)
3.артрит суставов кистей
4.симметричный артрит
5.ревматоидные узлы
6.ревматоидный фактор
7.характерные рентгенологические изменения
Эти признаки должны длиться по крайней мере 6 недель, т.к. иногда другие артриты могут проявляться так же. Лечение РА.
1. Лечение должно быть постоянным (всю жизнь), комплексным (медикаментозное + физиотерапевтическое + санаторно-курорт- ное + хирургическое по показаниям), индивидуальным, этапным.
2. Медикаментозная терапия:
А. Базисная терапия (медленно действующие препараты):
-арава (лефлюнамид) (1-е место по эффективности, применяется > 5 лет)
-метотрексат (2-е место по эффективности, применяется > 20 лет)
-препараты золота (тауредон) (3-е место по эффективности, применяется > 60 лет)
-сульфасалазин (4-е место по эффективности, применяется > 50 лет)
-D-пеницилламин (5-е место по эффективности, применяется > 40 лет)
-азатиоприн (6-е место по эффективности, применяется > 30 лет)
-аминохинолиновые препараты (плаквенил) (7-е место по эффективности, применяется > 40 лет);
Все эти препараты эффективны в 40% случаев, в 30% - побочные эффекты, еще в 30% – нет никакого эффекта; в среднем эффект от базисной терапии наступает через 2 месяца (арава – 1 месяц). Возможно комбинировать базисные препараты (метотрексат + сульфасалазин + плаквенил и др.), но только в случае их патогенетической сочетаемости.
Б. Противовоспалительная терапия:
1)НПВС: традиционные, классические (индометацин, диклофенак 75-150 мг/сут в 2-3 приема, ибупрофен 1,2-3,2 г/сут в 3-4 приема и др.) и селективные ингибиторы ЦОГ-2 (меньше побочных эффектов: мелоксикам / мовалис 7,5-15 мг/сут, нимесулид / нимесил / найз 100 мг/сут в 2 приема, целекоксиб / целебрекс)
- назначить можно любой препарат, обычно начинают с классических, при наличии противопоказаний (язва желудка и ДПК, АГ, заболевания почек) показаны селективные ингибиторы ЦОГ-2 (с них не начинают из-за более высокой стоимости данных ЛС)
- если эффекта нет, препарат меняют (эффективность оценивается уже через 5-7 дней использования)
- основной побочный эффект: поражение ЖКТ в виде диспепсии или язвы (желудка, 12ПК, кишечника); при опасности язв можно использовать ингибиторы протонной помпы (омепразол)
2)ГКС – могут применяться
а) внутрь в малых дозах: 5-7,5 мг преднизолона б) в/в в виде пульс-терапии – только при наличии системных проявлений (кроме амилоидоза почек)
в) внутрисуставно (не > 3 раз/год) – при синовите: дипроспан (бетаметазон), депо-медрол (метилпреднизолон), кеналог (триамцинолон)
Каждому больному должно быть назначено минимум 2 препарата (1 – из А, 1 – из Б), но может быть и больше. Только у 20% больных удается достичь ремиссии заболевания (на каком-то базисном препарате), вторично он уже не эффективен. Все больные РА имеют право на бесплатное амбулаторное лечение, но в приказ включены не все препараты (нет аравы: месяц – 100$ или препаратов золота: месяц – 70$).
Современные тенденции в лечении РА - анти-ФНОα-терапия: Etanercept (Immunex, Enbrel) – растворимый димер ФНОα-рецепто- ра, соединенный с IgG1 (п/к по 2,5 мг 2 раза в неделю), Infliximab (Remicade) – моноклональное антитело против ФНОα (в/в капельно через 8 недель); стоимость годичного курса лечения – 10000-12000$, эти препараты высокоэффективны, т.к. останавливают прогрессирование РА.
3. Физиотерапевтическое лечение – должно быть направлено на уменьшение боли и воспаления, нельзя тепловые процедуры (грязи, озокерит, парафин), можно электро-, лазеро-, бальнеотерапию.
120
