
- •Задача 1.
- •Задача 2.
- •Задача 3.
- •Задача 4.
- •Задача 5.
- •Задача 6.
- •Задача 7.
- •Задача 8.
- •Задача 9.
- •Задача 14.
- •Задача 15.
- •Задача 16.
- •Задача 17.
- •Задача 18.
- •Задача 19.
- •Задача 20.
- •Задача 21.
- •Задача 22.
- •Задача 23.
- •100 Г белка – 16 г n
- •Задача 26.
- •Задача 27.
- •Задача 28.
- •Задача 28.
- •Задача 30.
- •Задача 31.
- •Задача 32.
- •Задача 33.
- •Задача 35.
- •Задача 36.
- •Задача 37.
- •Задача 38.
- •Задача 39.
- •Задача 40.
- •Задача 41.
- •Задача 42.
- •Строение липопротеиновой частицы плазмы крови:
- •Задача 43.
- •Задача 44.
- •Задача 45.
- •Задача 46.
- •Задача 47.
- •Задача 48.
- •Задача 49.
- •Задача 50.
- •Задача 51.
- •Задача 52.
- •Задача 53.
- •Задача 54.
- •Задача 55.
- •Задача 56.
- •Задача 57.
- •Задача 58.
- •Задача 59.
- •Задача 60.
- •Задача 61.
- •Задача 62.
- •Задача 63.
- •Задача 64.
- •Задача 66.
- •Задача 67.
- •Задача 69.
- •Задача 73.
- •Задача 74.
- •Задача 75.
- •Задача 76.
Задача 6.
Необходимо произвести электрофоретическое разделение двух пептидов – вазопрессина свиньи и вазопрессина быка. Последний отличается от вазопрессина свиньи лишь наличием лизина вместо аргинина. При каком рН разделение произойдет наиболее эффективно?
Ответ. Разделение будет более эффективно при рН, равном значению изоэлектрической точки одного из пептидов. В этих условиях этот пептид не будет обладать подвижностью в электрическом поле. Также при выборе рН следует учесть, что пептид с меньшей молекулярной массой будет передвигаться с большей скоростью.
Задача 7.
В приемное отделение больницы поступил 67-летний мужчина с жалобами на сжимающие боли в груди и сильную одышку. Цвет лица и конечностей синюшный, кровь, взятая на анализ, шоколадного цвета. Больной сообщил, что долгое время страдает от стенокардии и принимает препараты изосорбита тринитрата и нитроглицерин. Что послужило причиной резкого ухудшения состояния больного?
Ответ: Метгемоглобинемия, спровоцированная приемом нитратов.
Задача 8.
Больная 42 лет. Жалуется на боли в области почек и при мочеиспускании. При анализе крови изменений не обнаружено. В моче обнаружена кровь, белок – 0,33%, значительное количество осадка. Содержание урогликопротеинов в суточной моче 95 мг. Какое заключение можно сделать на основе анализа мочи? Какие дополнительные биохимические исследования необходимо провести для уточнения диагноза?
Ответ. Содержание урогликопротеидов в моче снижено. Наличие крови и белка в моче может указывать на воспалительный процесс в мочевыводящих путях или о мочекаменной болезни. Необходимо определить содержание мочевой кислоты в моче.
Задача 9.
Экспериментальные данные свидетельствуют, что в некоторых случаях при полном насыщении фермента субстратом тепловая денатурация фермента наступает при более высоких температурах. Чем это объясняется?
Ответ. Согласно теории индуцированного соответствия (теории Кошленда), связываясь с активным центром, субстрат вызывает изменение пространственной формы молекулы фермента и переводит его в более устойчивую, стабильную конформацию при действии температуры.
Задача 10.
В отдельную группу металлоферментов выделены энзимы, содержащие ионы металлов в качестве простетической группы. Примерами таких ферметов являются: цитохромоксидаза, каталаза, пероксидаза. Объясните, почему в роли кофактора чаще всего выступают переходные металлы?
Ответ: Наличие сильного положительного заряда, большое число свободных орбиталей (следовательно, способность связывать большое число лигандов), возможность выступать в роли как акцептора, так и донора электронов – все эти свойства переходных металлов обусловливают их участие в биокатализе в качестве кофакторов.
Задача 11.
Фермент (10мкг) с молекулярной массой 500.000 г/моль превращает 9,6 мкмоль субстрата в минуту при температуре 25С. Подсчитайте число оборотов.
Ответ. Молярная активность (число оборотов фермента) – количество молекул субстрата, которое превращается в продукт одной молекулой фермента (при полном насыщении субстратом) за единицу времени.
9,6/60:10/50000=800сек-1
Задача 12.
Сколько граммов субстрата с молекулярной массой 672 г/моль может преобразовать фермент, если его активность составляет 5 нКат, а время инкубации – 20 сек.
Ответ. 6721011 г.
Задача 13.
|
Концентрация субстрата, М |
Скорость реакции, мкмоль/мин |
Скорость в присутствии ингибитора, мкмоль/мин |
|
610-6 110-5 210-5 610-5 1,810-4 |
20,8 29 45 67,6 87 |
4,2 5,8 9 13,6 16,2 |
Проанализируйте данные экспериментов по определению скорости ферментативной реакции при различных концентрациях субстрата, а также в присутствии ингибитора. По имеющимся данным, представленным в таблице, постройте график Лайнуивера–Берка, определите Кm фермента и тип ингибирования.
Ответ:
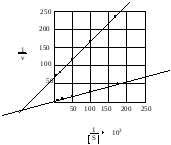
График Лайнуивера-Берка
– график двойных обратных величин
( против
против ).
).
Отрезок на горизонтальной оси = -1/Кm
Отрезок на вертикальной оси = 1/Vmax
Тип ингибирования неконкурентный, т.к. в присутствии ингибитора Кm (т.е. сродство фермента к субстрату ) не изменилась.
