
- •Задача 1.
- •Задача 2.
- •Задача 3.
- •Задача 4.
- •Задача 5.
- •Задача 6.
- •Задача 7.
- •Задача 8.
- •Задача 9.
- •Задача 14.
- •Задача 15.
- •Задача 16.
- •Задача 17.
- •Задача 18.
- •Задача 19.
- •Задача 20.
- •Задача 21.
- •Задача 22.
- •Задача 23.
- •100 Г белка – 16 г n
- •Задача 26.
- •Задача 27.
- •Задача 28.
- •Задача 28.
- •Задача 30.
- •Задача 31.
- •Задача 32.
- •Задача 33.
- •Задача 35.
- •Задача 36.
- •Задача 37.
- •Задача 38.
- •Задача 39.
- •Задача 40.
- •Задача 41.
- •Задача 42.
- •Строение липопротеиновой частицы плазмы крови:
- •Задача 43.
- •Задача 44.
- •Задача 45.
- •Задача 46.
- •Задача 47.
- •Задача 48.
- •Задача 49.
- •Задача 50.
- •Задача 51.
- •Задача 52.
- •Задача 53.
- •Задача 54.
- •Задача 55.
- •Задача 56.
- •Задача 57.
- •Задача 58.
- •Задача 59.
- •Задача 60.
- •Задача 61.
- •Задача 62.
- •Задача 63.
- •Задача 64.
- •Задача 66.
- •Задача 67.
- •Задача 69.
- •Задача 73.
- •Задача 74.
- •Задача 75.
- •Задача 76.
Задача 1.
Подавляющее большинство протеиногенных аминокислот дают синее окрашивание с нингидрином, а пролин и оксипролин – желтое. Объясните это различие, принимая во внимание химизм нингидриновой пробы и особенности структуры протеиногенных аминокислот.
Ответ. Нингидрин является специфичным реагентом для -аминокислот, тогда как пролин и оксипролин являются иминокислотами. С -аминокислотами нингидрин реагирует по следующей схеме:
нингидрин α - аминокислота
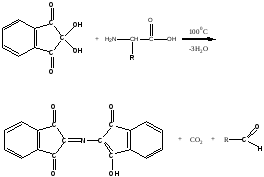
продукт реакции сине-фиолетового цвета альдегид
(светопоглощение в области 550-570 нм)
Задача 2.
Одним из наиболее распростаненных трипептидов животных, растительных и бактериальных клеток является глутатион. Функции глутатиона (глу-цис-гли) разнообразны: участвует в транспорте аминокислот, инактивации инсулина, является источником ά-аминоазота в головном мозге. предохраняет ряд белков со свободными тиольными группами от окисления. Объясните участие глутатиона в окислительно-восстановительных процессах, учитывая его строение.
Ответ. По химической природе глутатион представляет трипептид: γ-глутамилцистеинилглицин следующего строения:
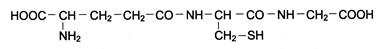
Наличие цистеина в составе глутатиона обусловливает возможность существования глутатиона как в восстановленной, так и в окисленной форме. При окислении глутатиона происходит межмолекулярное взаимодействие трипептидных фрагментов за счет дисульфидной связи, причем этот процесс обратим.
Задача 3.
Сделайте предположение об аминокислотном составе впервые выделенного пептида, принимая во внимание следующие экспериментальные данные:
- пептид не обладает электрофоретической подвижностью в щелочной среде (рН 9,8);
- при электрофорезе в кислой среде (рН 5,6) движется к катоду;
- не дает окрашивания при обработке концентрированной азотной кислотой (ксантопротеиновая проба отрицательна).
Ответ. Аминокислотный состав пептида отличается высоким содержанием диаминомонокарбоновых кислот – лизина и аргинина, в то же время, в структуре пептида отсутствуют ароматические и гетероциклические аминокислоты - фенилаланин, тирозин, гистидин и триптофан, дающие положительную ксантопротеиновую реакцию.
В частности, тирозин с концентрированной азотной кислотой реагирует по следующей схеме:
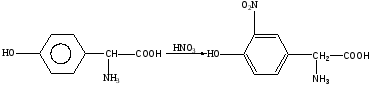
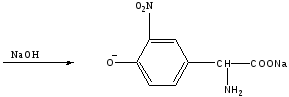 Оранжевая
окраска
Оранжевая
окраска
Задача 4.
Белок, синтезируемый in vivo, принимает биологически активную конформацию. В то же время, при синтезе белка in vitro не всегда удается получить функционально активный белок, даже при отсутствии сбоев, ошибок в первичной структуре. Объясните этот феномен.
Ответ. В живой клетке процесс укладки синтезируемой полипептидной цепи – фолдинг регулируется особыми белками шаперонами, называемыми также белками теплового шока. Эти белки контролируют формирование стабильной и биологически активной конформации, предотвращая образование из полипептидной цепи неспецифических клубков и агрегатов, а также участвуют в доставке белков к субклеточным мишеням.
Задача 5.
При электрофорезе на бумаге белка сыворотки крови больного Р.С. получили следующие результаты: альбумины-48,5%, α1-глобулины-12,6%, α2-глобулины-7,3%, β-глобулины-14,8%, γ-глобулины-16,8%. Выделите изменения, обнаруженные в белковом спектре крови больного и рассчитайте величину белкового коэффициента, содержание альбуминов и глобулинов в г/л, если общее содержание белка в крови у данного больного составляло 62 г/л.
Ответ. Снизилось процентное содержание альбуминов (в норме альбумины составляют 55,4-78,9%), повысилось содержание α1- и β-глобулинов. Белковый коэффициент снижен и составляет 0,93. Альбуминов в сыворотке крови больного содержится 30 г/л, глобулинов – 32 г/л.
