
- •Будова твердої речовини. Основні поняття та визначення
- •1.1. Кристалічні структури. Недосконалості структури матеріалів
- •1.2. Поверхня твердого тіла
- •1.3. Поверхнева енергія
- •1.4. Адсорбція
- •1.5. Окислення
- •1.7. Підготовка поверхонь
- •2. Методи інженерії поверхні
- •2.1. Основні поняття та визначення
- •2.2. Класифікація методів інженерії поверхні
1.5. Окислення
Речовини і матеріали, які застосовуються у техніці, навіть дуже чисті, завжди містять деяку кількість чужорідних атомів. Ці домішкові атоми, виявляючись на поверхні, відіграють роль хімічних дефектів. Елемент, що є присутнім у металі в невеликих кількостях, часто може концентруватися на поверхні, впливаючи на її стан і енергію. Особливо велика роль хімічних дефектів у процесах окислення металів. Оскільки перебудова поверхні і приповерхнього шару металу не приводить до повної втрати її хімічної активності, в умовах навколишнього середовища метали швидко вкриваються тонким шаром оксидів товщиною від декількох десятків до декількох сотень ангстрем.
Блиск
металевої поверхні не зникає до товщини
плівки оксидів 100
![]() .
Оксидна плівка на “свіжій” металевій
поверхні утворюється при звичайній
температурі протягом кількох годин, а
іноді і днів.
.
Оксидна плівка на “свіжій” металевій
поверхні утворюється при звичайній
температурі протягом кількох годин, а
іноді і днів.
Розміщення
металу в досить глибокий вакуум (![]() Па) не усуває окислювання, а лише його
уповільнює.
Па) не усуває окислювання, а лише його
уповільнює.
Тільки золото, платина, срібло не мають на поверхні оксидних плівок при звичайних температурах. Вони покриті так званим комплексом адсорбції кисню. Комплекс адсорбції відрізняється від оксиду структурою і міцністю хімічних зв’язків і може бути цілком вилучений нагріванням твердого тіла.
Властивості металевої поверхні, вкритої шаром адсорбованого кисню, відрізняються від властивостей поверхні металу, вкритої оксидом. Будова адсорбованої плівки двовимірна, тобто атоми кожного виду мають кількість сусідів, що відрізняється від їх кількості в оксидній плівці.
18
Плівку хемосорбованого кисню необхідно розглядати як хімічну речовину з визначеною структурою і термодинамічними . константами, здатну до участі в рівноважних процесах. Дуже важливою особливістю цієї плівки є те, що вона зв’язана з металевою основою.
Адсорбована плівка містить у собі не тільки атоми адсорбованої речовини, але і поверхневі атоми металу. Ці атоми зв’язують тверде тіло з адсорбованою речовиною і тому знаходяться в зовсім іншому стані, ніж атоми в об’ємі твердого тіла. З боку атмосфери плівка вкрита фізично адсорбованим киснем.
Хімічний зв’язок між киснем і атомами поверхні металу – іонний. Передача електронів від металу до кисню при утворенні зв’язку призводить до появи негативного заряду на плівці і позитивному заряду на її внутрішній поверхні.
Зв’язок між адсорбованим киснем і основою значно сильніший за зв’язок між киснем і металом в оксиді. Дослідження енергії зв’язку металів з киснем при окислюванні, вказують на зменшення теплоти адсорбції із зростанням
товщини адсорбованого газу. Найміцніше зв’язані з металом перші шари оксиду.
Згідно
сучасних уявлень, утворення плівки
оксиду починається і проходить через
ряд різних адсорбційних станів,
характерних для хемосорбції на металевій
поверхні. Наприклад, для систем
![]() і
і![]() хемосорбція на кожній грані кристала
може бути поділена на наступні стадії,
що послідовно протікають:
хемосорбція на кожній грані кристала
може бути поділена на наступні стадії,
що послідовно протікають:
1) хемосорбція на непорушеній металевій поверхні;
2) атомне перегрупування, при якому поверхневі атоми металу залишають свої місця. Цю стадію називають корозійною хемосорбцією;
3) адсорбція додаткових молекул газу на іонах металу, що виникають внаслідок процесів перебудови при атомному перегрупуванні за п. 2.
Стадія атомного перегрупування при хемосорбції азоту й оксиду вуглецю на вольфрамі відбувається вже при кімнатній і навіть більш низькій температурі.
Схематично поява плівки оксиду на поверхні металу з хемосорбованого кисню (рис. 1.8, а) можна представити як результат перебудови атомів металу і кисню поблизу поверхні таким чином (рис. 1.8, б), щоб просторовий розподіл
цих двох видів атомів був близьким до того, що спостерігається в оксиді. Перебудова припускає міграцію на невеликі відстані поверхневих атомів металу й атомів кисню, що вимагає значної енергії активації. При зміні взаємного розташування атомів відбувається збільшення кількості найближчих сусідів як для атомів металу, так і для атомів кисню. У результаті структура упорядковується, зменшується асиметричність зв’язків метал – кисень в адсорбованій плівці і відновлюється іонний характер зв’язків, який має місце в оксиді.
19
0 0 0 Me Me Me 0 Me Me Me 0 0 Me Me Me Me Me Me

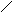


















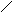







Me Me Me Me Me Me Me Me




















Me
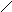



Me Me Me Me

Me
a б
Рис. 1.8. Схема процесу появи плівки оксиду на поверхні металу: а – стадія хемосорбції; б – стадія перебудови
1.6. Поверхнева сегрегація
При нагріванні чи деформації твердого тіла атоми виду А, розчинені в матриці з атомів В, можуть дифундувати і збиратися поблизу поверхні твердого тіла (рис.1.9, а). Це явище має назву поверхневої сегрегації.

Рис. 1.9. Перерозподіл домішок поблизу вільної поверхні: а – сегрегація; б – збідніння поверхні; в – скупчення домішок поблизу поверхні; г – утворення вторинних фаз
Сегрегація змінює поверхневу енергію що, у свою чергу, впливає на фрикційні та адгезійні властивості твердого тіла.
Поверхнева сегрегація може сильно змінити взаємодію поверхні з навколишнім середовищем, наприклад, мастильними матеріалами.
20
У сталі навіть при невеликій добавці кремнію формування захисних мастильних плівок визначається взаємодією молекул мастильних речовин з атомами кремнію, а не заліза.
Іноді спостерігається явище, зворотне поверхневій сегрегації – збідніння приповерхньої зони атомами легуючої домішки (рис.1.9, б). Механізм цього явища може бути різним.
Якщо атоми домішки мають велику леткість, вони залишають поверхню при нагріванні. Таке явище часто спостерігається при розчиненні газів у металі. Можлива дифузія домішковіх атомів з поверхневого шару в об’єм матеріалу. У цьому випадку властивості поверхні визначаються, в першу чергу, властивостями атомів основного матеріалу, а не розчинника.
Можлива ситуація, коли домішкові атоми скупчуються поблизу поверхні (рис. 1.9, в). На відміну від сегрегації зона високої концентрації атомів не локалізується на самій поверхні. Прикладом може бути азотування. Насичення азотом приповерхнього шару заліза приводить до його зміцнення за рахунок виділення нітридів заліза.
Азот не локалізований на поверхні, а у складі хімічної сполуки із залізом розташовується у приповерхневому шарі.
Зміна складу поверхневого шару може бути обумовлена також утворенням на поверхні вторинної фази (рис. 1.9, г). Така ситуація можлива, якщо елементи А і В сплаву утворюють між собою хімічну сполуку. За умови, коли концентрація домішковіх атомів А зростає і, з зрештою, починає перевищувати межу розчинності, утворюється сполучення чи вторинна фаза. Сполука може виникати на самій поверхні, що надає їй нові властивості, які відрізняються від об'ємних властивостей матеріалу. Прикладом може бути утворення нової фази при розчиненні вуглецю в залізі. При досягненні досить високої концентрації вуглецю в сталі з'являється нова фаза – карбід заліза.
Розповсюдженим дефектом кристалічних поверхонь є границі зерен. З ними пов'язана наявність надлишкової енергії і сегрегація найбільш інтенсивно протікає саме поблизу границь. Хоча значна частина міжзеренної границі знаходиться всередині матеріалу, вона значно впливає на поверхневі властивості. Інтенсивна сегрегація домішковіх атомів поблизу границі зерна також впливає на поверхневі, у тому числі, фрикційні властивості. При терті ковзання домішка, локалізована поблизу міжзеренної границі, розосереджується по всій контактній поверхні, а самі границі відіграють роль своєрідних резервуарів для домішковіх атомів.
21
