
- •Будова твердої речовини. Основні поняття та визначення
- •1.1. Кристалічні структури. Недосконалості структури матеріалів
- •1.2. Поверхня твердого тіла
- •1.3. Поверхнева енергія
- •1.4. Адсорбція
- •1.5. Окислення
- •1.7. Підготовка поверхонь
- •2. Методи інженерії поверхні
- •2.1. Основні поняття та визначення
- •2.2. Класифікація методів інженерії поверхні
Будова твердої речовини. Основні поняття та визначення
1.1. Кристалічні структури. Недосконалості структури матеріалів
Тверда речовина існує у двох основних формах: кристалічній і аморфній.
Характерна риса кристалів – фіксована температура плавлення. При нагріванні кристалічна речовина залишається твердою до визначеної температури, а потім починає плавитися, переходячи в рідкий стан.
Аморфні речовини при нагріванні поступово розм’якшуються і, нарешті, розтікаються, приймаючи форму судини.
Аморфні речовини мають однакові властивості в усіх напрямках і їх називають ізотропними. У цьому відношенні вони подібні рідинам і газам.
Найбільш важливою особливістю кристалічної речовини є упорядковане розташування її атомів. Такі конфігурації мають більш низьку енергію і тому більш стійкі, ніж при хаотичному розташуванні атомів.
При розгляді умовної внутрішньої будови кристала і аморфної речовини того ж складу виявляється (рис.1.1), що оточення кожного з атомів, позначених чорними крапками, майже однаково: найближчі сусіди розташовуються по вершинах правильного трикутника при кристалічному стані і майже правильного при аморфному.
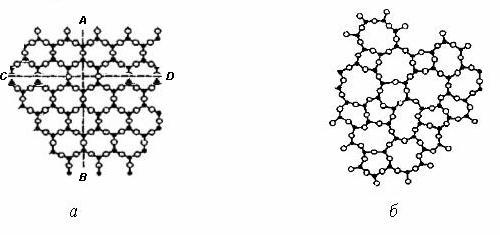
Рис. 1.1. Розташування атомів у кристалічній (а) і аморфній (б) речовинах однакового складу
Із середини 80-х років починається дослідження матеріалів, які мають квазікристалічну структуру або квазікристалічну фазу у своєму складі. Квазікристалам характерна наявність осі симетрії п’ятого порядку.
Згідно із вченням про симетрію типовою операцією симетрії є обертання навколо осі, яка проходить через будь-яку точку гратки.
4
При різних осях симетрії кристал співпадає сам із собою при повертанні навколо осі на 2p, 2p/2, 2p/3, 2p/4 або 2p/6. За законами класичної кристалографії у кристалів нема симетрії 5-го або вище 6-го порядків, бо це не узгоджується із вимогами симетрії трансляції (площина не може бути заповнена правильними п’ятикутниками або будь-якими правильними багатокутниками із числом сторін більшим за шість). Осі обертання (симетрії) називаються обертальними осями (осями обертання) і позначаються цифрами 1, 2, 3, 4 та 6. Мінімальний кут, на який потрібно повернути тіло навколо осі симетрії, називається елементарним кутом повертання осі. Обертальну вісь можна характеризувати іншою величиною, яка називається порядком осі. Ця величина вказує, скільки разів пройде суміщення при повертанні на 360°.
Для аналітичного опису трьох- або двомірного упорядкованого середовища використовуються кристалографічні індекси точок, прямих та площин у кристалі. При цьому точки – це атоми, які знаходяться у вузлах кристалічної гратки, прямі – напрямки, вздовж яких розміщені атоми, площини – атомні площини.
Для знаходження кристалографічних координат точки необхідно знайти декартові координати точки у вибраній системі кристалографічних осей.
Наприклад, для зафарбованого атома, рис.1.2, це а, b, c. Потім координати перераховуються у одиницях періодів гратки по кристалографічних осях (для конкретної точки відповідно 1, 1, 1). Отримані числа називаються кристалографічними координитами точки. Їх записують у вигляді трійки чисел (у двомірному випадку двійки) у подвійних квадратних дужках – [[111]].
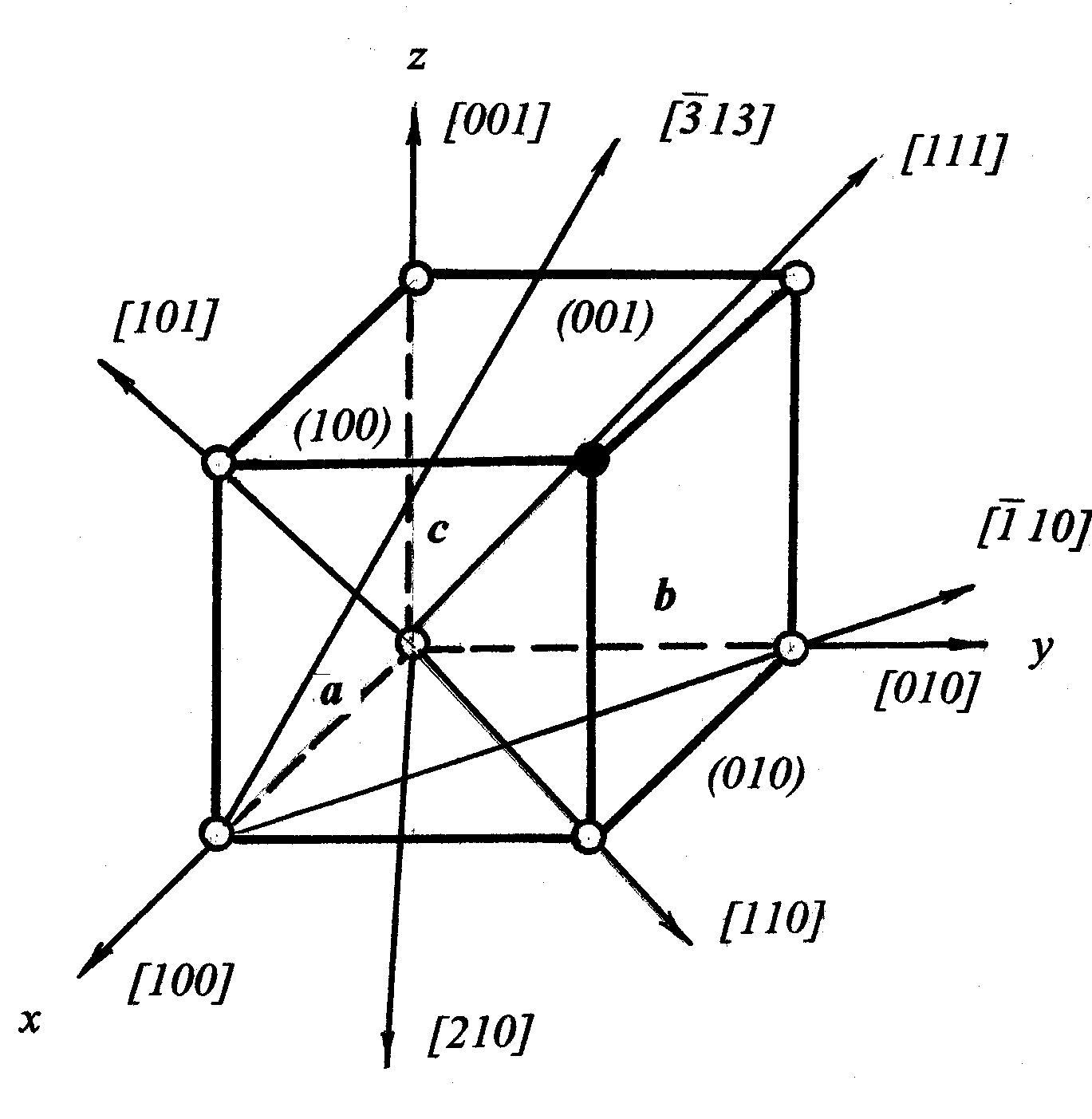
Рис.1.2. Основні площини та кристалографічні напрямки у кубічному кристалі
5
Кристалографічні координати прямої задаються кристалографічними індексами найближчого до початку координат атома, що знаходиться на цій прямій. Позначаються координати трійкою цілих чисел у квадратних одинарних дужках. Наприклад, [111] для діагоналі у кубічній гратці (рис.1.2).
Орієнтація площин характеризується індексами Міллера. Для цього визначаються точки перетину площини з трьома осями і координати отриманих
точок виражаються у відносних одиницях, що відповідають параметрам гратки a, b, c. Потім визначаються величини, зворотні отриманим числам. Якщо є хоча б одна дрібна величина, то всі числа замінюються трьома найменшими числами, що співвідносяться між собою у тій же пропорції. Індекси Міллера для площини даються у круглих дужках (рис.1.2).
Розтушування атомів по гранях кристалів з різними індексами неоднаково. Саме це визначає анізотропію властивостей кристалів, тобто зміну властивостей по різних напрямках.
В аморфній речовині спостерігається так званий «ближній» порядок. У кристалічній речовині, на відміну від аморфної, спостерігається «далекий» порядок, що і визначає всі особливі властивості кристалів. Так, у напрямку АВ, паралельному напряму деяких зв’язків між атомами, властивості не
відповідатимуть таким у напрямку СД, уздовж якого такі зв'язки не проходять. В аморфній речовині подібних специфічних напрямків немає.
У кристалічних матеріалах цілий ряд явищ пов'язаний із процесами упорядкування - розупорядкування. Сутність упорядкування полягає в тому, що атоми розчиненого елемента займають цілком визначені позиції в матриці розчинника.
У випадку розупорядкування атоми основи і розчинника займають випадкове положення.
При переходах упорядкування - розупорядкування істотно змінюються не тільки фізичні, механічні, але і фрикційні властивості твердих тел.
У твердих кристалічних матеріалах розташування атомів чи молекул є структурою, яка періодично повторюється у трьох вимірах. Порядок, притаманний розташуванню атомів твердого тіла, часто приводить до симетрії його зовнішньої форми, особливо якщо кристали вирощені в спеціальних умовах. Наприклад, порошки металів і сполук, отримані відновленням чи конденсацією з парової фази, зазвичай мають чітке огранювання.
У більшості хімічних сполук, які використовуються як покриття (оксиди, карбіди, нітриди, бориди), кристалічні структури дуже складні.
Розглянемо основні геометричні співвідношення і властивості кристалічних структур на металах, що мають більш просту будову.
Найпростішою структурою (рис. 1.3, а) є проста кубічна (ПК). В елементарному кубі такої структури атоми розташовані тільки у вершинах куба. Тому атоми торкаються один одного вздовж ребер куба. Ця структура має нещільне упакування. Кожен атом має всього 6 найближчих сусідів.
6
Структура зустрічається дуже рідко, однак, дозволяє більш складні кристалічні структури представляти як набір уставлених друг у друга простих кубічних підграток. Наприклад, об’ємоцентровану кубічну (ОЦК) гратку можна розглядати як систему з двох однакових простих кубічних граток, причому в одній з них атоми знаходяться у вершинах кубів, а інша містить центральні атоми.
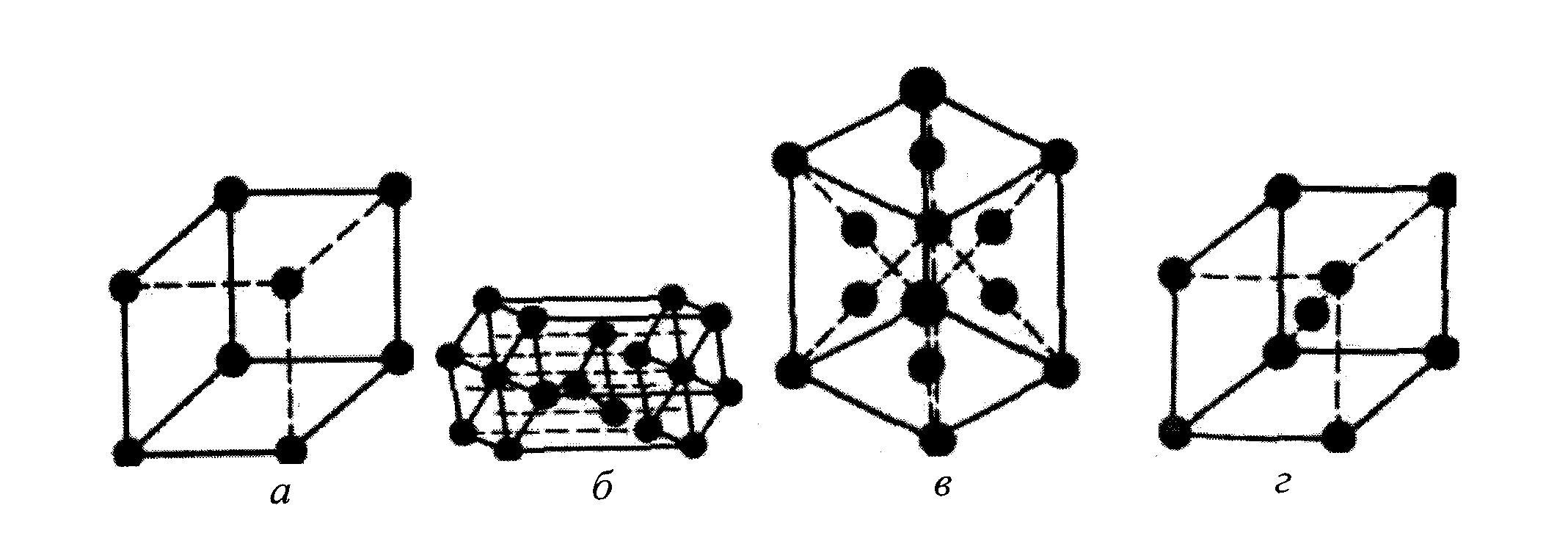
Рис. 1.3. Розташування атомних центрів: а – проста кубічна гратка; б – кристал із гексагональною щільно упакованою структурою (ГЩУ); в – гранецентрована кубічна (ГЦК) гратка; г – об’ємоцентрована кубічна (ОЦК) гратка
У металів часто зустрічається гексагональна щільно упакована (ГЩУ) структура (рис. 1.3, б). Вона виникає при складанні щільно упакованих площин у простій послідовності: дві щільно упаковані площини стикаються одна з одною таким чином, що кожний атом однієї площини міститься в поглибленні
між трьома атомами сусідньої площини. Ця структура називається щільно упакованою тому, що вона має максимально можливу щільність упакування. Кожний атом оточений дванадцятьма найближчими сусідами: шість знаходяться в тій же площині, три – у верхній площині і три – у нижній площині. Відстань між центрами сусідніх атомів називається атомним діаметром (а).
У гранецентрованій кубічній (ГЦК) гратці атоми (рис. 1.3, в) займають усі вершини куба і центр кожної грані. Атоми торкаються один одного уздовж діагоналей граней. ГЦК структура також щільно упакована, кожен атом має дванадцять найближчих сусідів.
Методи укладання щільно упакованих площин, що приводять до побудови кристалічних структур ГЩУ і ГЦК, практично вичерпують усі найпростіші способи укладання. Однак багато матеріалів мають структури, що утворюються не із щільно упакованих площин. Одна з таких структур – об’ємоцентрований куб (ОЦК) (рис. 1.3, г). Такий елементарний осередок є кубом з атомами в кожній вершині і в центрі куба. Структура не має щільного упакування, оскільки кожний атом оточений тільки вісьма сусідами.
7
Зіткнення атомів відбувається вздовж діагоналей куба.
Усі хімічні сполуки мають інші, більш складні структури. Багато з них є комбінаціями однієї з тільки що розглянутих основних кубічних структур. У таких комбінаціях одні гратки проникають усередину інших. Наприклад, структура алмаза є сполученням двох ГЦК підграток, вставлених одна в одну. Така структура не є щільно упакованою, тому що кожний атом оточений тільки чотирма найближчими сусідами.
Практичний інтерес представляють наступні характеристики атомної будови:
1) координаційне число, тобто кількість найближчих сусідніх атомів;
2) атомний радіус, що є половиною відстані між найближчими сусідами в кристалі (ця відстань дається в частках ребра куба а);
3) відносна щільність упакування, що є відношенням об’єму, зайнятого сферичними атомами, до об’єму, який зайнятий структурою.
У табл. 1.1. наведені розрахункові формули для визначення характеристик атомної будови основних типів кристалічних структур.
В реальних кристалічних тілах існують суттєві порушення порядку розташування атомів. Порушення кристалічної будови можуть бути настільки значними, що їх вплив на властивості матеріалу стає вирішальним.
Порушення насамперед пов’язані з рухомістю атомів матеріалу. Крім енергії положення (потенційна енергія) атоми мають певний запас енергії руху (кінетична енергія). Інтенсивне коливання атомів навколо вузлів кристалічної гратки не припиняється навіть при температурі близькій до абсолютного нуля.
Таблиця 1.1. Розрахункові формули для визначення характеристик кристалічних структур
|
Тип структури |
ПК |
ОЦК |
ГЦК |
Гратка алмазу |
|
Координаційне число |
6 |
8 |
12 |
4 |
|
Атомний радіус |
|
|
|
|
|
Кількість атомів в елементарному кубі |
1 |
2 |
4 |
8 |
|
Щільність упаковки |
|
|
|
|
|
Кількість атомів у другій координаційній сфері |
12 |
6 |
6 |
12 |
В результаті обміну кінетичною енергією атоми з підвищеною енергією долають оточуючі їх потенційні бар’єри і переходять з вузлів кристалічної гратки у міжвузілля або оточуючий простір.
Атом, який вийшов із рівноважного положення у міжвузілля прийнято називати дислокованим, а порожнє місце у вузлі гратки, яке залишене атомом – вакансією, чи діркою (рис. 1.4).
8
Дислоковані атоми і вакансії– це дефекти гратки, які викликають її спотворення по радіусу приблизно на п’ять міжатомних відстаней у всіх напрямках від дефекту.
Такого роду дефекти не залишаються нерухомими, а переміщуються по гратці.
Суттєвий вплив на будову металу і відповідно його властивості мають розчинені домішки – чужорідні атоми, які розташовані у кристалічній гратці.

Рис. 1.4. Спотворення кристалічної гратки навколо дислокованого атома (а) та вакантного місця (b) в розчині заміщення (c) і вкорінення (d)
Порівняно невеликі атоми деяких металоїдів (наприклад, вуглець, водень, азот і бор) розташовуються у гратці таких металів, як залізо, нікель, кобальт, між атомами основного металу (у міжвузіллі). В результаті такої взаємодії з домішками утворюються розчини, які називають розчинами вкорінення (позиція d на рис. 1.4).
В більшості випадків атоми домішок розташовуються у вузлах кристалічної гратки, заміщуючи в них атоми металу основи. Такі розчини прийнято називати розчинами заміщення (позиція c на рис. 1.4).
Оскільки чужорідні атоми за своєю фізичною природою і розмірами відрізняються від атомів основного металу, їх наявність викликає спотворення кристалічної гратки. Спотворення тим більше, чим сильніше атоми розчинника відрізняються від розчинених атомів.
У сучасних уявленнях про фізичну природу міцності головна роль відводиться особливого роду дефектам, які називають дислокаціями.
Відрізняють два основних види дислокацій: крайові (або лінійні) і гвинтові.
Якщо в частину об’єму монокристала вставити зайву атомну площину, то спотворення монокристала буде зосереджено з краю введеної площини.
9
Під крайовою дислокацією розуміють лінію спотворення, що проходить по краю зайвої атомної площини. Тому дислокація є лінійним дефектом, на відміну від точкових дефектів. Область поблизу дислокаційної лінії, де спотворення гратки найбільш значні, називають ядром дислокації.
Якщо взяти монокристал і розрізати його умовно на деяку глибину, а потім зрушити одну частину монокристала відносно іншої його частини вздовж площини розрізу на один параметр гратки, отримаємо ще один вид дефекту кристалічної гратки.
Лінія спотворень, що йде вздовж краю розрізу, називається гвинтовою дислокацією.
Переміщення гвинтової дислокації по поверхні приводить до утворення сходинки (рис. 1.5.).
Рис.1.5. Дислокації: а – крайова; б – гвинтова
Дефекти атомної структури поверхні є хімічно активними центрами, тобто місцями переважної адсорбції атомів і молекул з газової фази, а також атомів, що дифундують з об’єму матеріалу. У зв'язку з цим введено термін "активні центри". Імовірність адсорбції на поверхні збільшується за експонентою при збільшенні щільності активних центрів, наприклад, сходинок, і може змінюватися в межах трьох і більше порядків.
У металевих кристалах найбільш типовими мікроскопічними недосконалостями в об’ємі є дислокації і дефекти упакування. Щільність дислокацій звичайно коливається від 103 на 1 см2 у найбільш досконалих монокристалів і до 1011 ...1012 на 1 см2 у сильно деформованих металів.
Дислокації впливають не тільки на такі механічні властивості твердих тіл, як пластичність і міцність, для яких присутність дислокацій є визначальною, але й на інші фізичні властивості кристалів. Наприклад, зі збільшенням числа дислокацій зменшується щільність кристала, зростає внутрішнє тертя, змінюються оптичні властивості, підвищується електроопір. Дислокації збільшують середню швидкість дифузії в кристалі і прискорюють старіння й інші процеси, що протікають за участю дифузії.
10
