
- •Конспект лекций
- •Лекция 1
- •Основные определения
- •Лекция 2
- •Лекция 3
- •Лекция 4
- •Теплотворная способность
- •Добыча, потребление и значение ископаемого топлива
- •Лекция 5
- •Лекция 6
- •Классификация вв
- •Физико-химические характеристики вв Консистенция и структура
- •Физическая стабильность вв
- •Реакции взрывчатого превращения
- •Лекция 7
- •4.2. Общие сведения о взрывчатых веществах
- •Лекция 8
- •Физико-химические характеристики вв
- •Классификация вв
- •Инициирующие вв
- •Бризантные вв
- •Бризантные вв повышенной мощности
- •Лекция 9
- •Нитроглицериновые вв нормальной мощности
- •Вв, находящееся в стадии исследований
- •Жидкие вв и жидкие смесевые вв
- •Вв жидкие смеси
- •Оксиликвиты
- •Суррогатные вв
- •Лекция 10
- •Взрывная волна
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Если нельзя применять диоксид углерода (например, при горении металлов
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Строительные материалы. Строительные конструкции. Сравнительная оценка пожарной опасности лакокрасочных покрытий. Эвакуация людей при пожаре
- •Библиографический список рекомендуемой литературы
Лекция 5
ФИЗИЧЕСКИЕ И ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ГАЗОВ: ГАЗОВЫЕ И ЖИДКИЕ СМЕСИ И ИХ СВОЙСТВА.
ПЛОТНОСТЬ ГАЗОВ.
ВЛАЖНОСТЬ ГАЗОВ.
ТЕПЛОЁМКОСТЬ ГАЗОВ.
СОСТАВ ПРОДУКТОВ ВЗРЫВА.
ЗАДАЧИ И ОСНОВНЫЕ ПРИНЦИПЫ ПРИБЛИЖЕННЫХ МЕТОДОВ РАСЧЕТА СОСТАВА ПРОДУКТОВ ВЗРЫВА ВВ
Основными компонентами природных углеводородных газов являются газообразные парафиновые углеводороды: метан, этан, пропан, бутан.
Более тяжелые парафиновые углеводороды (пентан) составляют ничтожные количества.
В искусственных газах, кроме парафиновых, содержаться также непредельные, т.е. олефиновые углеводороды.
В естественных и искусственных газах в некоторых количествах могут быть CO2, N, H2S, H, O2 (CO в искусственных газах).
В коксовом газе преимущественно H.
В генераторном газе – H, N, CO2.
Плотность газов
Плотность,
![]() ,
кг/л, кг/м3.
,
кг/л, кг/м3.
Величина, обратная плотности – удельный (массовый) объем – м3/кг.
Согласно закона Авогадро: плотности газов должны относится между собой как их молекулярные массы
![]()
Удельные объемы (массовые) должны относиться между собой обратно пропорционально их молекулярным массам
![]()
Зная химическую формулу и пользуясь законом Авогадро можно определить плотность любого газа по воздуху
![]()
Плотность газов меняется, в зависимости от внешних условий
ρ увеличивается с увеличением давления,
ρ уменьшается при увеличении t,
ρ увеличивается с увеличением молекулярной массы.
(плотность жидкостей с изменением ρ не меняется)
Изменение плотности насыщенных паров в замкнутом пространстве в зависимости от изменения температуры.
Следует иметь ввиду, что насыщенные пары могут находится над жидкостью в замкнутом объеме.
Влажность газов
Влажность газов может иметь место и является нежелательным явлением, образуется кондуит, т.е. выпадение воды из газа и при низких t – замерзание, ледяные пробки в арматуре
![]() ,
φабс=
,
φабс=
![]() /м2
кг газа;
/м2
кг газа;
![]() /м3
кг газа
/м3
кг газа
![]()
Изменение влагосодержания природных газов в зависимости от t и P. Например – критическая температура – это максимальная температура, при которой жидкая и паровая фазы могут существовать одновременно. Давление паров при этой температуры называют критическими.
При t более tкр при любом давлении где не может быть переведен в жидкое состояние, отсюда следует состояние углеводородного продукта:
для CH4 tкр – (-82,5 °С)
для пропана tкр – (+96,8 °С)
при увеличении t, увеличивается давление в сосуде, и может быть разрыв, нарушение герметичности, утечки и т.д.
Теплоёмкость газов
Для определения количества тепла, участвующего в процессе, вводят понятие об удельной теплоемкости системы:
![]() (1)
(1)
где: Z - масса системы, выраженная в какой-либо количественной единице измерения.
В соответствии с определением (1) удельная теплоемкость представляет собой количество тепла, приходящееся на 1°С изменения температуры какой-либо количественной единицы массы в элементарном процессе. Теплоемкость элементарного процесса называется истиной.
В технической термодинамике наиболее употребительными единицами измерения массы являются кг и кгмоль (в дальнейшем - просто моль).
В соответствии с выбранными единицами измерения различают удельную массовую теплоемкость (в дальнейшем - просто массовую теплоемкость) и удельную мольную теплоемкость (в дальнейшем - просто мольную теплоемкость). По определению (1), если масса системы выражается в килограммах, то Z=m кг, и
![]() (2)
(2)
если же числом молей, то Z = М молей, и
![]() (3)
(3)
где
с,
![]() - массовая и мольная теплоемкости
соответственно,
дж/кг.град, дж/моль.град.
- массовая и мольная теплоемкости
соответственно,
дж/кг.град, дж/моль.град.
Сопоставляя уравнения (1), (2) и (3), легко определить
![]()
откуда
![]() (4)
(4)
Полученная связь между удельными теплоемкостями позволяет определить одну из теплоемкостей, если известна другая. В дальнейшем для целостности изложения будем определять только массовую теплоемкость, имея в виду, что мольную теплоемкость всегда легко вычислить, пользуясь соотношением (4). Если известны величины удельных теплоемкостей, то количество тепла, участвующего в термодинамическом процессе в соответствии с (1), (2) и (3) определится из уравнений:
![]() (5)
(5)
Таким образом, введение понятия о теплоемкости позволяет свести задачу об определении количества тепла к задаче об определении теплоемкости и ее зависимости от различных факторов. Действительно, если бы величина теплоемкости была постоянной, то
![]()
Тогда задача сводится только к определению величины теплоемкости для заданного процесса. Однако в общем случае величина теплоемкости переменна и зависит от ряда факторов. Для выявления этих факторов и способа расчета теплоемкости воспользуемся определением (2) и первым законом термодинамики. В результате получим соответственно:
![]()
(6)
![]()
Для du и для di определим:
![]()
(7)
![]()
Эти
выражения и являются наиболее общими
для теплоемкости.
Из уравнений (7)
следует, что для вычисления теплоемкости
необходимо знать u
=u
(Т, p)
или i=i(T,p),
т.е. одно из калорических уравнений
состояния, и
![]() илир=р(Т)
-
уравнение процесса.
илир=р(Т)
-
уравнение процесса.
При любой форме
выражения теплоемкости знание этих
уравнений является принципиально
необходимым. В том случае, когда
калорическое
уравнение состояния и уравнение процесса
заданы
в различных переменных,
необходимо и термическое уравнение
состояния
F(р,
![]() ,
Т )
= 0.
,
Т )
= 0.
Поскольку для вычисления теплоемкости используется калорическое уравнение состояния, то теплоемкость должна зависеть от структуры системы и параметров состояния. Структура системы определяет явный вид калорического уравнения, а параметры состояния - энергию системы.
Поэтому в самом общем случае, в соответствии с уравнениями (7), теплоемкость зависит от структуры системы, параметров состояния и характера процесса. Обычно выражения для теплоемкости записываются несколько в иной, чей по (7), форме.
Если в первом
уравнении (7) положить
![]() и обозначить теплоемкость этого процесса
и обозначить теплоемкость этого процесса![]() ,
то можно получить
,
то можно получить
![]() (8)
(8)
Совершенно аналогично из второго уравнения (7) для процесса р=соnst найдем
![]() (9)
(9)
С учетом (8) и (9) уравнения (7) можно переписать в следующем виде:
![]()
(10)
![]()
Важно заметить,
что
![]() иср
в принципе не являются характеристиками
соответствующих процессов, а представляют
собой характеристики системы.
иср
в принципе не являются характеристиками
соответствующих процессов, а представляют
собой характеристики системы.
Для определения
численных значений
![]() иср
по (8)
и (9) необходимы только калорические
уравнения состояния.
Поэтому
иср
по (8)
и (9) необходимы только калорические
уравнения состояния.
Поэтому
![]() иср
однозначно определяются энергетическим
состоянием системы и являются, таким
образом, функциями состояния.
иср
однозначно определяются энергетическим
состоянием системы и являются, таким
образом, функциями состояния.
Физический смысл
этих величин непосредственно следует
из
(8) и (9):
![]() характеризует изменение внутренней
энергии, а с - энтальпии, вызванное
изменением только кинетической энергии
элементарных частиц, составляющих
систему.
характеризует изменение внутренней
энергии, а с - энтальпии, вызванное
изменением только кинетической энергии
элементарных частиц, составляющих
систему.
То, что численные
значения теплоемкостей в процессах
![]() и
и![]() совпали с некоторыми энергетическими
характеристиками системы (
совпали с некоторыми энергетическими
характеристиками системы (![]() и
и
![]() ),
объясняется исключительно тем, что
только в этих процессах тепло численно
равно изменению внутренней энергии или
энтальпии соответственно. Уравнения
(10) ничем не отличаются от уравнений
(7), так как
для определения
),
объясняется исключительно тем, что
только в этих процессах тепло численно
равно изменению внутренней энергии или
энтальпии соответственно. Уравнения
(10) ничем не отличаются от уравнений
(7), так как
для определения
![]() и
и
![]() в обоих случаях необходимы те же
калорические уравнения.
в обоих случаях необходимы те же
калорические уравнения.
Определение калорических уравнений состояния реальных систем представляет значительные трудности. Поэтому, как правило, обращаются к идеальному газу. Для идеального газа и и I зависят только от температуры. Тогда
![]()
и из (10) получим:
![]()
(11)
![]()
так как и
и i
не зависят от р
и
![]() .
Физически переход
от частных производных
к полным очевиден: для идеального газа
изменение внутренней энергии и энтальпии
определяется только изменением
кинетической энергии элементарных
частиц.
.
Физически переход
от частных производных
к полным очевиден: для идеального газа
изменение внутренней энергии и энтальпии
определяется только изменением
кинетической энергии элементарных
частиц.
Из (11) следует, что
в случае идеального газа для вычисления
теплоемкости необходимо знать
![]() ,
,![]() и характер термодинамического процесса.
Обычно достаточно знать одну из указанных
теплоемкостей, так как они связаны между
собой определенной зависимостью.
Уравнение, связывающее
и характер термодинамического процесса.
Обычно достаточно знать одну из указанных
теплоемкостей, так как они связаны между
собой определенной зависимостью.
Уравнение, связывающее![]() и
и![]() ,
впервые было получено Р. Майером, носит
его имя и может быть получено в явном
виде при помощи уравнения состояния.
,
впервые было получено Р. Майером, носит
его имя и может быть получено в явном
виде при помощи уравнения состояния.
Вычитая получено из второго уравнения первое (11), найдем.
![]() .
.
Используя уравнение состояния идеального газа для определения производной, получим уравнение Майера:
![]() (12)
(12)
Обозначив
![]() ,
из (12) будет иметь:
,
из (12) будет иметь:
![]()
(13)
![]()
Величина
![]() называется показателем адиабаты и
является одной
из важнейших характеристик
термодинамической системы. Важно
заметить,
что величина
называется показателем адиабаты и
является одной
из важнейших характеристик
термодинамической системы. Важно
заметить,
что величина
![]() определяется однозначно только состоянием
системы. Действительно, поскольку с и
с зависят только от состояния системы,
то
определяется однозначно только состоянием
системы. Действительно, поскольку с и
с зависят только от состояния системы,
то
![]() - также функция состояния.
- также функция состояния.
Таким образом, в
случае идеального газа для
определения
теплоемкости необходимо
знать только
![]() или
или![]() и характер термодинамического процесса,
В свою очередь, с и с идеального газа
также зависят от калорического уравнения
состояния, а поэтому и от структуры
системы.
и характер термодинамического процесса,
В свою очередь, с и с идеального газа
также зависят от калорического уравнения
состояния, а поэтому и от структуры
системы.
Для идеального
газа
![]() и
и![]() .
Если калорические уравнения линейны,
то согласно (8) и (9)
.
Если калорические уравнения линейны,
то согласно (8) и (9)![]() и
и![]() не будут зависеть от температуры, в
противном случае будут функциями
температуры.
не будут зависеть от температуры, в
противном случае будут функциями
температуры.
Влияние различных факторов на теплоемкость
Влияние характера процесса. Ранее отмечалось, что тепло является одной из форм энергообмена между термодинамическими системами, и, следовательно, при заданном начальном и конечном состоянии системы количество тепла должно зависеть от характера процесса .
Если количество тепла зависит от характера процесса, то по (13) и теплоемкость также является функцией процесса.
Для оценки степени этого влияния определим величину теплоемкости (1) некоторых характерных процессов:
1)
![]() ,
,![]() (адиабатный процесс)
(адиабатный процесс)
![]() ,
,
2)![]() ,
,![]() (изотермический процесс)
(изотермический процесс)
![]() .
.
Таким образом, влияние характера процесса является наиболее принципиальным для теплоемкости, которая в зависимости от характера процесса может приобретать любые значения.
Аналогичный
результат следует и из уравнений (11).
Поэтому теплоемкость с характеризует
термодинамический процесс, а не состояние
системы. Характеристиками состояния
являются только
![]() и
и![]() ,
определение которых наиболее трудная
и важная задача. Без знания этих
характеристик системы практически
невозможно производить термодинамические
расчеты вообще и вычисление теплоемкости
в частности. Поэтому в дальнейшем будем
определять только эти теплоемкости,
тем более, что влияние структуры и
температуры газа на величину теплоемкости
проявляется только через
,
определение которых наиболее трудная
и важная задача. Без знания этих
характеристик системы практически
невозможно производить термодинамические
расчеты вообще и вычисление теплоемкости
в частности. Поэтому в дальнейшем будем
определять только эти теплоемкости,
тем более, что влияние структуры и
температуры газа на величину теплоемкости
проявляется только через![]() и
и![]() .
.
Влияние структуры
газа на теплоемкость.
Для того чтобы найти численные значения
![]() и
и![]() из (8) или (9), достаточно знать одно из
калорических уравнений, так как вместо
второго можно использовать уравнение
Майера. Обычно по калорическому уравнению
состояния определяется
из (8) или (9), достаточно знать одно из
калорических уравнений, так как вместо
второго можно использовать уравнение
Майера. Обычно по калорическому уравнению
состояния определяется![]() ,
а
,
а
![]() -
из уравнения Майера. Поэтому задача
сводится к установлению зависимости
вида
-
из уравнения Майера. Поэтому задача
сводится к установлению зависимости
вида
![]() .
.
Для определения этой зависимости необходимо знать структуру системы. Классическая (феноменологическая) термодинамика не связана со структурой систем, а оперирует наиболее общими макрофизическими свойствами этих систем. Поэтому она в принципе не позволяет определить уравнения состояния.
Для решения задачи можно воспользоваться методом молекулярно кинетической теории.
Рассмотрим термодинамическую систему, представляющую собой идеальный газ. Внутренняя энергия идеального газа определяется как сумма только лишь энергий движения частиц. Число возможных и независимых движений частиц определяется числом степеней свободы и зависит, таким образом, от структуры системы. Так, число степеней свободы любого свободного жесткого тела в общем случае равно шести: три степени свободы поступательного и три - вращательного движения. Рассматривая молекулы идеального газа как жесткие соединения атомов, а атомы - как материальные точки, получим:
1) для одноатомного газа только три степени свободы поступательного движения, так как энергия всех вращательных движений равна нулю;
2) для двухатомной молекулы пять степеней свободы, так как энергия вращения по оси, совпадающей с линией центров, равна нулю;
3) для трехатомной молекулы в общем случае вое шесть степеней свободы, а для линейной молекулы, как и в случае двухатомной, только пять.
Определим функцию и(Т) для одноатомного газа.
Из курса физики известно, что средняя энергия поступательного движения всех молекул, содержащихся в 1 кг массы газа, равна:
![]() .
.
Так как частицы одноатомного газа имеют лишь поступательные степени свободы, то внутренняя энергия одноатомного газа равна энергии только поступательного движения. Поэтому калорическое уравнение для одноатомного газа будет иметь вид
![]() .
(14)
.
(14)
Для определения двух-, трех- и многоатомных газов необходимо знать распределение энергии по степеням свободы, так как температура характеризует кинетическую энергию только поступательного движения, а молекулы таких газов имеют и вращательные степени свободы.
Наиболее просто предположить, что энергия газа равномерно распределена между всеми степенями свободы. Это положение является основным в классической молекулярно-кинетической теории теплоемкости. Тогда для определения внутренней энергии идеальных газов любой атомности достаточно знать энергию, приходящуюся на одну степень свободы и число степеней свободы.
Энергию
![]() ,
приходящуюся на одну степень свободы
молекул, содержащихся в 1 кг массы газа,
можно определить из (14). Имея в виду
равномерное распределение энергии
между всеми степенями свободы, а также
число степеней свободы одноатомного
газа (три), из (14) получим
,
приходящуюся на одну степень свободы
молекул, содержащихся в 1 кг массы газа,
можно определить из (14). Имея в виду
равномерное распределение энергии
между всеми степенями свободы, а также
число степеней свободы одноатомного
газа (три), из (14) получим![]() .
.
Тогда:
![]() ,
(15)
,
(15)
Таким образом, если считать принятое распределение справедливым, то уравнение (15) также справедливо для идеальных газов любой атомности.
Получив калорическое уравнение идеального газа (1.2.61), определим численное значение теплоемкостей. В соответствии с (8) и (15) для идеального газа получим
![]() ,
(16)
,
(16)
а на основании уравнения Майера:
![]() .
(17)
.
(17)
Значения соответствующих мольных теплоемкостей определятся из (16) и (17) умножением на молекулярный вес:
![]() ;
;
![]() .
.
Из последних уравнений видно, что массовая теплоемкость зависит от структуры газа (i) и рода газа (R), а мольная теплоемкость - только от структуры газа (i).
Вычисленные значения теплоемкостей не всегда хорошо согласуются с экспериментальными:
- для одноатомных газов - хорошо,
- для двухатомных газов при температурах, близких к 0°С удовлетворительно;
- для двухатомных газов при высоких температурах, трех и многоатомных газов при любых температурах не согласуются.
Кроме того, экспериментальные исследования показывают явную зависимость теплоемкости от температуры.
Такое несоответствие между результатами молекулярно-кинетической теории и экспериментальными данными объясняется в основном двумя причинами:
неточностью принятой модели газа;
несправедливостью принципа равномерного распределения энергия по степеням свободы.
Зависимость
теплоемкостей
![]() и
и![]() от
температуры.
При определении структуры газа считалось,
что связь между атомами в молекулах
жесткая. В действительности эти связи
квазиупругие, а поэтому атомы в молекулах
совершают колебательные движения.
Иначе, в молекулах имеются и колебательные
степени свободы. Вели считать, что
энергия равномерно распределяется по
всем степеням свободы, в том числе и
колебательным, то теплоемкость должна
быть кратна
от
температуры.
При определении структуры газа считалось,
что связь между атомами в молекулах
жесткая. В действительности эти связи
квазиупругие, а поэтому атомы в молекулах
совершают колебательные движения.
Иначе, в молекулах имеются и колебательные
степени свободы. Вели считать, что
энергия равномерно распределяется по
всем степеням свободы, в том числе и
колебательным, то теплоемкость должна
быть кратна
![]() ,
что не соответствует экспериментальным
данным. Следовательно, распределение
энергии неравномерно. Более того, это
распределение зависит от температуры,
иначе температура не влияла бы на
теплоемкость. Однако объяснить эту
зависимость классическая
молекулярно-кинетическая теория не в
состоянии. Ее объяснила квантовая теория
теплоемкости. Квантовая теория учитывает
несколько видов внутримолекулярных
движений, в том числе и колебательные.
В соответствии с основным положением
квантовой теории, энергия поглощается
молекулами дискретно, квантами (порциями).
Энергия кванта (
,
что не соответствует экспериментальным
данным. Следовательно, распределение
энергии неравномерно. Более того, это
распределение зависит от температуры,
иначе температура не влияла бы на
теплоемкость. Однако объяснить эту
зависимость классическая
молекулярно-кинетическая теория не в
состоянии. Ее объяснила квантовая теория
теплоемкости. Квантовая теория учитывает
несколько видов внутримолекулярных
движений, в том числе и колебательные.
В соответствии с основным положением
квантовой теории, энергия поглощается
молекулами дискретно, квантами (порциями).
Энергия кванта (![]() )
пропорциональна частоте колебаний. С
увеличением температуры увеличивается
частота колебаний, поэтому увеличивается
энергия, поглощаемая колебательным
движением атомов в молекуле. В результате
с увеличением температуры теплоемкость
возрастает.
)
пропорциональна частоте колебаний. С
увеличением температуры увеличивается
частота колебаний, поэтому увеличивается
энергия, поглощаемая колебательным
движением атомов в молекуле. В результате
с увеличением температуры теплоемкость
возрастает.
При температурах порядка 0°С энергия, идущая на колебательное движение двухатомной молекулы, мала по сравнению с энергией других видов движения. Поэтому в данном случае молекулярно-кинетическая теория дает достаточно удовлетворительный результат. При высоких температурах пренебречь колебательной степенью свободы для газов любой атомности невозможно.
Таким образом, теплоемкость двух-, трех- и многоатомных газов зависит от температуры. Теплоемкость одноатомного газа не зависит от температуры и удовлетворительно определяется молекулярно-кинетической теорией, так как принятая модель достаточно близка к действительной (с точностью до энергии вращения, которая мала), а дополнительные условия о распределении энергии для одноатомного газа не требуются.
Ввиду сложности даже приближенного аналитического определения, теплоемкости двух-, трех- и многоатомных газов обычно задаются в виде таблиц или эмпирических зависимостей.
Таблицы теплоемкостей могут быть составлены по результатам экспериментальных исследований или приближенных аналитических расчетов на основе квантовой теории.
Эмпирические зависимости получают, как правило, в результате аппроксимации экспериментальной зависимости теплоемкости от температуры. В результате аппроксимации зависимость теплоемкости от температуры может быть представлена степенным рядом вида:
![]() ,
(18)
,
(18)
где: с - массовая изохорная или изобарная теплоемкость;
А,В,D,...,F- постоянные коэффициенты, различные для изохорной и изобарной теплоемкостей.
В целях упрощения технических расчетов, чаще зависимость теплоемкости от температуры аппроксимируют не степенным рядом, а линейным законом на таком интервале температур (рис. 1), чтобы ошибка в определении теплоемкости не превышала требуемой. Иначе, производят кусочно-линейную аппроксимацию сложной зависимости. Тогда для каждого интервала температур теплоемкость определится следующим образом:
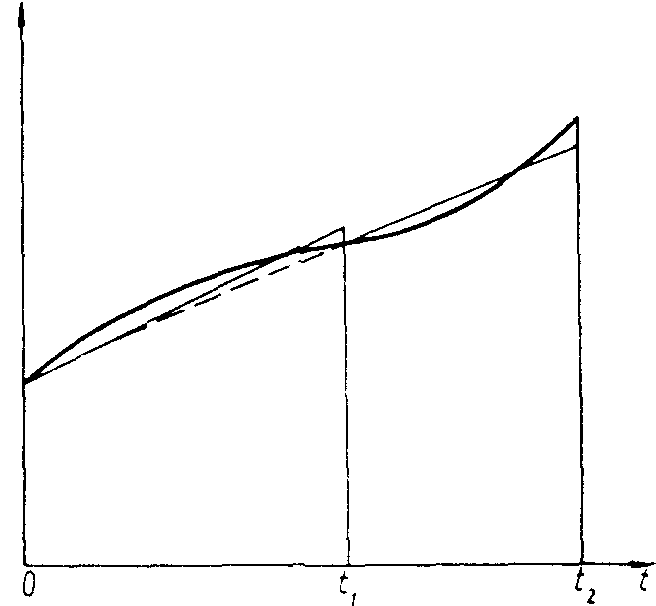
Рисунок 1
![]() ,
(19)
,
(19)
где: Аi , Вi - коэффициенты, зависящие от интервалов температуры.
Использование линейной зависимости облегчает расчеты, обеcпечивая при этом достаточную для технических задач точность.
Аналогичным образом
представляются и мольные теплоемкости,
но
численные значения коэффициентов в
(18) и (19) будут в
![]() раз больше. Поэтому в общем случае можно
записать:
раз больше. Поэтому в общем случае можно
записать:
![]() (20)
(20)
или при кусочно-линейной аппроксимации
![]() (21)
(21)
В заключение заметим, что для реальных газов теплоемкость зависит и от давления. Однако эта зависимость, как правило, слаба и учитывается только в специальных случаях.
Средняя теплоемкость
В соответствии с определением удельной теплоемкости (1), количество тепла, участвующее в произвольном термодинамическом процессе, можно вычислить следующим образом:
![]() .
.
Если вместо
![]() подставить ее значение по (21), а также
иметь в виду, что
подставить ее значение по (21), а также
иметь в виду, что![]() ,
то получим:
,
то получим:
![]() .
.
Зная численные значения коэффициентов, можно вычислить количество тепла. При этом всякий раз необходимо производить интегрирование, что неудобно. Этой операции можно избегать, введя понятие о средней теплоемкости. Действительно, если ввести понятие о средней теплоемкости, то
![]() ,
(22)
,
(22)
где:
![]() - некоторая условная постоянная в
заданном интервале
температур величина,
которая и называется средней
удельной
теплоемкостью.
- некоторая условная постоянная в
заданном интервале
температур величина,
которая и называется средней
удельной
теплоемкостью.
Из (22) следует, что
![]() .
(23)
.
(23)
Из определения ясно, что по своему содержанию средняя теплоемкость весьма условная величина, но, как было замечено, ее использование позволяет упростить расчет количества тепла.
Определим связь между средней и истинной теплоемкостями:
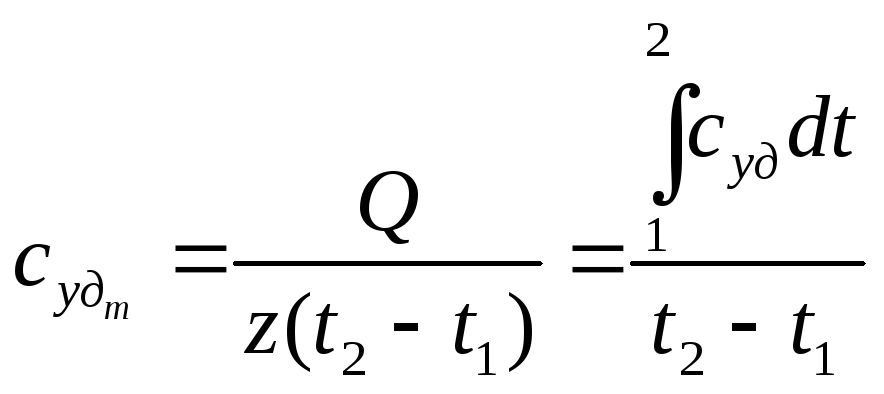 .
.
Подставляя
вместо
![]() интегрирование, получим окончательно
интегрирование, получим окончательно
![]() .
(24)
.
(24)
Таким образом, зная зависимость истинной теплоемкости от температуры, можно легко, без интегрирования, по (24) определить средние теплоемкости в заданном интервале температур.
Тогда количество
тепла определится по формуле (22).
Так,
если масса задана в килограммах, то
![]() :
:
![]() ,
,
![]() ,
(25)
,
(25)
Если числом молей,
то
![]() :
:
![]() ,
,
![]() ,
(26)
,
(26)
Сопоставляя выражения (25) и (26), можно убедиться, что связь между средней мольной и средней массовой теплоемкостями такая же, как и между истинными.
Вычисление средней удельной теплоемкости по формуле (24) не всегда удобно.
Во всех отношениях более удобно пользоваться таблицами средних теплоемкостей, которые могут быть заранее рассчитаны по формулам типа (24) или приближенным аналитическим зависимостям.
Для того, чтобы
можно было рассчитать количество тепла,
необходимое для изменения состояния
тела в любом диапазоне температур,
необходимо иметь теплоемкости
![]() для любого сочетания
для любого сочетания![]() и
и![]() .
Выполнить такие таблицы практически
не представляется возможным, так как
невозможно охватить всевозможные
сочетания температур. Более целесообразно
при составлении таблиц средних
теплоемкостей отсчет вести от какой-либо
фиксированной температуры. Эта температура
принята равной 0°С.
Поэтому в таблицах
приводятся значения средних удельных
теплоемкостей (изохорных и изобарных)
в диапазоне температур от 0°С до
.
Выполнить такие таблицы практически
не представляется возможным, так как
невозможно охватить всевозможные
сочетания температур. Более целесообразно
при составлении таблиц средних
теплоемкостей отсчет вести от какой-либо
фиксированной температуры. Эта температура
принята равной 0°С.
Поэтому в таблицах
приводятся значения средних удельных
теплоемкостей (изохорных и изобарных)
в диапазоне температур от 0°С до
![]() .
.
Как отмечалось,
они могут быть рассчитаны по формулам
типа (24); если считать, что
![]() ,
тогда
,
тогда
![]() .
.
Используя эти средние теплоемкости, можно определить количество тепла, участвующего в процессе при изменении температуры в любом интервале. Действительно,
 .
.
Так, если масса задана в килограммах, то
![]() ,
(27)
,
(27)
если числом молей, то
![]() ,
(28)
,
(28)
где значения
средних теплоемкостей
![]() ,
,![]() берутся
из таблиц для соответствующих значений
температур (приложение, табл.1).
берутся
из таблиц для соответствующих значений
температур (приложение, табл.1).
Теплоемкость смеси газов
В большинстве практических задач рабочим телом служит смесь различного рода газов. Рассматривая квазиравновесные процессы, для которых температуры всех газов в смеси одинаковы, можем записать
![]() ,
(29)
,
(29)
гдб:
![]() - средняя удельная теплоемкостьi-го
газа;
- средняя удельная теплоемкостьi-го
газа;
![]() -
масса i
-го газа, выраженная в соответствующих
единицах (килограммах или молях).
-
масса i
-го газа, выраженная в соответствующих
единицах (килограммах или молях).
С другой стороны, смесь газов можно рассматривать как некоторый фиктивный однородный газ, а поэтому можно также записать
![]() ,
(30)
,
(30)
где:
![]() - общая масса смеси;
- общая масса смеси;
![]() -
средняя удельная теплоемкость смеси.
-
средняя удельная теплоемкость смеси.
Приравняв правые
части выражений (29) и (30) и решая относительно
![]() ,
найдем
,
найдем
![]() ,
(31)
,
(31)
Из (31) видно, что для расчета теплоемкости необходимо знать состав смеси.
При задании смеси массовыми долями:
![]() ,
,
![]() ,
,![]() .
(32)
.
(32)
Мольная теплоемкость вычисляется по формуле (32) умножением обеих частей на молекулярный вес смеси:
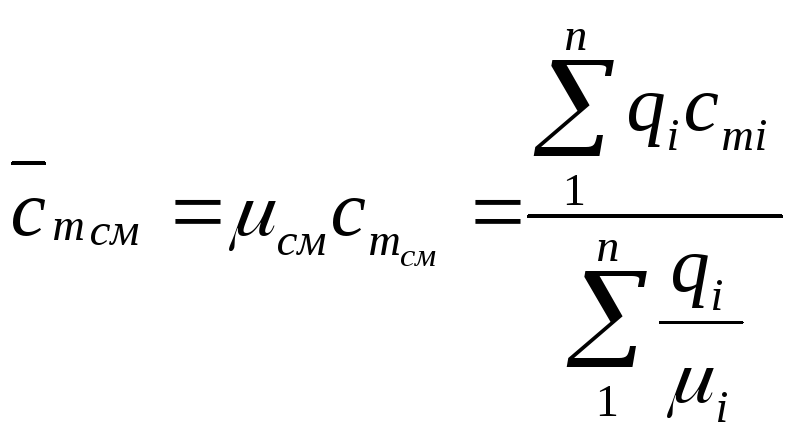 ,
(33)
,
(33)
При задании смеси объемными долями
![]() ,
,
![]()
и тогда
![]() ,
(34)
,
(34)
а средняя массовая теплоемкость смеси определяется соответственно
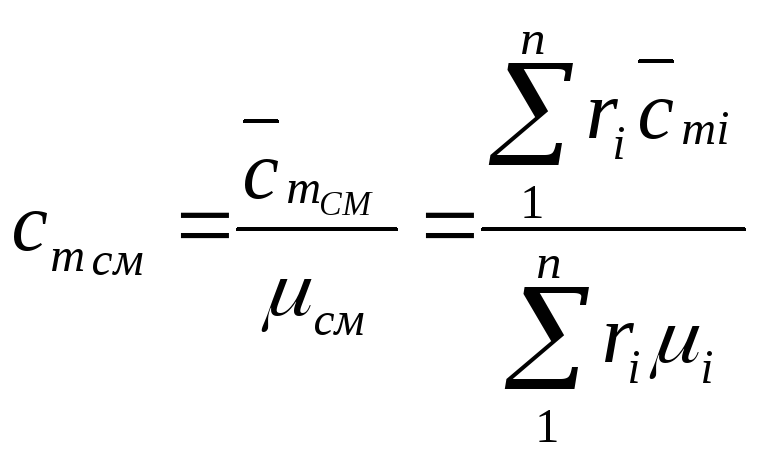 ,
(35)
,
(35)
При известным средним удельным теплоемкостям смеси количество тепла рассчитывается в соответствии с общим выражением (30):
![]() .
(36)
.
(36)
Состав продуктов взрыва, физические и химические взрывы
Химические превращения веществ, протекающие в форма взрыва, характеризуются рядом специфических качественно своеобразных особенностей.
В наиболее широком смысле слова под взрывом понимается чрезвычайно быстрое изменение состояния вещества, сопровождающееся столь же быстрый превращением энергии, которое, как правило, приводит к разогреву, движению и сжатию окружающей среды, возникновению интенсивного скачка давления в месте взрыва к разрушению и разбрасыванию окружающей среди.
Под это общее понятие взрыва можно в одинаковой мере отнести взрывы, обусловленные различными физическими причиной (''физические" взрывы), и взрывы, в основе которых лежат чрезвычайно быстрые химические превращения веществ ("химические" взрывы).
Примерами "физических" взрывов могут служить:
1) Ядерные взрывы, источником которых служит ядерная энергия. Этот вид взрывов может быть искусственно вызван в земных условиях и в широких масштабах протекает в космосе.
2) Взрывы электрической природы, источником которых служит электрическая энергия. Примерами этого вида взрывов могут служить мощные искровые разряды в воздухе (молнии) или взрывы тонких металлических проволочек ври пропускании через них тока высокого напряжения ('взрывающиеся проволочки").
3) Взрывы, происходящие при соударениях тел, движущихся с высокими скоростями (падение крупных метеоритов). Источником взрывов этого вида служит кинетическая энергия движущихся тел, которая при ударе переходит в тепловую энергию, достаточную для превращения части вещества в сильно нагретый газ, что и приводит к взрыву.
4) Взрывы баллонов со сжатым газом, паровых котлов, вулканические взрывы. В этих видах взрывов источником энергии служат сжатые газы.
5) 3емлетрясения - своеобразная форма "физического" взрыва, обусловленного внезапным переходом потенциальное энергии упругих деформаций в энергию движения (перемещения) среды.
Общим для всех видов "физических" взрывов и взрывов химической природы является чрезвычайно быстрый переход потенциальной энергии системы в механическую работу разрушения окружающей среды. Отличие же "химического" взрыва от "физических" взрывов состоит в том, что если при "физических" взрывах изменение химической природы вещества, как правило, не происходит (исключение составляет ядерные взрывы), то "химический'' взрыв - это результат веста быстрого превращения вещества.
В настоящее время "химические" взрывы являются наиболее изученными и имеют важное практическое значение. К химическим взрывам относятся взрывы взрывчатых веществ (ВВ), жидких и твердых топлив, взрывчатых газовых смесей, а также взрывы пылевоздушных или пылекислородных смесей.
Под взрывчатыми веществами (ВВ) понимаются такие вещества, которые, представляя собой неустойчивые в термодинамическом отношении системы, способны под влиянием внешних воздействий к весьма быстрым химическим превращениям, сопровождающиеся выделением энергии и образованием сильно нагретых газообразных продуктов превращения.
Характерными признаками взрывных превращений веществ являются:
а) экзотермичность процесса превращения;
б) способность его к самораспространению по массе исходного вещества;
в) наличие конечного по ширине фронта превращения, перемещающегося с весьма высокой скоростью;
г) образование продуктов взрыва в виде газов и паров.
Необходимо подчеркнуть, что только сочетание указанных признаков определяет возможность протекания химического превращения вещества и форме взрыва, при этом каждый отдельный признак играет свою особую роль в развитии взрывного процесса в целом.
Экзотермичность превращения.
Без выделения энергии в ходе химических реакций возникновение и развитие взрыва вообще не возможно, так как в противной случае потребовался бы непрерывный приток энергии извне. Кроме того, за счет тепло, выделяющегося при взрыве, происходит разогрев газообразных продуктов взрыва до нескольких тысяч градусов и осуществляется последующее разрушительное действие при расширении продуктов превращения вещества.
Экзотермичность процессов превращения ВВ обуславливается различными причинами, главным из которых являются химическое разложение эндотермических соединений и окисление горючих элементов (углерода и водорода) за счет кислорода, содержащегося в молекуле вещества.
Способность реакции к самораспространению. Этот фактор является необходимым условием взрывных превращений, так как только благодаря такому характеру протекания процесса возможно полное, без остатка, превращение вещества и выделение соответствующего количества энергий.
Причиной самораспространения является передача энергии, выделившейся в зоне химических реакций, новым слоям ВВ, которая при взрывных превращениях, в отличие от процессов горения, осуществляется при помощи распространения ударной волны.
Высокая скорость распространения. Для взрывных процессов характерно чрезвычайно быстрое, происходящее за стотысячные м миллионные доли секунды превращение исходного вещества в конечные газообразные продукты взрыва. В результате такого быстрого превращения веществе достигаются чрезвычайно высокая скорость выделения энергии в единице объема высокая мощность взрыва. Высокие скорости распространения взрывных процессов обусловлены тем, что передача энергии новым слоям ВВ для возбуждения в них интенсивной химической реакции осуществляется посредством ударной волны, которая распространяется со скоростью, в несколько раз превосходящей скорость звука к исходном веществе. Для современных ВВ линейная скорость распространения взрыва составляет 4500 - 9000 м/сек.
Газообразование. Высокие давления, возникающие при взрыве, и обусловливаемый ими разрушительный эффект взрыва не могли бы быть достигнуты, если химическая реакция не приводила бы к образованию достаточно большого количества газообразных продуктов. Эти продукты, находящиеся в момент взрыва в чрезвычайно сжатом состоянии (давление газов достигает сотен тысяч атм.), являются тем физическим агентом, в процессе расширения которого осуществляется чрезвычайно быстрый переход потенциальной энергии ВВ в механическую работу разрушения окружающей среды. Значение фактора газообразования можно проиллюстрировать на примере хорошо известной реакции: Fe2O3+2Al→Al2O3+2Fe
Это превращение смеси порошкообразных веществ и окиси железа удовлетворяет первым трем основным признакам взрыва: реакция экзотермична, способна к самораспространению и протекает с довольно высокой скоростью. Однако конечные продукты реакции (Al2O3, Fe) выделяются в конденсированном виде и только поэтому термитная реакция не приводит к взрыву.
Только наличие всех четырех характерных признаков обеспечивает протекание химических превращений в форме взрыва.
Взрывные процессы могут протекать в двух формах: собственно взрыв и детонация. Отличие между ними состоит лишь в том, что собственно взрыв характеризуется переменной скоростью распространения реакции по массе исходного вещество, детонация же представляет стационарную форму взрыва: они характеризуется постоянной и максимально возможной для данного ВВ и данных условий взрыва скоростью распространения.
Явления горения и взрыва имеют много общих черт. Общность их выражается в том, что и для горения и для взрыва характерно сочетание одинаковых признаков, а также в том, что горение какого-либо вещества при наличии определенных условий может переходить во взрыв.
Задачи и основные принципы приближенных методов расчета состава продуктов взрыва ВВ.
Расчет состава продуктов взрыва производится с целью определения их термодинамических параметров и взрывчато-энергетических характеристик ВВ, которые используются для оценки количественных показателей действия взрыва. Так, зная состав продуктов взрыва ВВ, ыоаьи рассчитать теимрй- туру продуктов детонации, удельный объем газообразных продуктов взрыва, скорость детонации ВВ и оценить величину механической работы, которую совершают продукты взрыва.
Рассчитать состав продуктов взрыва значит определить какие вещества и в какой количестве образуются при взрыве 1 моля или 1 кг данного ВВ. Обычно рассчитывается мольный состав продуктов взрыва, т.е. определяется количество молей различных конечных продуктов превращения ВВ, приходящееся на 1 моль исходного вещества.
Состав продуктов взрывчатого превращения ВВ зависит от его элементарного состава и условий протекания химических реакций в процессе взрыва, в частности, от плотности и размеров заряда ВВ, способа инициирования взрыва и других факторов. Иными словами говоря, состав продуктов взрыва данного ВВ не является однозначной функцией его элементарного состава. Иллюстрацией этому выводу могут служить данные по составу продуктов взрыва тротила, полученные опытным путем при взрывах тротила, инициированных импульсами различной интенсивности (табл. 1)
Таблица 1
|
Условия взрыва |
Состав продуктов взрыва, г-моль/кг | |||||||||
|
С |
СО2 |
СО |
Н2О |
Н2 |
СН4 |
N2 |
НСN |
C2N2 |
NH3 | |
|
Слабый импульс |
6,60 |
1,78 |
18,63 |
4,25 |
5,34 |
0,10 |
4,74 |
1,10 |
1,20 |
0,30 |
|
Сильный импульс |
15,00 |
5,30 |
8,79 |
7,05 |
1,69 |
0,03 |
5,20 |
1,40 |
0,10 |
0,90 |
Сущность приближенных методов расчета состава продуктов взрыва состоит в том, что они в большинстве случаев отвлекаются от влияния различных внешних факторов и исходят только из элементарного состава ВВ и предварительной качественной оценки состава продуктов его взрывчатого превращения.
Как уже отмечалось, большинство ВВ состоит из элементов С, Н, О и N. Наиболее характерными продуктами превращения таких веществ могут быть газы СО2, Н2О, СО, Н2, N2, О2 и углерод в свободном виде. В незначительных количествах могут образоваться также газы NО, СН4, NH3, C2N2 и некоторые другие.
Между указанными продуктами взрыва после их образования могут протекать различные реакции, которые в конечном счете и определяют окончательный состав продуктов превращения ВВ. Важнейшими из этих реакций являются:
Реакция диссоциации углекислоты
2СО2↔2СО+О2
2) Реакция диссоциации водяного пара
2Н2О↔2Н2+О2
3) Реакция водяного газа
СО+Н2О↔ СО2+ Н2
4) Реакция Будуара
2СО↔ СО2+С
5) Реакция образования окиси азота
N2+ О2↔ 2NО
Последняя реакция, как установлено исследованиями, получает заметное развитие лишь при очень высоких температурах взрыва и поэтому для большинства ВВ она не имеет существенного значения. Роль других реакций в определении конечного состава продуктов взрыва зависят от элементарного состава ВВ (прежде всего, от величины кислородного коэффициента) и условий взрыва.
Если ВВ имеет положительный или нулевой кислородный баланс (А>100%), то направление реакций взрывчатого превращения вещества соответствует принципу максимального тепловыделения: в продуктах взрыва будут содержаться в основном продукты полного окисления горючих элементов (СО2, Н2О) и газы О2 и N2. Реакции образования окиси азота и диссоциации воды для таких ВВ не имеют существенного значения. Однако реакция диссоциации углекислоты может получить заметное развитие и её приходится учитывать.
При взрыве ВВ с отрицательным кислородным балансом, относящихся к ВВ 2-ой группы, значительную роль в определении состава продуктов взрыва начинает играть как реакция диссоциации углекислоты, так и реакция диссоциации водяного пара. В связи с этим в продуктах взрыва таких ВВ, наряду с продуктами ВВ, наряду с продуктами полного окисления, будут содержаться газы СО и Н2. Соотношение между основными компонентами продуктов взрыва: СО2, СО, Н20 и Н2 в данном случай регулируется реакцией водяного газа.
Если ВВ относится к 3-ей группе, то при расчете состава продуктов взрыва приходится учитывать не только реакцию водяного газа, но и реакцию Будуара.
Методы расчета состава продуктов взрыва, построенные по атому принципу, позволяют достаточно точно вычислить количество каждого компонента продуктов взрыва, если предварительная оценка их качественного состава окажется правильной. Однако использование таких методов расчета связано с введением в некоторые исходные уравнения численных значений констант равновесия тех реакции диссоциации, которые учитываются в расчете. Последние же в большинства случаев оказываются определенными не достаточно точно, что вызывает сомнения в достоверности результатов расчета. В связи с этим в практике расчетов характеристик ВВ, вместо методов, основанных на учете тех или иных определяющих реакций диссоциации, получили широкое применение более простые приближенные методы расчета состава продуктов взрыва ВВ.
